- Вода кипит при 100 градусах
- Непостоянная величина, или какова температура кипения воды
- Что это такое?
- От чего зависит?
- Чему равна в нормальных условиях?
- Почему H2O закипает именно при 100 градусах?
- Может ли кипеть при нагреве более или менее 100С?
- Заключение
- Вода, пар и перегретый пар
- Найдены возможные дубликаты
- Что опаснее: обжечься 100-градусным паром или 100-градусной водой?
Вода кипит при 100 градусах
Обычная вода закипает при 100 градусах — в справедливости этого утверждения мы не сомневаемся, а градусник легко это подтверждает. Однако есть люди, которые могут скептически улыбнуться, так как знают — вода не всегда и не везде кипит ровно при 100 градусах.
А разве такое возможно? Да, возможно, но только при определенных условиях.
Сразу нужно сказать, что вода может закипать при температурах как ниже, так и выше +100 °С. Так что не стоит удивляться выражению «Вода вскипела при + 73 °С» или «Кипение воды началось при +130 °С» — обе эти ситуации не просто возможны, но и относительно легко осуществимы.
Но, чтобы понять, как достичь только что описанных эффектов, необходимо разобраться в механизме кипения воды и любых других жидкостей. 
При нагреве жидкости у дна и на стенках сосуда начинают образовываться пузырьки, наполненные паром и воздухом. Однако температура окружающей воды слишком мала, отчего пар в пузырьках конденсируется и сжимается, а под давлением воды эти пузырьки лопаются. Данный процесс происходит до тех пор, пока весь объем жидкости не прогреется до температуры кипения — в этот момент давление пара и воздуха внутри пузырей сравнивается с давлением воды. Такие пузырьки уже способны подняться к поверхности жидкости, выпустив там пар в атмосферу — это и есть кипение. Во время кипения температура жидкости больше не поднимается, так как наступает термодинамическое равновесие: сколько тепла потрачено на нагрев, столько же тепла и отводится паром с поверхности жидкости.
Ключевой момент в закипании воды и любой другой жидкости — равенство давления пара в пузырях и давления воды в сосуде. Из этого правила можно сделать простой вывод — жидкость может закипать при совершенно разных температурах, а добиться этого можно изменением давления жидкости. Как известно, давление в жидкостях складывается из двух составляющих — ее собственного веса и давления воздуха над ней. Получается, что снизить или повысить температуру кипения воды можно изменением атмосферного давления либо давления внутри сосуда с подогреваемой жидкостью.
В действительности так и происходит. Например, в горах кипяток вовсе не так горяч, как на равнинах, — на высоте 3 км, где давление воздуха падает до 0,7 атмосферы, вода закипает уже при +89,5 градусов. А на Эвересте (высота — 8,8 км, давление — 0,3 атмосферы) вода закипает при температуре чуть больше +68 градусов. Да, приготовление пищи при таких температурах — дело весьма трудное, и если бы не специальные средства, то на таких высотах это было бы и вовсе невозможно.
Чтобы повысить температуру кипения, необходимо поднять давление атмосферы или хотя бы плотно закрыть сосуд с водой. Этот эффект используется в так называемых скороварках — плотно закрытая крышка не дает выходить пару, из-за чего давление в ней повышается, а значит, растет и температура кипения. В частности, при давлении в 2 атмосферы вода закипает только при +120 градусах. А в паровых турбинах, где поддерживается давление в десятки атмосфер, вода не закипает и при +300-400 °С!
Однако существует еще одна возможность нагрева воды до больших температур без кипения. Замечено, что образование первых пузырьков начинается на шероховатостях сосуда, а также вокруг более или менее крупных частиц присутствующих в жидкости загрязнителей. Поэтому если нагревать абсолютно чистую жидкость в идеально отполированном сосуде, то при нормальном атмосферном давлении можно заставить эту жидкость не вскипать при очень высоких температурах. Образуется так называемая перегретая жидкость, отличающаяся крайней нестабильностью — достаточно минимального толчка или попадания пылинки, чтобы жидкость мгновенно вскипела (а на деле — буквально взорвалась) сразу во всем объеме.
Обычную воду при некоторых усилиях можно нагреть до +130 °С и она не вскипит. Для получения больших температур уже необходимо применение особого оборудования, но предел наступает при +300 °С — перегретая вода при такой температуре может существовать доли секунды, после чего происходит взрывоподобное вскипание.
Интересно, что перегретую жидкость можно получить и иным способом — подогреть ее до относительно низких температур (чуть ниже +100 °С) и резко понизить давление в сосуде (например, поршнем). В этом случае также образуется перегретая жидкость, способная вскипеть при минимальном воздействии. Данный метод используется в пузырьковых камерах, регистрирующих заряженные элементарные частицы. При пролете сквозь перегретую жидкость частица вызывает ее локальное вскипание, а внешне это отображается как возникновение трека (следа, тонкой черточки) из микроскопических пузырьков. Однако в пузырьковых камерах применяется отнюдь не вода, а различные сжиженные газы.
Итак, вода далеко не всегда закипает при +100 °С — все зависит от давления внешней среды или внутри сосуда. Поэтому в горах без специальных средств нельзя получить «нормальный» кипяток, а в котлах тепловых электростанций вода не кипит даже при +300 °С.
Источник
Непостоянная величина, или какова температура кипения воды
Кипение воды без ее нагревания – явление обыденное. Его обязательно демонстрировали на школьных уроках физики.
Как же можно достичь кипения воды, не прибегая к воздействию на нее температуры, и почему это возможно – целевые вопросы, затрагиваемые в этой публикации.
Что это такое?
Температура кипения воды – это граница ее фазового перехода из жидкого состояния в газообразное (пар). Причем в этот момент все тепло поглощается этим пограничным процессом, не позволяя воде продолжать греться. Она не нагревается выше 100С, в отличие от пара.
От чего зависит?
Это параметр зависим от следующих факторов:
 Нагрев. Он заставляет молекулы воды двигаться быстрее, постепенно уравнивая давление ее насыщенного пара с атмосферным.
Нагрев. Он заставляет молекулы воды двигаться быстрее, постепенно уравнивая давление ее насыщенного пара с атмосферным. При достаточном нагревании их значения выравниваются. В этот момент вода начинает кипеть.
Чему равна в нормальных условиях?
Состояние, при котором давление составляет 760 мм. рт. ст (101,325 кПа) при 0С, принимают нормальным. Чистая вода в таком состоянии закипает при 100С.
Почему H2O закипает именно при 100 градусах?
Нагрев приводит к отделению растворенного воздуха от H2O и образованию микроскопических пузырей. Чем горячее она становится, тем больше вырастает их объем и количество. При этом их пространство заполняется паром, давление которого также растет.
Постепенно пар становится насыщенным. Пузыри укрупняются и, ускоряясь, покидают воду.
Этому процессу свойственны следующие этапы:
образование мелких пузырьков и их группировка на дне и стенках емкости;
- рост количества и объема пузырей, а также скорости их подъема на поверхность, что сопровождается характерным звуком;
- массовое всплытие и ускорение движения пузырьков вызывает усиление звука бурления и изменение его тональности.
На последней стадии объем паровых пузырей максимален. Давление пара и атмосферы соизмеримы, что и провоцирует фазовый переход и сильное бурление. Если значение давления атмосферы близко к нормальному, то описанный процесс протекает именно при 100С.
Может ли кипеть при нагреве более или менее 100С?
Из вышесказанного следует утвердительный ответ. Достаточно искусственно повысить давление, окружающее воду, или растворить в ней какое-нибудь вещество. Опыт показывает, что температура кипения воды повысится на 1С при добавлении в ее состав 40 граммов пищевой соли.
Напротив, в разряженном воздухе температура закипания снижается (ориентировочно около 0,2С на каждые 5 мм. рт. ст.).
Заключение
Теперь можно утверждать, что температура кипения воды не является незыблемой константой. Поэтому неудивительно, что на Эвересте она составляет порядка 69 градусов. Напротив, океаническая вода закипает только при 101С по причине своей солености.
Каноническое же значение, равное 100С, подразумевает проведение измерения с кристально чистой H2O и нормальным давлением. Разумеется, соблюсти оба требования на практике принципиально невозможно.
Источник
Вода, пар и перегретый пар
Несколько дней назад на пикабу был пост http://pikabu.ru/story/travma_ot_zhidkosti_pod_davleniem_410. про жидкость и высокое давление. В комментариях я упоминул, так же, перегретый пар и тема вызвала некоторый интерес, поэтому я решил поподробней рассказать про пар и перегретый пар.
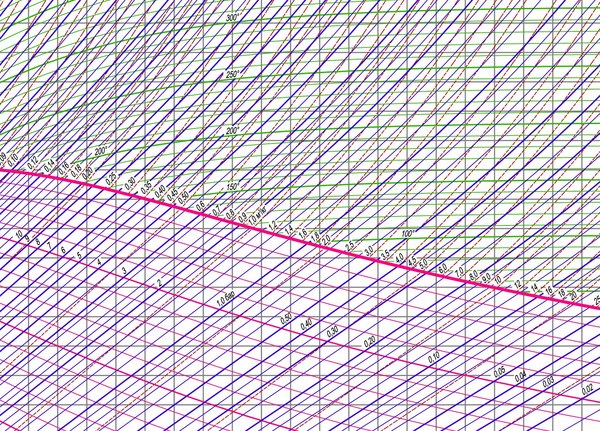
Итак, все прекрасно знают и понимают, что такое пар — это состояние воды при температуре 100 градусов и атмосферном давлении. Если вы не прогуливали физику в школе, то должны помнить, что при увеличении давления, растет температура кипения воды. И наоборот — при понижении давления температура кипения воды снижается. Зависимость температуры кипения от давления давно изучена, рассчитана и занесена в справочники — т.н. таблицы состояния воды и водяного пара, а так же эту зависимость можно отследить на диаграмме. Вот небольшой ее фрагмент:
Нас интересуют линии трех цветов на диаграмме. Синяя линия — это давление. Зеленая — температура. А жирная розовая линия — это степень сухости, т.е. линия насыщения. В точке пересечения зеленой и синей линий с розовой можно определить параметры, при которых вода закипит. Все пространство под жирной линией — обычная вода. Все, что на линии — пар. Все, что выше этой линии — уже перегретый пар.
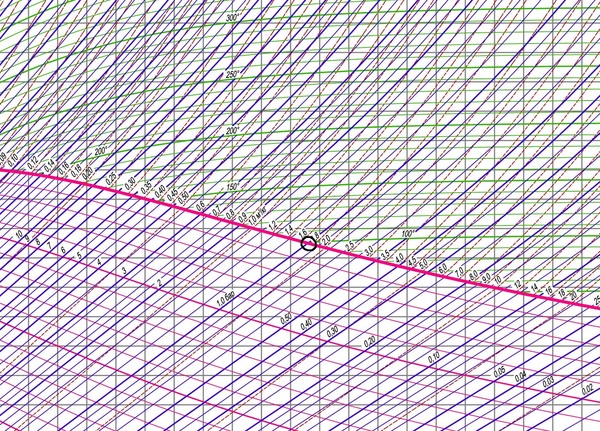
Таким образом при давлении 1 бар получаем температуру кипения 100 градусов:
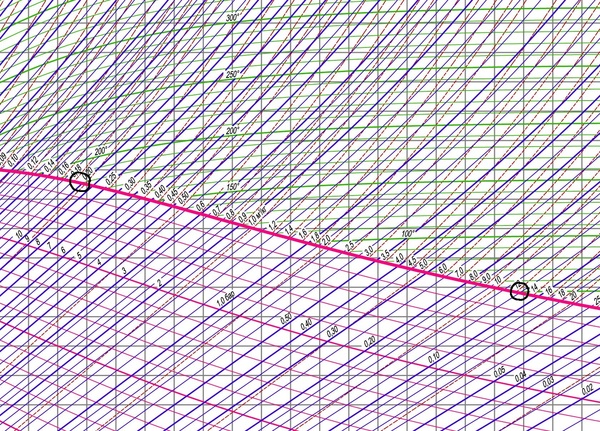
При давлении, например 0,12 бар, имеем температуру кипения 50 градусов. А при давлении 10 бар имеем температуру кипения 180 градусов:
Это, немного нудное введение, помогает понять, что в зависимости от параметров, состояние и характеристика самого пара могут меняться. Пар при температуре насыщения мы прекрасно видим, знаем что он очень горячий и от него нужно держаться подальше. Но при перегреве, он (пар) становится невидимым и представляет огромную опасность для человека. @Skywrtr вот наглядный пример из детской передачи:
В упомянутом выше посте, я говорил о том, что если на производстве вдруг происходит утечка перегретого пара в относительной близости от вас, а вы все еще живы, то лучше повременить с бегством, потому что можно попасть под воздействие той самой невидимой струи. Конечно, это в том случае, если утечка не велика, например где-то выдавило прокладку. В противном случае, при нахождении в непосредственной близости, вам уже вряд ли помогут:
Все видео взято с ютуба, в пейнте рисовал сам=) Мой первый длиннопост. Если в тексте есть ошибки, прошу на них указать, ибо инженер должен быть грамотным и владеть родным языком. БМ ругался на «нежность» и «Тимошенко» XD. Судите сами.
Найдены возможные дубликаты
Как бывший электрик на котельной, могу сказать, что утечку перегретого пара не только ВИДНО, но и СЛЫШНО! Несмотря на шум котельного оборудования, свист протечки вполне слышно. И да, прокладки паронитовые не выдавливает, происходит струйный пробой между прокладкой и фланцем. А почему пробой и видно? Да потому, что температура пара падает, когда он вырывается из паропровода.
Полностью согласен. При таком давлении и температуре растёт толщина стенок трубопроводов или качество метала и защищать от излучения их нужно.
Ну у меня в цеху стоит БГМ 35-М, и 2 БЭМ, Ну на выходе с котлов около 36-38 кг и температура 410 на выходе,
12 кг, около 200 градусов, три котла ДКВР. На высоком давлении не работал, но, думаю, свистит не хило, если протекает) Думаю, при таком давлении струя режет конструкции на своем пути.
Ого еще какие дедушки работают, у нас лет 6 назад пломбы повесили
твоя правда, но к сожалению не все написано в ТБ
Для пикабу-сообщества на мой взгляд всё прекрасно написано. А раз уж Вы выложили эту диаграмму, расскажите теперь что на ней изображено, что такое адиабаты, изохоры и изобары, чем отличаются энтальпия и энтропия, что такое удельная теплота фазового перехода и т.д. и т.п.
попытаюсь объяснить. адиабата — линия, которая показывает процесс изменения состояния среды без теплообмена с внешней средой. изохора — при постоянном объеме, изобара — при постоянном давлении. энтальпия — это величина, которая показывает, сколько теплоты содержит 1 кг вещества в данных условиях. термодинамику я учила плохо, поэтому честно признаюсь, не могу точно сформулировать, что такое энтропия. стыдно. да, привет, андрей олегович.
удельная теплота фазового перехода — это сколько теплоты необходимо сообщить 1кг или 1м^3 вещества, чтобы оно совершило фазовый переход — из твердого в жидкое состояние, например.
например, если кусочку льда непрерывно сообщать какую-то энергию, то, нагревшись до 0 градусов, он будет плавиться без изменения температуры — вся эта энергия будет уходить не на нагрев, а на разрушение кристаллической решетки. только после того, как он расплавится, уже вода будет продолжать нагреваться. возвращаясь к определению, это та самая теплота, которая ушла на разрушение кристаллической решетки.
Кстати, благодаря тому, что для фазового перехода требуется дополнительная энергия, можно проверять китайские кухонные термометры. Берем полстакана холодной воды, кидаем туда много льда, опускаем термометр. Ждем наименьшей температуры, лед охладит воду до нуля и пока весь лед не растает вода так и будет при температуре 0 градусов. Можно наоборот, взять стакан, насыпать туда льда из морозилки, подождать пока лед начнет таять и опустить в талую воду термометр, вот вам истинный нуль по цельсию. Пока весь лед не растает температура воды не поднимется.
Энтропия — мера беспорядка и хаоса, эффь. Тоже толком не понимаю что это и как использовать.
Источник
Что опаснее: обжечься 100-градусным паром или 100-градусной водой?
Это то же самое, что отвечать на вопрос, что тяжелее килограмм ваты или килограмм железа.
По той простой причине, что нужно знать условия, при которых произошел ожег. Если дунул пар и вы отскочили, или плеснуло водой и вы отошли, то это одно дело. Тогда обжечься водой опаснее. По той простой причине, что масса пара меньше массы воды, которая на вас выльется. А теплоемкость воды выше. Ожог будет сильнее. А если вас бросили в бассейн с горячей водой, то вы умрете мгновенно, а вот в парной, где температура пара более 100 градусов, вы будете чувствовать себя некоторое время весьма неплохо.
В такой абстрактной форме, надо понимать, что вопрос относится к физике явления, а не медицинским аспектам?
Пар, касаясь кожи, будет на ней конденсироваться, и при конденсации выделять дополнительную теплоту. Следовательно, при прочих равных условиях ожог от пара опаснее.
Паром как ни странно обжечься опаснее, чем водой. Если на кожу попадает 100 градусная вода, то при теплообмене её температура понижается очень быстро. С паром дела обстоят по-другому. Он проникает в глубь кожи, и свою температуру не теряет дольше. Да и внутренняя энергия пара выше, чем воды.
По тяжести и глубине ожога будет одинаково, только пар, как правило, охватывает большую площадь, чем вода, то есть, ожоги будут более обширные. Если пар вырвался с давлением, то ожоги будут глубже, чем ожоги от кипящей воды.
Источник
 образование мелких пузырьков и их группировка на дне и стенках емкости;
образование мелких пузырьков и их группировка на дне и стенках емкости;