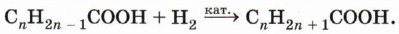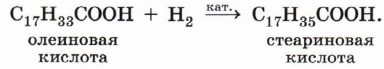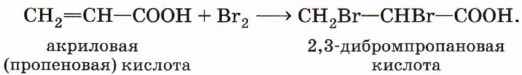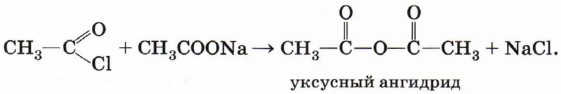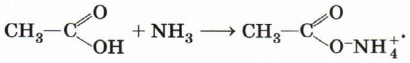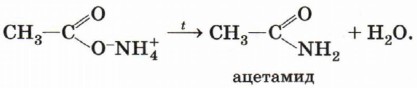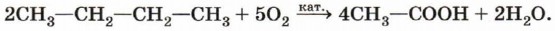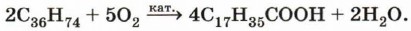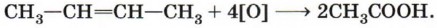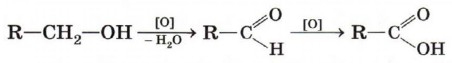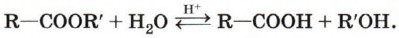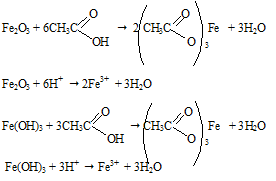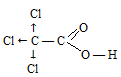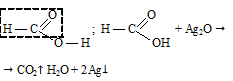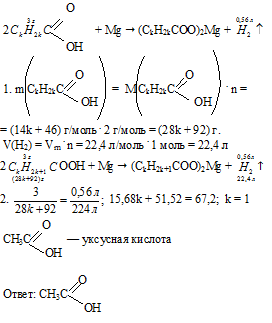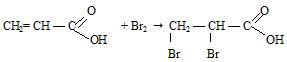Карбоновые кислоты
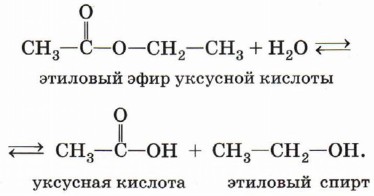
В реакции, обратной этерификации, которая называется гидролизом сложного эфира (взаимодействие сложного эфира с водой), образуются карбоновая кислота и спирт:
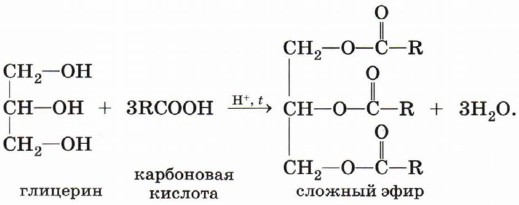
Очевидно, что реагировать с карбоновыми кислотами, т. е. вступать в реакцию этерификации, могут и многоатомные спирты, например глицерин:
В молекулах карбоновых кислот (кроме муравьиной) наряду с карбоксильной группой содержится углеводородный остаток. Безусловно, это не может не сказаться на свойствах кислот, которые определяются характером углеводородного остатка.
7. Реакции присоединения по кратной связи характерны для непредельных карбоновых кислот. Реакцию присоединения водорода (гидрирование) для кислоты, содержащей в радикале одну π -связь, можно записать в общем виде:
Например, при гидрировании олеиновой кислоты образуется предельная стеариновая кислота:
Непредельные карбоновые кислоты, как и другие ненасыщенные соединения, присоединяют галогены по двойной связи. Так, например, акриловая кислота обесцвечивает бромную воду:
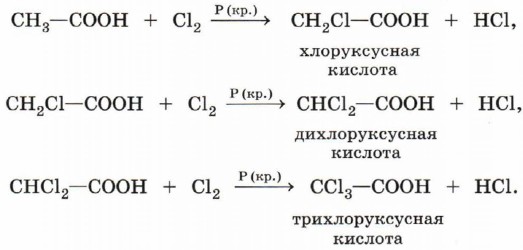
8. Реакции замещения (с галогенами) характерны для предельных карбоновых кислот. Например, при взаимодействии уксусной кислоты с хлором могут быть получены различные хлорпроизводные:
При галогенировании карбоновых кислот, содержащих более одного атома углерода в углеводородном остатке, возможно образование продуктов с различным положением галогена в молекуле. При протекании реакции по свободнорадикальному механизму могут замещаться разные атомы водорода в углеводородном остатке. Если же реакцию проводить в присутствии небольших количеств красного фосфора, то она идёт селективно и водород замещается лишь в α-положении (у ближайшего к функциональной группе атома углерода) в молекуле кислоты.
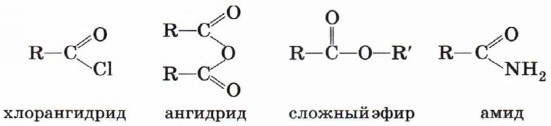
Производные карбоновых кислот
Карбоновые кислоты образуют различные функциональные производные при замещении гидроксильной группы.
При гидролизе из этих производных вновь образуется карбоновая кислота.
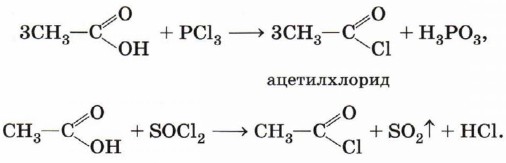
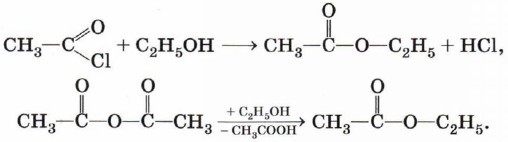
Хлорангидрид карбоновой кислоты можно получить, воздействуя на неё хлоридом фосфора (III) или тионилхлоридом (SOCl2):
Ангидриды карбоновых кислот получают взаимодействием хлорангидридов с солями карбоновых кислот:
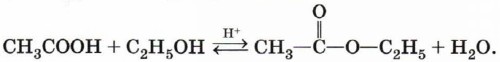
Сложные эфиры образуются в результате этерификации карбоновых кислот спиртами. Этерификация катализируется неорганическими кислотами:
Сложные эфиры могут быть получены также из хлорангидридов и ангидридов карбоновых кислот:
При взаимодействии карбоновых кислот с аммиаком образуются аммониевые соли карбоновых кислот:
Эти соли при нагревании отщепляют воду, превращаясь в амиды:
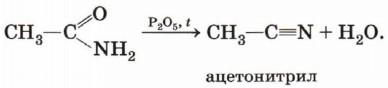
При нагревании амидов кислот с водоотнимающими средствами, например с фосфорным ангидридом, образуются нитрилы:
Способы получения карбоновых кислот
Реакции окисления
Окисление алканов. Ряд карбоновых кислот в промышленности получают окислением предельных углеводородов. Практическое значение имеет каталитическое окисление метана до муравьиной кислоты. При окислении других алканов происходит разрыв углеродной цепи (примерно посередине). Например, при каталитическом окислении бутана получают уксусную кислоту:
Практическое значение имеет окисление твёрдых алканов (парафинов). При этом углеводороды с длинной цепью (> С25) под действием кислорода воздуха в жидкой фазе в присутствии солей тяжёлых металлов превращаются в смесь карбоновых кислот с длиной цепи С12—С18, которая используется для получения мыла и других поверхностно-активных соединений:
Окисление алкенов. Алкены с неразветвлённой углеродной цепочкой окисляются по месту двойной связи с образованием карбоновых кислот:
В качестве окислителя можно использовать кипящий раствор перманганата калия или кислород воздуха в присутствии катализатора.
Окисление аренов. Ароматические карбоновые кислоты образуются при окислении гомологов бензола (см. §15):
В лабораторных условиях в качестве окислителя используют перманганат калия при нагревании.
Окисление первичных спиртов и альдегидов. Первичные спирты при окислении сначала превращаются в альдегиды и далее в карбоновые кислоты. Естественно, что в качестве исходных веществ в реакцию можно брать и альдегиды.
В качестве окислителей используются растворы перманганата или дихромата калия (КМnO4 или К2Сr2О7), раствор оксида хрома (VI) в серной кислоте.
Реакции гидролиза
Карбоновые кислоты можно получить реакциями гидролиза их производных или тригалогеналканов.
Гидролиз сложных эфиров. При гидролизе сложных эфиров образуются спирт и карбоновая кислота. Как уже отмечалось выше, реакции этерификации и гидролиза, катализируемые кислотой, обратимы:
Гидролиз сложного эфира под действием водного раствора щёлочи протекает необратимо. В этом случае из сложного эфира образуется не кислота, а соль:
R—COOR’ + NaOH → R—COONa + R’OH.
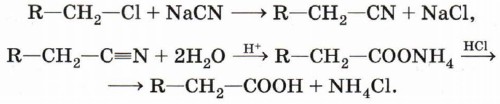
Гидролиз нитрилов. Карбоновые кислоты могут быть получены гидролизом их многочисленных производных. Однако с целью синтеза карбоновых кислот используют лишь гидролиз нитрилов, поскольку остальные производные сами получаются из кислот.
Напомним, что получение нитрилов с их последующим гидролизом позволяет увеличить длину углеродной цепочки на один атом.
Гидролиз тригалогеналканов. Взаимодействие производных предельных углеводородов, содержащих три атома галогена у концевого углеродного атома, с водными растворами щелочей позволяет получить монокарбоновые кислоты. Упрощённо уравнение реакции можно записать следующим образом:
Источник
Строение и свойства карбоновых кислот
Непредельные карбоновые кислоты
Вопрос 1.
Элаидиновая кислота (транс-9-октадеценовая кислота)
Сокращенная структурная формула элаидиновой кислоты:
Структурная формула элаидиновой кислоты:
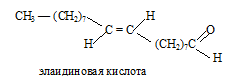
Жирные карбоновы кислоты
Вопрос 2.
В результате реакции гидрирования олеиновой кислоты получается стеариновая кислота:
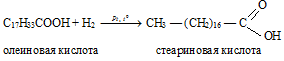
Вопрос 3.
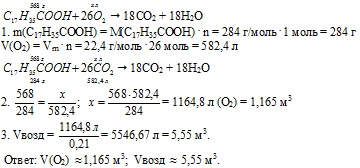
Вопрос 4.
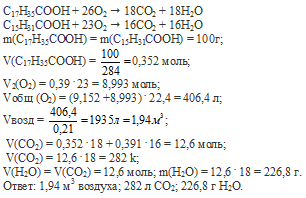
Вопрос 5.

Свойства и применение карбоновых кислот
Вопрос 6.
Если обработать раствором кислоты пятно ржавчины, то оно исчезает, так как происходит химическая реакция, ржавчина превращается в растворимый ацетат железа (III), а с водой ни Fe2O3, ни Fe(OH)3 не реагируют, поэтому пятна не удаляются.
Вопрос 7.
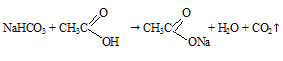
Образование пены можно объяснить бурным выделением пузырьков углекислого газа, выделяющегося при реакции кислоты и соды.
Вопрос 8.
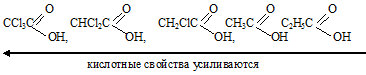
Это можно объяснить строением молекул.
Атомы хлора, как более электроотрицательные, по сравнению с атомами углерода, кислорода и водорода, оттягивают электронную плотность на себя, тем самым не позволяя радикалу компенсировать недостаток электронной плотности на атоме углерода, входящему в состав карбоксильной группы, вследствие чего связь О—Н более полярна.
Так как в состав последующих кислот входит меньшее количество атомов хлора, следовательно, связи
О—Н в них менее полярны и кислоты с уменьшением количества атомов хлора становятся слабее:
Пропионовая кислота слабее этановой, так как радикал C2H5 — обладает большим +I эффектом, чем СН3 —, т. е. больше отталкивает от себя электронную плотность и связь O—H становится менее полярна по сравнению с таковой в этановой кислоте.
Вопрос 9.
Так как в молекуле муравьиной кислоты отсутствует углеводородный радикал и присутствует альдегидная группа, то она вступает в «реакцию серебряного зеркала»:
В результате реакции выделяется углекислый газ.
Вопрос 10.
Характерным признаком произошедшей реакции является изменение окраски осадка: был голубой осадок Cu(OH)2, а выпал красный осадок Cu2O.
Вопрос 11.

Вопрос 12.
Даже в отсутствие катализатора акриловая кислота обесцвечивает бромную воду:
Пропионовая кислота в обычных условиях не реагирует с бромом.
Вопрос 13.
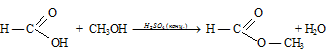
Вопрос 14.
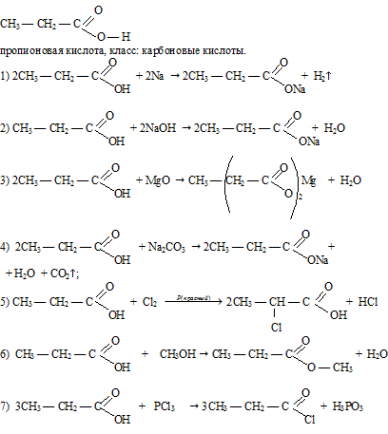
Вопрос 15.
Веществом «А» является:
Источник