- Активные металлы список с водой
- Какие металлы реагируют с водой?
- Активные металлы
- Положение в таблице Менделеева
- Свойства
- Что мы узнали?
- Активные металлы – список в химии, таблица ряда
- Положение в таблице Менделеева
- Свойства
- Что мы узнали?
- Активные металлы
- Положение активных металлов в таблице Менделеева
- Свойства щелочных металлов
- Свойства щелочноземельных металлов
- Подведение итогов
Активные металлы список с водой
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ
Вода является очень слабым электролитом, однако в процессе диссоциации ее молекул, хоть и в небольшом количестве, образуются ионы водорода:
H2O 
Образующиеся ионы Н + способны окислять атомы металлов, расположенных в ряду активности до водорода, восстанавливаясь до молекулярного водорода:
Следовательно, продуктом восстановления при взаимодействии любого металла (если он стоит в ряду активности левее водорода) с водой будет газообразный водород. Состав же продукта окисления зависит от активности металла и условий протекания реакции.
Активные металлы энергично взаимодействуют с водой при обычных условиях по схеме:
Продуктом окисления металла является его гидроксид – Me ( OH ) n (где n -степень окисления металла).
Металлы средней активности взаимодействуют с водой при нагревании по схеме:
2Me + nH2O 
Продукт окисления в таких реакциях – оксид металла Me 2 On (где n -степень окисления металла).
3 Fe + 4 H 2 O пар 
Источник
Какие металлы реагируют с водой?
Прежде всего следует запомнить, что металлы делят в целом на три группы:
1) Активные металлы: к таким металлам относятся все щелочные металлы, щелочноземельные металлы, а также магний и алюминий.
2) Металлы средней активности: к таковым относят металлы, расположенные между алюминием и водородом в ряду активности.
3) Малоактивные металлы: металлы, расположенные в ряду активности правее водорода.
В первую очередь нужно запомнить, что малоактивные металлы (т.е. те, что расположены после водорода) с водой не реагируют ни при каких условиях.
Щелочные и щелочноземельные металлы реагируют с водой при любых условиях (даже при обычной температуре и на холоде), при этом реакция сопровождается выделением водорода и образованием гидроксида металла. Например:
Магний из-за того, что покрыт защитной оксидной пленкой, реагирует с водой только при кипячении. При нагревании в воде оксидная пленка, состоящая из MgO, разрушается и находящийся под ней магний начинает реагировать с водой. При этом реакция также сопровождается выделением водорода и образованием гидроксида металла, который, однако, в случае магния нерастворим:
Алюминий так же, как и магний, покрыт защитной оксидной пленкой, однако в этом случае кипячением ее разрушить нельзя. Для ее снятия требуются либо механическая чистка (каким-либо абразивом), либо ее химическое разрушение щелочью, растворами солей ртути или солей аммония:
Металлы средней активности реагируют с водой лишь тогда, когда она находится в состоянии перегретого водяного пара. Сам металл при этом должен быть нагрет до температуры красного каления (около 600-800 о С). В отличие от активных металлов, металлы средней активности при реакции с водой вместо гидроксидов образуют оксиды металлов. Продуктом восстановления и в этом случае является водород:
Fe + H2O = FeO + H2 (в зависимости от степени нагрева)
Источник
Активные металлы

Средняя оценка: 4.4
Всего получено оценок: 879.
Средняя оценка: 4.4
Всего получено оценок: 879.
Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
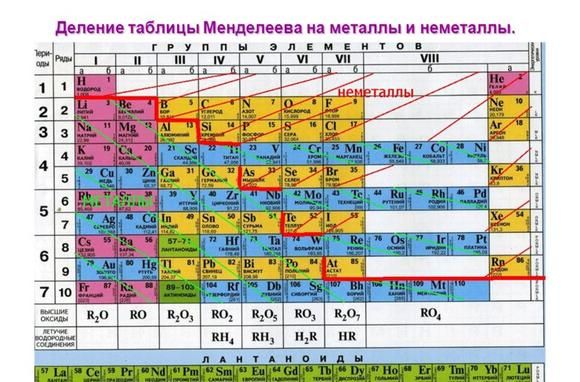
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
К щелочноземельным металлам относятся:
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Источник
Активные металлы – список в химии, таблица ряда
Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
К щелочноземельным металлам относятся:
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.
Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
– Ca + Br2 → CaBr2;
– 2Al + 3S → Al2S3
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
– 2Na + 2H2O → 2NaOH + H2;
– Ca + 2H2O → Ca(OH)2 + H2
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
– Ca + 2HCl → CaCl2 + H2;
– 2K + 2HMnO4 → 2KMnO4 + H2
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
2Na + CuCl2 + 2H2O:
– 2Na + 2H2O → 2NaOH + H2;
– 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.
Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Источник
Активные металлы
Среди всех металлов некоторые отличаются тем, что они очень легко вступают в восстановительные реакции. Такие металлы имеют много схожих свойств и объединяются в класс активных металлов.
Положение активных металлов в таблице Менделеева
К активным металлам относятся три группы элементов:
- щелочные металлы;
- щелочноземельные металлы;
- алюминий.
Щелочные металлы находятся в первой группе таблицы Менделеева, то есть занимают в ней крайнее левое положение. В частности щелочными металлами являются:
Щелочноземельные металлы находятся во второй группе, то есть правее щелочных металлов. К ним относятся:
- бериллий (Be);
- магний (Mg);
- кальций (Ca);
- стронций (Sr);
- барий (Ba);
- радий (Ra).
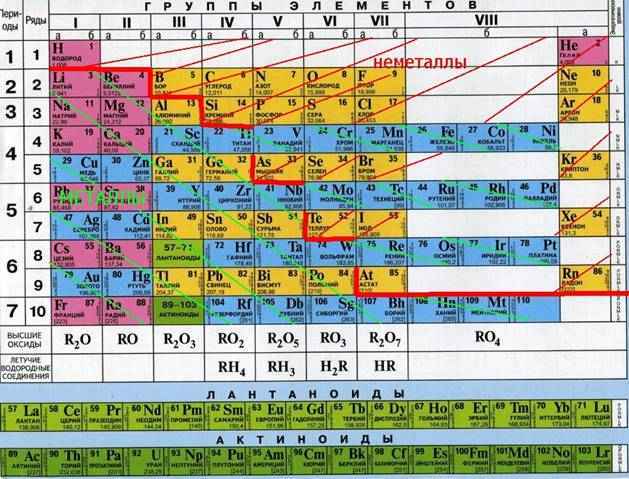
В целом активные металлы отличаются тем, что имеют один или два валентных электрона, поэтому они легко отдают эти электроны в ходе химических реакций, выступая в качестве восстановителей. Степень активности металла можно оценить по его расположению в электрохимическом ряде активности металлов. Чем левее там находится металл, тем сильнее выражены его восстановительные свойства. Крайнее левое положение в ряде занимает литий. В вот крайне правое положение в ряду занимает золото, именно поэтому оно почти не окисляется кислотами.
Алюминий – это так называемый постпереходный металл, по своим свойствам он находится где-то между активными и среднеактивными металлами. Разные ученые придерживаются различного мнения о том, стоит ли считать алюминий активным металлом.
Активные металлы не встречаются в природе в чистом виде, так как они быстро вступают в химические реакции с другими элементами. Чаще всего в природе они присутствуют в виде оксидов. Например, даже если алюминий получен в чистом виде, то на воздухе он быстро покрывается оксидной пленкой.
Свойства щелочных металлов
Цвет всех щелочных металлов – белый, с серебристым оттенком. Исключением является цезий, имеющий серебристо-желтый цвет. Щелочные металлы можно резать простым скальпелем, так как у них низкая твердость. Также они имеют малую плотность – от 534 кг/м 3 у лития до 1900 кг/м 3 у цезия. Литий, калий и натрий настолько легкие, что они плавают в воде, но построить корабль из них не получится, так как вода быстро окисляет и разрушает эти металлы. Франций и цезий плавятся уже при комнатной температуре, а самый тугоплавкий щелочной металл – это литий, плавящийся при 180,6°С.
Для защиты щелочных металлов от воздуха и волы их хранят в керосине. При реагировании лития с водой выделяется водород, а натрий и особенно калий просто взрываются в воде. При взаимодействии с кислородом образуются оксиды.
Свойства щелочноземельных металлов
Щелочноземельные металлы значительно тверже щелочных, их нельзя просто взять и разрежать ножом. Также они тяжелее – их плотность колеблется от 1550 кг/м 3 у кальция до 5500 кг/м 3 у радия. Цвет щелочноземельных металлов – серый. Температуры плавления этих элементов находятся в диапазоне 650-840°С. Исключение – бериллий, плавящийся лишь при 1278°С.
Чем больше порядковый номер щелочноземельного металла в таблице Менделеева, тем выше его химическая активность. Например, бериллий вообще не взаимодействует с кислородом и по своим свойствам напоминает алюминий. Наиболее активные стронций, барий и радий приходится хранить в керосине, также как и щелочные металлы.
Подведение итогов
Активные металлы отличаются тем, что имеют лишь один-два валентных электрона, которые они легко отдают. Поэтому эти элементы очень быстро вступают в химические реакции, а в природе в чистом виде не встречаются.
Источник









