- Параметры аквариумной воды: жесткость, pH и другие
- Параметры воды для идеального травника
- Температура для аквариума травника = 24-25°С
- Карбонатная жесткость (kН) для аквариума травника = 2-4
- Углекислота СО2 для аквариума травника = 20-30 мг/л
- pH для аквариума травника = 6,5-7,3
- Редфилд рулит
- Соотношение нитрат NO3 и фосфата PO4 в аквариуме/азота N и фосфора P
Параметры аквариумной воды: жесткость, pH и другие

Одной из важнейших составляющих аквариумного мира является вода, как среда обитания аквариумных рыбок и растений.
Параметры аквариумной воды, ее характеристики напрямую влияют на самочувствие ваших питомцев и состояние растений. Не секрет, что грязная, мутная вода губит рыб, портит внешний вид аквариума, однако и прозрачная вода не всегда говорит о том, что ее состав идеален.
Основными параметрами и показателями качества аквариумной воды являются:
— Жесткость аквариумной воды (hD);
— Водородный показатель воды «Кислотность аквариумной воды» (pH);
— Окислительно-восстановительный потенциал (rH);
ЖЕСТКОСТЬ АКВАРИУМНОЙ ВОДЫ (hD) – обусловлена наличием в воде карбонатов — солей кальция и магния: CaCO3 и MgCO3 гидрокарбонатов Ca(HCO3)2 и Mg(HCO3)2, сульфатов CaSO4 и MgSO4, хлоридов CaCl2 и MgCl2. . Их концентрация в аквариумной воде составляет ОБЩУЮ ЖЕСТКОСТЬ, которую можно разделить на ВРЕМЕННУЮ (KH) и ПОСТОЯННУЮ (GH).
Временная жесткость аквариумной воды (КН) – это концентрация двууглекислых солей кальция и магния. Такая жесткость может меняться в течении суток. Например, в дневное время аквариумные растения в процессе фотосинтеза поглощают углекислый газ, который накапливается в воде. Если углекислого газа будет не хватать для потребления его растениями, они начнут синтезировать углерод из состава бикарбонатов, вследствие чего временная жесткость воды увеличится
Постоянная жесткость аквариумной воды (GH) – это количество растворенных сульфатов, хлоридов и некоторых других солей кальция и магния. При кипячении такой воды концентрации этих катионов и анионов практически не изменяются – отсюда и название «постоянная жесткость».
Жесткость воды имеет важнейшее значение для жизни аквариумного мира. Во-первых, соли кальция и магния используются при построении скелета и оказывают влияние на построение всего организма рыбы. Для различных видов аквариумных рыбок показатели жесткости воды различны и несоблюдение их может привести к ухудшению самочувствия рыбок, к нарушению функции размножения и оплодотворения икры.
Общая жесткость аквариумной воды измеряется немецкими градусами (hD). 1° hD – это 10мг окиси кальция в 1литре воды.
Аквариумная вода с параметрами жесткости:
от 1 до 4° hD – считается очень мягкой;
от 4 до 8° hD – считается мягкой;
от 8 до 12° hD – средняя жесткость;
от 12 до 30° hD – считается очень жесткой;
Большинство аквариумных рыбок комфортно себя чувствуют при жесткости от 3-15° hD.
Как изменить жесткость аквариумной воды:
1.) Увеличение жесткости.
— Жесткость KH можно повысить путем добавления 1-й чайной ложки пищевой соды на 50 литров, что увеличит показатели на 4°dKH.
— 2-е чайные ложки карбоната кальция на 50 литров воды увеличат одновременно KH и GH на 4 градуса.
— еще одной мерой для плавного/постепенного увеличения жесткости воды, является разбрасывание и украшение аквариума морскими ракушками.
2.) Уменьшение жесткости (здесь все сложнее):
— используют/добавляют дистиллированную воду, которая продается в магазинах;
— используют/добавляют дождевую, снеговую, талую воду из холодильника (должна быть чистой, без мути и примесей).
— фильтруют воду через осмотический фильтр;
— фильтруют воду через торф (добавляется торф в фильтр) или в емкость, где отстаивается вода;
— жесткость КН снижают кипячением воды в эмалированной посуде в течении 1 часа с последующим отстаиванием в течении суток;
— природными смягчителями воды являются быстрорастущие растения: элодея, роголистник, наяс, валлиснерия.
КАК ИЗМЕРИТЬ общую жесткость аквариумной воды в домашних условиях без спец. оборудования и препаратов (титрование пробы мыльным раствором):
Особенность этого метода заключается в том, что 10мг окиси кальция в 1 литре воды нейтрализуется 0,1г. чистого мыла.
1. Берется 60-72% хозяйственное мыло, крошится.
2. В мерный стаканчик (или иной мерный сосуд) наливается вода (дистиллированная, снежная, талая из холодильника воду) — далее дистиллят.
3. В воду добавляется мыльная крошка (отсчитанная в граммах), так чтобы было можно рассчитать порцию мыла в полученном растворе.
4. В другую посуду наливаем 0,5 литров испытуемой аквариумной воды и добавляем постепенно порции мыльного раствора (по 0,1гр.), взбалтываем.
Сначала на поверхности воды появятся сизые хлопья и быстро исчезающие пузырьки. Постепенно добавляя порции мыльного раствора ждем когда вся окись кальция и магния свяжется – на поверхности воды появятся устойчивые мыльные пузыри с характерным радужным переливом.
На этом опыт окончен. Теперь подсчитываем количество израсходованных мыльных порций, умножаем их надвое (аквариумной воды было 0,5л, а не 1л.). Полученное число и будет жесткость аквариумной воды в градусах. Например, 5 порций мыла*2= 10° hD.
При аккуратном проведении опыта погрешность может составлять +-1° hD.
При получении результата жесткости более 12° hD, точность измерения снижается, рекомендуется провести опыт повторно разбавив аквариумную воду на 50% дистиллятом, полученный результат удвоить.
Водородный показатель воды или «кислотность аквариумной воды» (pH аквариумной воды) определяет нейтральную, кислую и щелочную реакцию воды при определенной концентрации ионов водорода.
В химически чистой воде происходит электролитическая диссоциация – разложение молекул на ионы водорода (Н+) и гидроксила (ОН-), количество которых в ней при температуре 25°С всегда одинаково и равно 10-7г*ион/л. Такая вода имеет нейтральную реакцию. Отрицательный логарифм концентрации ионов водорода условно применяется для обозначения величины pH и в данном случае равен 7. При наличии в воде кислот (не химически чистая вода) количество ионов водорода будет больше, чем гидроксила – вода приобретает кислую реакцию с меньшим цифровым показателем pH. И наоборот, в щелочной воде будут преобладать гидроксильные ионы и pH увеличиваться.
Аквариумная вода с параметрами pH:
— от 1 до 3 называют/считают сильнокислотной;
— от 5-6 слабокислой;
Параметры pH могут меняться в течении суток, что обусловлено переменной концентрацией углекислого газа в аквариумной воде, что в свою очередь стабилизируется постоянной аэрацией.
Резкие колебания показателей pH вредны и болезненны для аквариумных рыбок и растений. Большинство аквариумных рыбок предпочитают pH от 5,5 до 7,5.
Как изменить pH аквариумной воды:
— Если необходимо снизить показатель pH – подкисляют воду настоем торфа (ну или спец. препаратами из зоомагазина);
— Если необходимо увеличить показатель pH (усилить щелочность) – используют пищевую соду;
Измерение pH аквариумной воды:
1. Во многих зоомагазинах продаются тестеры (лакмусовые бумажки с фенолфталеином). Собственно, следуя инструкциям на упаковке, по шкале можно определить параметры pH.
2. Есть спец. прибор для измерения – ПиАшметр. Для домашних аквариумов не используется (дорого, да и не зачем вообще). Ведь главное не частое измерение параметров pH, а условия содержания рыбок и аквариума. В ухоженном, не перенаселенном, не забитым доверху растениями аквариуме, с аэрацией — pH будет всегда в норме и часто измерять его не нужно.
Окислительно-восстановительный потенциал (rH воды, ОВП воды).
Суть окислительно-восстановительного процесса в аквариумной воде сводится к том, что все вещества находящиеся в ней вступают друг с другом в реакцию. При этом одно вещество отдает свои электроны и заряжается положительно (окисляется), а другое приобретает электроны и заряжается отрицательно (восстанавливается). В итоге между разноразрядными веществами возникает разность электрических потенциалов. Проще говоря: окисление – это реакция соединения нитритов с кислородом, а восстановление – наоборот, распад нитритов с высвобождением кислорода.
Максимальный окислительный потенциал воды равен 42rH.
Параметры:
rH 40-42 – максимальное окисление (чистый кислород);
rH 35 –сильное окисление;
rH 30 – незначительное окисление;
rH 25 – слабое окисление;
rH 20 – слабое восстановление;
rH 15 –незначительное восстановление;
rH 10 – сильное восстановление;
rH 5-0 – максимальное восстановление (чистый водород);
Почти все аквариумные рыбки и растения комфортно себя чувствуют при rH 25-35. Отдельные виды предпочитают более узкие параметры этого значения.
Измеряется rH специальными измерителями.
Увеличивают rH воды регулярной сменой воды, уходом — чисткой аквариума, а так же продувкой воздуха и использованием озона.
ИТАК:
Мы с Вами узнали об основных параметрах аквариумной воды, соблюдение которых будет безусловным залогом здоровья рыбок и красоты растений.
Существуют и другие значения/параметры характеризующие аквариумную воду. Однако, они не столь значимы, как hD и pH. Для содержания домашнего аквариума знать и следить за ними просто нет необходимости. Как говорил Шерлок Холмс: «…человек толковый тщательно отбирает то, что он поместит в свой мозговой чердак».
ОПТИМАЛЬНЫЕ ПАРАМЕТРЫ АКВАРИУМНОЙ ВОДЫ (hD воды, pH воды, ОВП воды) ЗАЧАСТУЮ ДОСТИГАЮТСЯ БАНАЛЬНЫМ УХОДОМ ЗА АКВАРИУМОМ И СОБЛЮДЕНИЕМ ПРАВИЛ СОДЕРЖАНИЯ ЕГО ЖИТЕЛЕЙ: не делайте из аквариума общежитие, не перегружайте его растениями, обеспечьте постоянную аэрацию и фильтрацию, осуществляете регулярную подмену воды на свежую.
Подписывайтесь на наш You Tube-канал, чтобы ничего не пропустить
Источник
Параметры воды для идеального травника

Данная статья является выжимкой из всего, что написано на ФанФишке, да и в интернет-пространстве в целом. На нашем ресурсе уже давно существует отличная форумная ветка для обсуждения данной темы, где дебаты и дискуссии, пылают, как Вечный огонь на 9 мая!
В связи с чем, есть объективная необходимость еще раза вывести все постулаты в отдельную статью и проговорить самые важные аспекты воссоздания оптимальных условий для аквариумных растений.
Перед началом следует отметить, что все аквариумы разные. Кому-то и два куста эхинодоруса – это уже акваскейп! Ниже приведены четкие параметры для акваскейперских шедевров, для голландских аквариумов или любительских, но плотных травников. Если аквариум простой, допустим без СО2 и качественного освещения, конечно, возможны отклонения от указанных норм. Вырастить нефорсированный травник тоже можно. Но в тоже время, вы должны понимать, что соблюдение норм и есть залог успеха. Нельзя что-то убирать или наоборот гиперболизировать в расчете на замещение недостающего. Важен фен-шуй и аквариумный инь-яня =) Итак,
Аквариум – это замкнутая экосистема. И только обладая всей информацией о происходящих там процессах, применяя их на практике, возможно добиться отличных результатов.
Температура для аквариума травника = 24-25°С
Возможно существование растений и при более низкой или высокой температуре.
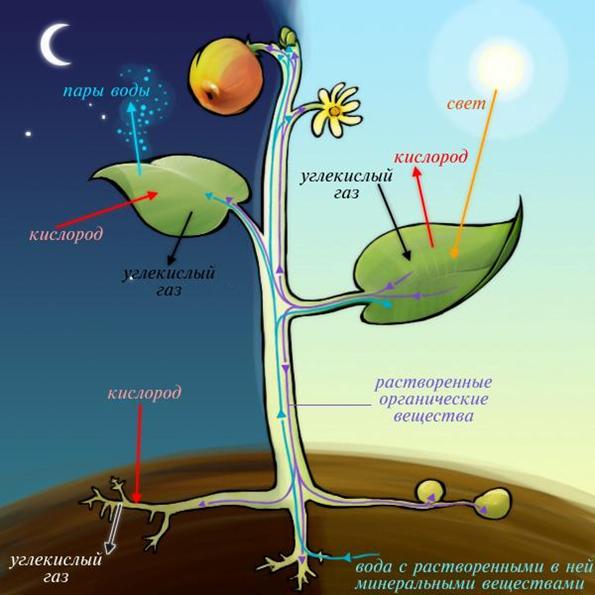
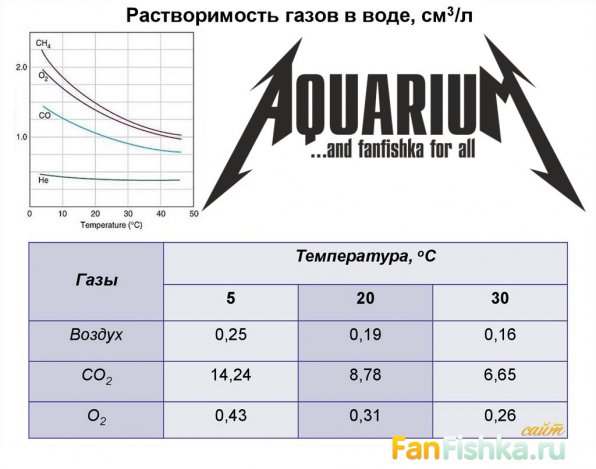
Однако, известна закономерность: растворимость газов в воде тем меньше, чем теплее вода. Если ее температура 24–25°С, в ней гораздо больше растворенного углекислого газа (днем) и кислорода (ночью). А это прямая польза для замкнутой экосистемы, какой является аквариум. Кислород требуется растениям для дыхания, помогает окислять органику и азотистые соединения. И соответственно, растения в большем количестве ассимилируют углекислоту, необходимую для роста.
В любом аквариуме всегда имеются аммоний NH4 и аммиак NH3, представляющие опасность для обитателей. Они образуются из продуктов жизнедеятельности рыб, в том числе от гниения органики. Если температуру воды поднять или повысить уровень pH, токсичность азотистых увеличится.
Дополнительно отметим, что Такаши Амано рекомендовал в самом начале, после запуска травника даже снижать температуру
21-23 градусов, то есть тем самым не давать перекосам азотистых «лупить по растениям» и аквариуму в целом. «Усиленное количество» О2 в темное время суток способствует окислению и «быстрой работе» над азотистыми, способствует лучшему дыханию растения. В дневное время в такой же степени по своему профилю действует СО2.
Самой частой ошибкой травославных аквариумистов является игнорирование или минимизация значения О2 ночью – в темное время суток. Подача аэрации в аквариум должна быть соразмерна дневной подаче СО2. Должна быть максимально качественной, мелкодисперсной (как из диффузора СО2). Добиться такого эффекта можно поднятием флейты над уровнем воды, мощной помпой или, например, такой штукой, как H2Show BubbleMaker, через которую, кстати, можно и даже офигенно подавать и СО2 в больших травниках – пузырьки крайне мелкодисперсные и их разносит на все 120*50*50.
Карбонатная жесткость (kН) для аквариума травника = 2-4
Самое подходящее для роста большинства растений значение pH 6,5-7,3. Насколько выше этот показатель, настолько больше карбонатная жесткость аквариумной воды (kH).
Углекислота из воды наиболее эффективно усваивается растениями при значении kН равном 3,5-4. Таким образом, должный kН способствует интенсивному росту травы. Общая же жесткость воды (GH) играет второстепенную роль в этом процессе.
kH 2–4 — лучший вариант, так как уровень kH тесно связан с уровнем CO2. Штука вся в том, что если KH будет высоким, растворение в воде необходимого количества CO2, которое должно снизить pH до нужного уровня 6.5-7.3 превысит допустимую концентрацию для рыб, креветок и др. – они начнут задыхаться. То есть при слишком большом kH довести концентрацию CO2 до нужного уровня достаточно сложно и опасно.
Кроме того, затрагивается вопрос экономии углекислоты. Чем ниже наш kH, тем меньше нужно подать пузырьков углекислоты для снижения pH до требуемых значений. А, например, с ранее представленным вариантом распыления – БаблМэйкером, даже на 300л. аквариум достаточно
1-2 пузырьков в секунду.
Отметим, что часто можно услышать высказывания о том, что нулевой kH может обрушить pH. Так-то оно так, но в интернете есть масса практических примеров удержания травника на kH=0. Насколько это необходимо, каждый решает сам исходя из своего опыта и практики. Для начинающих акваскейперов, мы не рекомендуем обнулять карбонатную жесткость.
Дополнительно отметим, что гуминовые кислоты, выделяющиеся уложенным торфом в грунте и при помощи того же Tetra ToruMin очень благотворно влияют на рост растений. Но при высокой щелочности воды (kH, pH) гуминовые кислоты нейтрализуются кальцием.
Таким образом, если вода в аквариуме жесткая/щелочная (хорошо выше pH, kH=7), она будет постоянно истощать «торфяные запасы» и эффект будет минимальным.
Углекислота СО2 для аквариума травника = 20-30 мг/л
Углерод (С) — это важнейший первичный строительный элемент организма растения. Растение примерно на 90% состоит из воды, остальные 10% — это сухое вещество. Из этих 10% — 46% это углерод. Вот почему подача СО2, так важна в растительном аквариуме.
Усвоение С происходит в основном из углекислоты, растворенной в воде. Ее содержание зависит от pH и кH. Углекислый газ снижает pH. Если кH составляет 2–4, то 20-30 мг/л углекислоты способствуют установлению pH на уровне 6,5–7,3, наиболее подходящем для жизни аквариумных растений.
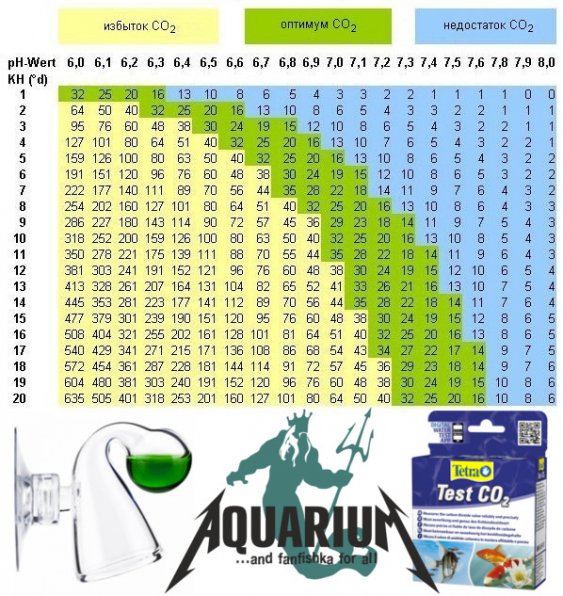
Количество СО2 можно определить при помощи тестов, дропчекера, таблицы соотношения kH и pH. Но самый лучший показатель – это габитус растений и поведение креветок и рыб при подаче газа.
pH для аквариума травника = 6,5-7,3
Норма pH 6,5–7,3. Это наиболее благоприятное значение для роста растений. Если этот показатель меньше, значит, большее количество углерода в легкоусвояемой форме содержится в аквариуме. Если pH больше 7, количество углерода становится меньше.
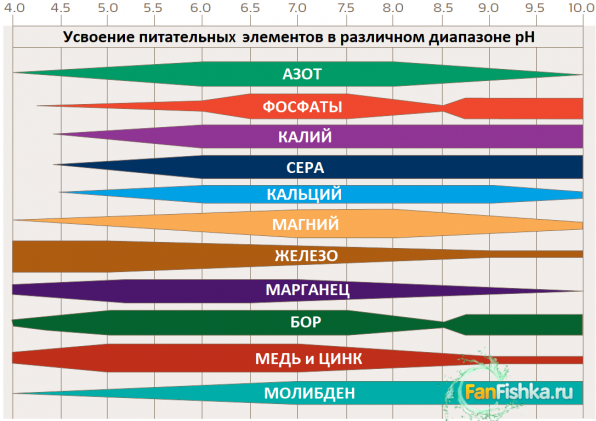
Кроме того, в указанном диапазоне наиболее эффективно усваиваются макро и микроэлементы.
Редфилд рулит
Давайте в этой статье, еще очень кратко затронем вопрос дозировок и соотношения, наиболее важных марко и микро-элементов для травника: N, P, Fe и К. Ведь это крайне важно! Обязуемся в скором времени более детально рассмотреть данный вопрос (он уже тут), ну а пока продекларируем самое главное.
Соотношение нитрат NO3 и фосфата PO4 в аквариуме/азота N и фосфора P
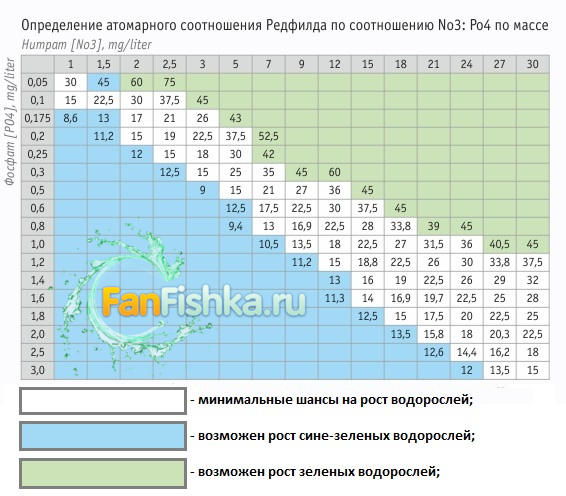
Начать нужно с того, что Редфилд – это не сорт брокколи, а американский ученый исследователь (Альфред Кларенс Редфилд), который в 1934г. обнаружил атомарное соотношение С-N-P и вывел пропорцию, названную в его честь.
Это атомарное соотношение было исследовано на зоопланктоне, а в дальнейшем изучалось влияния изменения данного соотношения на жизни различных видов водорослей. В результате исследований были сделаны потрясающие выводы, в том числе помогающие нам — аквариумистам. Тема крайне важная, но заслуживающая отдельного повествования. Ниже суть и просто бомбическая таблица Редфилда.
Из таблицы усматривается, что важна не только концентрация удобрений NO3:PO4, но и их пропорция. ПРОПОРЦИЯ. АКЦЕНТИРУЕМ ВНИМАНИЕ. Многие аквариумисты пренебрегают пропорциями и держат их произвольно, «типа есть же удо и то и то», значит растения лопают все, что им необходимо. А на самом деле – это грубейший косяк.
Данная пропорция проверена миллионами аквариумистов, мы – ФанФишевцы на собственной практике, на собственных экспериментах также констатируем, что пропорция Редфилд рулит! И призываем вас к ее соблюдению.
Посмотрите еще раз на таблицу и ответьте себе, какое соотношение нитрата к фосфату лучше: PО4=0,1 к NО3=1 или PО4=1 к NО3=15? И тот и тот показатель ведь хорош.
Вы, наверное, догадываетесь, к чему мы клоним. Об этом мы уже говорили в своем Аквариумном навигаторе для начинающих «Подводные сады Семирамиды». Понятно, что N и P необходимы и работают в связке друг другом, но почему всеми декларируется пропорция
1:20, а не скажем 0,1 к 2 или наоборот 10:200? Например, концентрация фосфора и азота в природных водоемах крайне мала: PO4=0.05мг/л и менее, NO3 0.5мг/л и менее. Почему же в аквариуме с растениями, мы вносим удобрения в вышеназванных пропорциях?
В природных водоемах соотношение биомассы растений к объему воды несоизмеримо меньше, чем в аквариуме, и даже если растения постоянно потребляют P, его запасы в воде вокруг растений сразу же восстанавливаются за счет выравнивания концентрации.
Аквариум — это почти замкнутая система, самостоятельного выравнивания концентраций фактически не происходит. Они либо обнуляются, либо, что чаще бывает в аквариумах у начинающих, наоборот зашкаливают.
Из сказанного мы можем сделать вывод о том, что теоретически можно держать соотношение P к N в пропорции 0,1:2, то есть в 10 раз меньше рекомендованной пропорции. Но с практической точки зрения сделать это очень сложно, поскольку азот и фосфор будет быстро потребляться растениями и обнуляться. Для восстановления концентраций нам придется добавлять удобрения по капельке и каждый день. Что неудобно и непрактично.
Более того, нужно не забывать, что N и P необходимы и другим гидробионтам. Самый очевидный пример по азоту — бактерии нитрификаторы, то есть бактерии участвующие в азотном цикле. Потребляя азот, они являются прямыми конкурентами растений.
ДА, НО! Когда мы декларируем пропорцию 1:20 в неделю мы все же предоставляем возможность водорослям питаться избытками. Компания ADA (Такаши Амано) и ведущие акваскейперы мира держат минимальные концентрации нитрата и фосфата (с учетом пропорции), не давая никакого шанса водорослям. Да — это практически сложение сделать, но зато дает потрясающие результаты. К тому же есть электронные автодозаторы удобрений на том же АлиЭкспресс (хотя с ними есть тоже проблемы, но все же). Все же достаточно спокойно можно держать среднюю пропорцию в ручном режиме, внося удобрения не раз в неделю, а хотя бы два раза в неделю, а лучше через день, а еще лучше ежедневно (что делают большинство скейперов – встают с утра, завтракают и льют удо =).
Напоследок, два слова о том, что полная пропорция Редфилда включает в себя С-углерод. Об этом тоже все забывают почему-то. В целом, давайте не забывать об интенсивности освещения, микро-удобрениях и всем остальном, что настраивает бомбический фотосинтез растений.
И еще одно слово в конце… =) Как видно из таблицы, пропорция Редфильда допускает отклонения в
20%, плюс ко всему, часто можно встретить различные вариации пропорции: 1:20, 1:10, 1:15, 1,2:25. Почему так? Потому, что есть разные схемы запуска травника от бабки АДЫ, от дядьки Кнотта, от енота… где есть свои штрихи. Например, при ступенчатом методе освещения «рассвет-зенит-закат» рекомендуется пропорция NO3:PO4 1 к 15-25.
Итого, красной нитью, пестрой лентой этого раздела проходит мысль, что важно не количество макро-удорбрений NO3|PO4 и атомарного N|P, А ИХ ПОСТОЯННОЕ СООТНОШЕНИЕ И УДЕРЖАНИЕ.
Так, статья превращается в доклад. Поэтому «полслова» о К (калии) и Fe (железе).
О калии вот наш форум, почитайте, пожалуйста. Самое выбесительное, что связано с калием – это так называемый «радикулит» растений, который приплетаю во все случаи, когда растение скрючивает — «радикулит едрид Мадрид». Прежде чем советовать обратить внимание на калий, следует исключить первичные составляющие качественного процесса фотосинтеза, а — это интенсивность освещения (Лм/л с учетом особенностей аквариума), концентрация СО2, NO3, PO4… а уж потом К и Fe. Поверьте, растение быстрее скрючит от недостатка освещения, чем от недостатка калия.
Тоже самое касается и железа, с которым связывают хлороз растений (побледнение прожилок и разрушению листа). У растения быстрее случится хлороз, фимоз, понос и эндометриоз =) от недостатка света, углекислоты, азота, фосфата… нежели от железа.
Рекомендуемая многими производителями еженедельная дозировка Fe=0,5 мг/л. Данная дозировка варьируется в меньшую или большую сторону — до 1 мг/л в зависимости от индивидуальных особенностей травника.
Опять же важна больше пропорция железа и его постоянное присутствие = 0,1 мг/л. Что достигается дроблением недельной дозировки. Также важно понимать, что железо может быть представлено в виде двухвалентного, трехвалентного железа, а также в виде комплексонов (хелатов). И все это крайне занимательно. Но это уже другая история…
Крутые ролики о растениях и травнике от ФанФишки
Подписывайтесь на наш You Tube-канал, чтобы ничего не пропустить
Источник