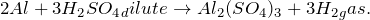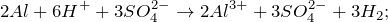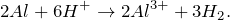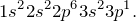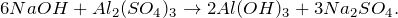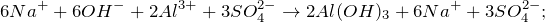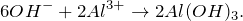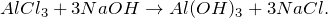Гидролиз сульфата алюминия
Общие сведения о гидролизе сульфата алюминия
Представляет собой кристаллы белого цвета с неярким серым, голубым или розовым оттенком. В виде кристаллогидрата — бесцветные Формула – Al2(SO4)3. Молярная масса – 142 г/моль.
Рис. 1. Сульфат алюминия. Внешний вид и структурная формула.
Гидролиз сульфата алюминия
Гидролизуется по катиону. Характер среды – кислый. Теоретически возможны вторая и третья ступени гидролиза.
2Al 3+ + 3SO4 2- + HOH ↔ 2AlOH 2+ + 3SO4 2- + H + ;
Примеры решения задач
| Задание | Какая масса сульфата алюминия образовалась при взаимодействии 15,4 г алюминия с серной кислотой? |
| Решение | Запишем уравнение реакции: |
Найдем количество вещества алюминия, вступившего в реакцию (молярная масса – 27 г/моль), используя данные, указанные в условии задачи:
υ (Al) = msolute(Al)/ M (Al) = 15,4/27 = 0,57 моль.
Согласно уравнению реакции υ (Al2(SO4)3) = 2×υ(Al). Следовательно,
Рассчитаем массу образовавшегося сульфата алюминия (молярная масса – 142 г/моль):
| Задание | Докажите качественный состав сульфата алюминия. |
| Решение | Запишем уравнение диссоциации сульфата алюминия: |
Качественная реакция на сульфат-анион действие катионов бария. Наблюдается выпадение осадка белого цвета, нерастворимого в кислотах:
Качественная реакция на катионы алюминия – действие щелочи, в результате чего образуется нерастворимое соединение – гидроксид алюминия которое можно перевести в комплексное вещество гидратом аммиака:
Источник
Al2 so4 3 уравнение с водой
К раствору Al2(SO4)3 добавили следующие вещества:
а) H2SO4;
б) KOH;
в) Na2SO3;
г) ZnSO4.
В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
Согласно принципу Ле Шателье ведение в данный раствор дополнительного количества катионов водорода (H + ) будет подавлять гидролиз, а введение гидроксид-анионов (OH — ) наоборот усиливать гидролиз.
Серная кислота диссоциирует с образованием катионов водорода, что приведет к ослаблению гидролиза сульфата алюминия.
H2SO4 ⟶ 2H + + SO4 2-
Гидроксид калия диссоциирует с образованием гидроксид-анионов, что приведет к усилению гидролиза сульфата алюминия.
KOH ⟶ K + + OH —
Гидролиз сульфита натрия идёт по аниону:
Na2CO3 + HOH ⇄ NaHCO3 + NaOH
2Na + + CO3 2- + HOH ⇄ Na + + HCO3 — + Na + + OH —
CO3 2- + HOH ⇄ HCO3 — + OH —
В результате гидролиза образовались гидроксид-анионы, что приведет к усилению гидролиза сульфата алюминия.
Гидролиз сульфата цинка идёт по катиону:
2ZnSO4 + 2HOH ⇄ (ZnOH)2SO4 + H2SO4
2Zn 2+ + 2SO4 2- + 2HOH ⇄ 2ZnOH + + SO4 2- + 2H + + SO4 2-
Zn 2+ + HOH ⇄ ZnOH + + H +
В результате гидролиза образовались катионы водорода, что приведет к ослаблению гидролиза сульфата алюминия.
Источник
Al -> Al2(SO4)3 уравнение реакции
Составьте химическое уравнение по схеме Al -> Al2(SO4)3. Расставьте стехиометрические коэффициенты. Укажите основные физические и химические свойства алюминия. Приведите способы получения этого вещества.
Получение средней соли сульфата алюминия из алюминия (Al -> Al2(SO4)3) возможно при действии на последний разбавленного раствора серной кислоты. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что простые вещества на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Алюминий – тринадцатый элемент Периодической таблицы. Обозначение – Al от латинского «aluminium». Расположен в третьем периоде, IIIА группе. Относится к металлам. Заряд ядра равен 13. Электронная конфигурация выглядит следующим образом:
Алюминий – самый распространенный в земной коре металл. Он входит в состав глин, полевых шпатов, слюд и многих других минералов. Общее содержание алюминия в земной коре составляет 8% (масс.).
Алюминий – серебристо-белый легкий металл. Он легко вытягивается в проволоку и прокатывается в тонкие листы. При комнатной температуре этот металл не изменяется на воздухе, но лишь потому, что его поверхность покрыта тонкой пленкой оксида, обладающего очень сильным защитным действием.
Алюминий пассивируется в воде, концентрированной азотной кислоте и растворе дихромата калия из-за образования устойчивой оксидной пленки; амальгамированный металл реагирует с водой. Реакционноспособный, сильный восстановитель. Проявляет амфотерные свойства, реагирует с разбавленными кислотами и щелочами.
Источник
Al2(SO4)3 + NaOH = ? уравнение реакции
Здесь есть кто-нибудь, кто хорошо разбирается в химии? Мне нужна помощь: взаимодействует ли сульфат алюминия с гидроксидом натрия (Al2(SO4)3 + NaOH = ?) и, если да, то, что при этом получается. Охарактеризуйте полученное нерастворимое в воде соединение: укажите его основные физические и химические свойства, а также способы получения.
В результате взаимодействия растворов сульфата алюминия и гидроксида натрия (Al2(SO4)3 + NaOH = ?) происходит образование средней соли – сульфата натрия, а также нерастворимого в воде основания — гидроксида алюминия (обмен). Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что гидроксид алюминия на ионы не распадается, т.е. не диссоциирует.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Гидроксид алюминия представляет собой термически неустойчивый порошок белого цвета. Не растворяется в воде. Он существует в виде четырех полиморфных модификаций, каждую из которых можно выделить при конкретной температуре.
Гидроксид алюминия выпадает в виде студенистого осадка при действии щелочей на растворы солей алюминия и легко образует коллоидные растворы.
Гидроксид алюминия – типичный амфотерный гидроксид. С кислотами он образует соли, содержащие катион алюминия, со щелочами – алюминаты; при взаимодействии с водными растворами щелочей образуются гидроксоалюминаты; при нагревании до температуры выше 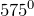
Источник
Al2 so4 3 уравнение с водой
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Что называют гидролизом? Гидролиз ― реакция обменного взаимодействия веществ с водой, приводящая к их разложению.
Какие варианты гидролиза вы знаете? Гидролиз по катиону и по аниону.
Задание 2
Запишите формулы некоторых солей, которым в таблице растворимости соответствуют прочерки «#», и уравнения реакций их гидролиза.
Al2S3 + 6H2O = 2Al(OH)3 ↓ + 3H2S ↑
Fe2S3 + 6H2O = 2Fe(OH)3 ↓ + 3H2S ↑
Cr2S3 + 6H2O = 2Cr(OH)3 ↓ + 3H2S ↑
CuCO3 + 2H2O = Cu(OH)2 ↓ + H2O +CO2 ↑
Задание 3
Только ли кислота и основание могут в результате обмена образовать соль?
Гидролиз средних солей может привести к образованию кислых или основных солей:
K2CO3 + H2O = KHCO3 + KOH
ZnCl2 + H2O = ZnOHCl + HCl
Задание 4
Запишите уравнения гидролиза следующих солей, укажите тип гидролиза и среду образовавшегося раствора:
Cu(NO3)2
Cоль диссоциирует в растворе Cu(NO3)2 ⇄ Cu 2+ + 2NO3 — , где
Cu 2+ ― катион слабого основания и гидролизирует по схеме (вторая стадия практически не происходит):
Cu 2+ + H2O ⇄ CuOH + + H + Гидролиз по катиону, pH
Cu 2+ + 2NO3 — + H2O ⇄ CuOH + + 2NO3 — + H +
Cu(NO3)2 + H2O ⇄ Cu(OH)NO3 + HNO3
FeSO4
Cоль диссоциирует в растворе FeSO4 ⇄ Fe 2+ + SO4 2 — , где
Fe 2+ ― катион слабого основания и гидролизирует по схеме (вторая стадия практически не происходит):
Fe 2+ + H2O ⇄ FeOH + + H + Гидролиз по катиону, pH ― среда кислотная
2FeSO4 + 2H2O ⇄ Fe(OH)2SO4 + H2SO4
ZnCl2
Cоль диссоциирует в растворе ZnCl2 ⇄ Zn 2+ + 2Cl — , где
Zn 2+ ― катион слабого основания и гидролизирует по схеме (вторая стадия практически не происходит):
Zn 2+ + H2O ⇄ ZnOH + + H + Гидролиз по катиону, pH
Zn 2+ + 2Cl — + H2O ⇄ ZnOH + + 2Cl — + H +
ZnCl2 + H2O ⇄ Zn(OH)Cl + HCl
K2S
Cоль диссоциирует в растворе K2S ⇄ 2K + + S 2- , где
S 2- ― анион слабой кислоты и гидролизирует по схеме (вторая стадия практически не происходит):
S 2- + H2O ⇄ HS — + OH — Гидролиз по аниону, pH>7 ― среда щелочная
S 2- + 2K + + H2O ⇄ HS — + 2K + + OH —
K2S + H2O ⇄ KHS + KOH
Na2SiO3
Cоль диссоциирует в растворе Na2SiO3 ⇄ 2Na + + SiO3 2- , где
SiO3 2- ― анион слабой кислоты и гидролизирует по схеме (вторая стадия практически не происходит):
SiO3 2- + H2O ⇄ HSiO3 — + OH- Гидролиз по аниону, pH>7 ― среда щелочная
SiO3 2- + 2Na + + H2O ⇄ HSiO3 — + 2Na + + OH —
Na2SiO3 + H2O ⇄ NaHSiO3 + NaOH
NH4Cl
Cоль диссоциирует в растворе NH4Cl ⇄ NH4 + + Cl — , где
NH4 + ― катион слабого основания и гидролизирует по схеме (вторая стадия практически не происходит):
NH4 + + H2O ⇄ NH3 •H2O + H + Гидролиз по катиону, pH
NH4 + + Cl — + H2O ⇄ NH3•H2O + Cl — + H +
NH4Cl + H2O ⇄ NH3 •H2O + HCl
Al(NO3)3
Cоль диссоциирует в растворе Al(NO3)3 ⇄ Al 3+ + 3NO3 — , где
Al 3+ ― катион слабого основания и гидролизирует по схеме (вторая стадия практически не происходит):
Al 3+ + H2O ⇄ AlOH 2 + + H + Гидролиз по катиону, pH
Al 3+ + 3NO3 — + H2O ⇄ AlOH 2+ + 3NO3 — + H +
Al(NO3)3 + H2O ⇄ AlOH(NO3)2 + HNO3
Задание 5
Допишите левые части уравнений реакций
Li2SiO3 + H2O = LiHSiO3 + LiOH
SiO3 + H2O = HSiO3 — + OH —
MgBr2 + H2O = MgOHBr + HBr
Mg 2+ + H2O = MgOH + + H +
Задание 6
Смешали растворы карбоната натрия и сульфата алюминия. При этом выделился газ и выпал осадок (объясните почему). Образующаяся в результате реакции соль карбонат алюминия Al2(CO3)2, образована слабой кислотой и слабым основанием, в водном растворе не существует, потому что необратимо разлагается водой, превращаясь в слабую кислоту и слабое основание.
Напишите уравнение реакции:
Na2CO3 + Al2(SO4)3 = [Al2(CO3)3] + Na2SO4
Al2(CO3)3 + 6H2O = 2Al(OH)3↓ + 3H2O + 3CO2 ↑
Суммарное уравнение:
Na2CO3 + Al2(SO4)3 + 6H2O = 2 Al(OH)3 ↓ + 3H2O + 3CO2 ↑ + Na2SO4
Источник