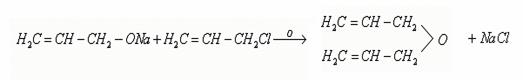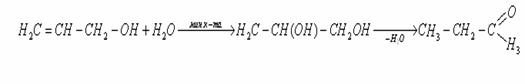Аллиловый спирт плюс бромная вода
Аллиловый спирт, имея в молекуле кратную связь и гидроксильную группу, проявляет свойства спиртов и непредельных соединений:
1. Взаимодействие с галогенами с образованием β — дигалоидгидринов глицерина
Совершенно иначе, чем этиловый спирт, относится аллиловый спирт к хлору и брому; тогда как обыкновенный спирт дает с ними продукты замещения и окисления (напр. хлораль), аллиловый спирт прямо присоединяет два атома хлора, брома или йода, образуя β-дигалоидгидрины глицерина C3H6Cl2O, C3H6Br2O и C3H6J2O [2]:
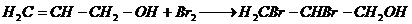
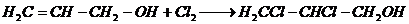
2. Реакция гидрирования [10]:
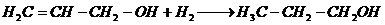
3. Реакция гидратации в присутствии кислорода с образованием глицерина [24]:
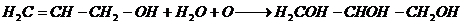
4. Окисление с образованием альдегида [24]
Окислителями переводится в альдегид — акролеин, дальнейшее окисление дает акриловую кислоту:
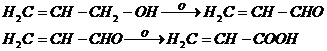
5. Взаимодействие со щелочными металлами с образованием алкоголятов [10]
Со щелочными металлами получаются алкоголяты, которые при действии хлористого аллила дают соответствующий этиловому эфиру аллиловый эфир (С3Н5)2О:

6. Межмолекулярная дегидратация спиртов с образование простых эфиров [27]:
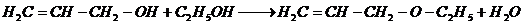
7. Взаимодействие с минеральными и органическими кислотами с образованием сложных эфиров
Образование сложных эфиров происходит при взаимодействии с минеральными и органическими кислотами [26]:

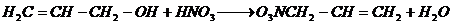
8. Взаимодействие с магнийгалогеналкилами
Происходит замещение гидроксильного водорода на магнийгалоген и выделение углеводорода [10]:
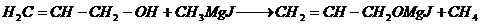
9. Взаимодействие с хлористым фосфором — PCl3 [31]
Треххлористый фосфор дает хлористый аллил C3H5Cl, изомерный с α- и β – хлорпропиленами:

Аналогичным путем образуется йодистый аллил C3H5J:

10. Гидратация под действием слабых минеральных кислот
При действии слабых минеральных кислот аллильный спирт способен присоединять элементы воды, причем превращается в пропиленгликоль который, вновь теряя воду, переходит уже в изомерный с аллиловым спиртом пропионовый альдегид или его продукты конденсации [24]:
Смотрите также
Адсорбция полимеров на неорганических носителях
Адсорбция (от лат. ad — «на, при» и sorbeo — «поглощаю») – это процесс поглощения одного вещества (адсорбата) поверхностью другого (адсорбентом). Процесс проходит самопроизвольно, в не .
Гидроксикарбонильные соединения. Дикарбоновые кислоты
a-Гидроксикарбонильные соединения, как уже отмечалось, могут быть получены окислением диолов гипобромитом натрия или реагентом Фентона. Для a-гидроксикарбонильных соединений характерна .
Электронная структура атомов и одноатомных ионов.
Цель работы: привить навыки составления формул, выражающих электронную конфигурацию атомов и одноатомных ионов металлических и неметаллических элементов. Согласно квантово — механическим пред .
Источник
Химические свойства аллилового спирта
Аллиловый спирт, имея в молекуле кратную связь и гидроксильную группу, проявляет свойства спиртов и непредельных соединений:
1. Взаимодействие с галогенами с образованием β — дигалоидгидринов глицерина
Совершенно иначе, чем этиловый спирт, относится аллиловый спирт к хлору и брому; тогда как обыкновенный спирт дает с ними продукты замещения и окисления (напр. хлораль), аллиловый спирт прямо присоединяет два атома хлора, брома или йода, образуя β-дигалоидгидрины глицерина C3H6Cl2O, C3H6Br2O и C3H6J2O:
2. Реакция гидрирования:
3. Реакция гидратации в присутствии кислорода с образованием глицерина:
4. Окисление с образованием альдегида
Окислителями переводится в альдегид — акролеин, дальнейшее окисление дает акриловую кислоту:
5. Взаимодействие со щелочными металлами с образованием алкоголятов
Со щелочными металлами получаются алкоголяты, которые при действии хлористого аллила дают соответствующий этиловому эфиру аллиловый эфир (С3Н5)2О:
6. Межмолекулярная дегидратация спиртов с образование простых эфиров:
7. Взаимодействие с минеральными и органическими кислотами с образованием сложных эфиров
Образование сложных эфиров происходит при взаимодействии с минеральными и органическими кислотами:
8. Взаимодействие с магнийгалогеналкилами
Происходит замещение гидроксильного водорода на магнийгалоген и выделение углеводорода:
9. Взаимодействие с хлористым фосфором — PCl3
Треххлористый фосфор дает хлористый аллил C3H5Cl, изомерный с α- и β – хлорпропиленами:
Аналогичным путем образуется йодистый аллил C3H5J:
10. Гидратация под действием слабых минеральных кислот
При действии слабых минеральных кислот аллильный спирт способен присоединять элементы воды, причем превращается в пропиленгликоль который, вновь теряя воду, переходит уже в изомерный с аллиловым спиртом пропионовый альдегид или его продукты конденсации:
Полимеризация аллилового спирта идет по следующей схеме:
Операторная модель химико-технологической системы
Операторная схема жидкофазного гидролиза хлористого аллила в аллиловый спирт представлена на рисунке 1.
Хлорпроизводное и водный раствор гидролизирующего агента подают на всасывающую линию компрессора 2, который эмульгирует смесь и сжимает её до давления 15 атм. Причем переключающее устройство гидравлического клапана пускает в действие поршневую ступень компрессора. При этом, в системе давление повышается до желаемого уровня.
В подогревателе 3 реакционная масса нагревается до температуры 1400С, и в изолированном от теплопотерь реакторе 4 процесс ведут до высокой степени конверсии хлорпроизводного (95% и более). После этого жидкость дросселируют в клапане редуктора 5 почти до атмосферного давления, причем часть ее в испарителе — сепараторе 6 испаряется и пары отделяются от жидкости. Органические продукты отгоняют с острым водяным паром; из нижней части испарителя 6 отводят раствор хлористого натрия и избыток щелочи.
В ректификационной колонне 7 аллиловый спирт отделяют, азеотропной перегонкой от диаллилового эфира. Из верхней части колонны при 77,8°С отбирают тройную азеотропную смесь аллилового спирта, диаллилового эфира и воды. Смесь поступает в сепаратор 8, где разделяется на два слоя: нижний (89,5% воды, 10% аллилового спирта и 0,5% диаллилового эфира), и верхний (90% диаллилового эфира; 8,6% аллилового спирта и 1,4% воды). Из сепаратора 8 верхний слой перетекает в аппарат 9, куда также подают воду для извлечения аллилового спирта в сепараторе 10. Из нижней части колонны 7 жидкость направляют в ректификационную колонну 11 для выделения аллилового спирта.
В процессе синтеза, с ректификационных колонн 7, 11, 13 аллиловый спирт поступает в сборник 14.
Щелочь из испарителя — сепаратора 6 вновь возвращается на стадию синтеза.
Побочные продукты от ректификационных колонн 11 и 13: вода и диаллиловый эфир, поступают на стадию утилизации сырья.
Разработка и оптимизация методов получения аллилового спирта является актуальной в химической технологии.
Пропеновый спирт, полупродукт производства глицерина, синтетических смол и пластических материалов, и используется в производстве фармацевтических препаратов и в химическом синтезе вообще, но самое большое применение аллиловый спирт нашел в производстве различных сложных эфиров аллила, из которых наиболее важными являются диаллил — фталат и диаллил — изофталат , которые служат в качестве мономеров и реполимеров .
Рис.1. Операторная схема получения аллилового спирта из хлористого аллила:
1 — смеситель; 2 — компрессор; 3 — подогреватель; 4 – реактор; 5 – редуктор; 6 – испаритель — сепаратор; 7, 11, 13 — ректификационная колонна; 8, 10 – сепаратор; 9, 12 – смеситель; 14- сборник
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |