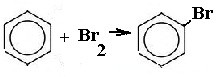- Качественные реакции органических соединений
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Качественные реакции органической химии
- Циклоалканы
- Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
- Содержание:
- Предельные углеводороды
- Химические свойства алканов
- Химические и физические свойства циклоалканов
- Непредельные углеводороды
- Химические и физические свойства алкенов
- Химические и физические свойства диенов
- Химические и физические свойства алкинов
- Ароматические углеводороды
- Химические и физические свойства бензола
- Химические и физические свойства гомологов бензола
- Химические и физические свойства стирола
Качественные реакции органических соединений
Качественные реакции органических соединений
Таблица. Качественные реакции на органические вещества
| Органическое вещество | Реактив | Наблюдаемая реакция | ||||||||||||||||||||||
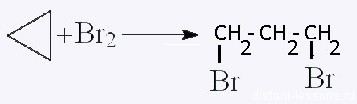
| Алкены, алкины, алкадиены (этилен, ацетилен, дивинил и др.) | Бромная вода, Br2 (р-р) | Обесцвечивание раствора (видеоопыт реакция этилена с бромной водой, ацетилен с бромной) | ||||||||||||||||||||||
| Алкены, алкины, алкадиены (этилен, ацетилен, дивинил и др.) | Перманганат калия KMnO4 | Обесцвечивание раствора (видеоопыт) | ||||||||||||||||||||||
| Алкины с тройной связью на конце цепи (ацетилен С2Н2, пропин и др.) | Аммиачный раствор оксида серебра, [Ag(NH3)2]OH | Выпадение осадка соли серебра (видеоопыт) | ||||||||||||||||||||||
| Многоатомные спирты (этиленгликоль, глицерин и др.) | Свежеосажденный гидроксид меди (II) Сu(OH)2 | Образование ярко-синего раствора комплекса (видеоопыт) | ||||||||||||||||||||||
| Фенолы (С6Н5ОН — фенол и др.) | Бромная вода, Br2 (р-р) | Выпадение белого осадка | ||||||||||||||||||||||
| Раствор хлорида железа (III) FeCl3 | Образование фиолетового раствора | |||||||||||||||||||||||
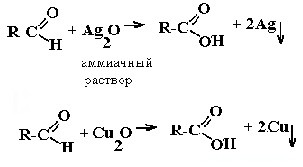
| Альдегиды (СН2О — муравьиный альдегид и др.) + муравьиная кислота НСООН + глюкоза (и другие углеводы-альдозы) Источник Химия, Биология, подготовка к ГИА и ЕГЭКачественные реакции органической химии
Это означает, что качественные реакции — это реакции с ощутимым эффектом -цвет, запах, изменение состояния вещества. «Селективность» — означает, что желательно, чтобы такая реакция на данный класс веществ или на данное вещество была уникальна. Высокая чувствительность — даже очень небольшое количество вещества должно проявляться в такой реакции. С уникальностью в органической химии немного проблематично, но тем не менее, есть достаточно много реакций для определения того или иного вещества . Итак, классы органических соединений и соответствующие им качественные реакции:
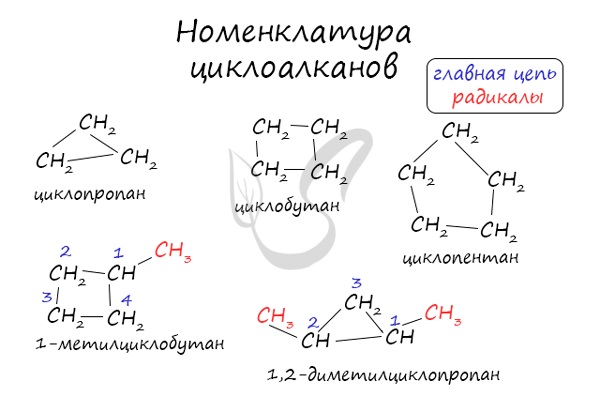
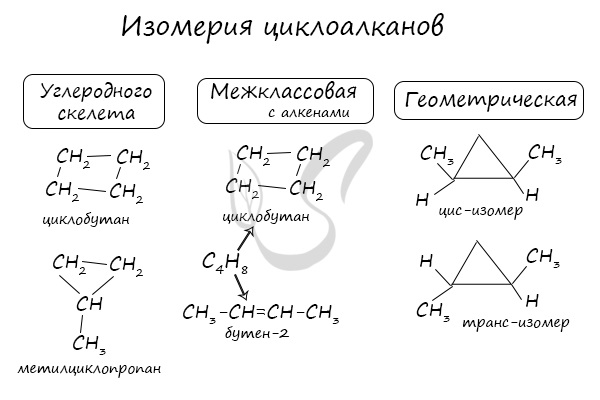
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям. Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам. Источник ЦиклоалканыЦиклоалканы (циклопарафины, нафтены) — циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только простые одинарные сигма связи (σ-связи), не содержат ароматических связей. Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их гомологического ряда — CnH2n. Номенклатура и изомерия циклоалкановНазвания циклоалканов формируются путем добавления приставки «цикло-» к названию алкана с соответствующим числом: циклопропан, циклобутан и т.д. Как и у алканов, атомы углерода циклоалканов находятся в sp 3 гибридизации. Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров. Получение циклоалкановВ промышленности циклоалканы получают несколькими способами:
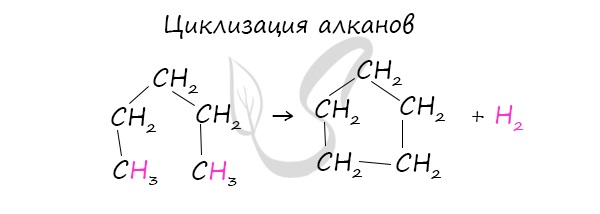
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов. При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород. В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
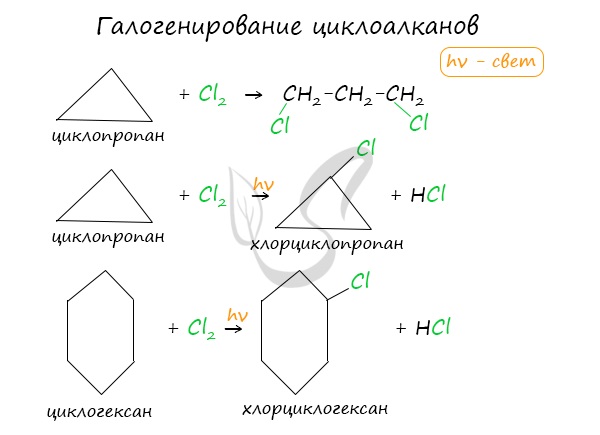
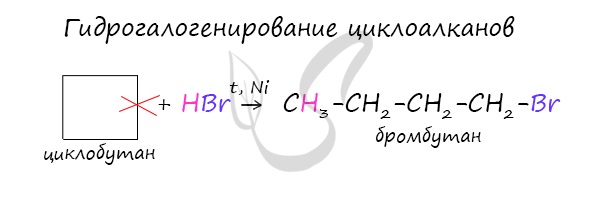
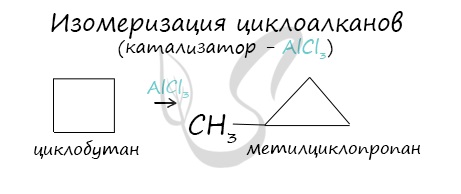
Химические свойства циклоалкановВажно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана реакции присоединения не характерны, они преимущественно вступают в реакции замещения. Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования (в рамках вопросов ЕГЭ — не вступают, но на самом деле эти реакции идут, просто крайне затруднены). Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция идет, как и у алканов, по механизму замещения. У циклопентана и циклогексана реакция идет только путем замещения. В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан. При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов — гомологи бензола. В ходе нагревания с катализатором — AlCl3 циклоалканы образуют изомеры. © Беллевич Юрий Сергеевич 2018-2021 Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. Источник Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)Содержание:Углеводороды – это органические соединения, которые состоят из углерода и водорода (иногда замещается на группы). Существует огромное количество углеводородов и для них существует множество классификаций. По составу углеродного скелета делятся на:
По наличию кратных связей и открытости цепи:
Предельные углеводородыХимические свойства алкановАлканы (парафины) – это соединения, для которых характерна sp 3 -гибридизация и наличие только σ-связи. Используются как источник энергии в промышленности и помощник в получении белка в микробиологии. I. Реакции замещения Эти реакции сопровождаются гомолитическим разрывом, который начинается в неорганических молекулах. Реакции замещения являются основным типом реакций, которые характерны для молекул алканов. В связи с высокой энергией ионизации в молекуле алканов очень насыщенные связи, из –за чего химическое взаимодействие затруднено. Общим для реакций замещения являются жесткость условий и наличие сильных окислителей. В ходе взаимодействия с хлором или бромом получается взрывчатое вещество, имеющее практическое значение. Взаимодействие с фтором провоцирует взрыв, не имеющее промышленного отклика. А реакция с йодом протекает очень медленно, поэтому редко проводится. Идет под воздействием света. Замещение водорода проходит у наименее гидрированного атома углерода. 1888 год – Коновалов открыл реакцию взаимодействия алканов с азотной кислотой (13-14 %) под воздействием температуры в 140°С. Она используется для производства ракетного топлива и взрывчатых веществ. Эту реакцию используют при мыловарении и в производстве синтетических моющих средств. II. Реакции с разрывом углерод-углеродной связи Энергия связи «углерод-углерод» высокая, поэтому она достаточно прочная. Реакций, сопровождающихся разрывом этой связи, немного и все они проходят в жестких условиях. При нормальных условиях алканы не реагируют с сильными окислителями, такими как серная кислота, перманганат или дихромат калия. Алканы горят бесцветным или голубоватым пламенем. У метана, этана, пропана, бутана и пентана копоть не наблюдается, а у соединений с длинными углеродными цепями она есть. Идет в присутствии катализатора. Это химический процесс, протекающий при действии высоких температур. В результате углеродная цепь рвется, и образуются молекулы алкана и алкена. Крекинг бывает: термическим; каталитическим. Для каталитической реакции используются катализаторы и меньшие температуры. III. Реакции с разрывом углерод-водородной связи Алканы – это вещества, с помощью которых можно получить соединения с кратными связями. Отщепление водорода осуществляется в присутствии катализаторов и при высоких температурах. При дегидрировании алканов с длинными углеродными цепями образуются алкены. Нагревание линейных алканов с катализатором провоцирует образование веществ с разветвленным углеродным скелетом. Из алканов получают топливо, которое широко используют в микробиологии, биотехнологиях, органическом синтезе. Химические и физические свойства циклоалкановЦиклоалканы (нафтены) – это насыщенные циклические углеводороды. Циклоалканы по физическим свойствам схожи с линейными алканами. Циклопропан и циклобутан – это газы, а начиная с циклопентана – жидкости с температурой кипения и плотностью выше, чем у соответствующих парафинов. Не растворяются в воде, но растворимы в эфирах. I. Реакции присоединения Реакционная способность зависит от размера цикла. Низшие циклоалканы напоминают алкены, а высшие – алканы. Действие галогена различно в зависимости от условий.
Малые циклы в нормальных условиях Средние циклы под воздействием света (реакция замещения) Взаимодействие с галогеноводородами Реакция протекает в водном растворе. В случае несимметричных молекулах соблюдается правило Марковникова. Реакция проходит при высоких температурах и под действием таких катализаторов как никель, платина. II. Дегидрирование Высокие температуры (500°С) по-разному действуют на малые и большие циклы. III. Горение Устойчивость к окислителям повышается по гомологическому ряду. Циклоалканы содержатся в нефтяных продуктах, и вырабатывается некоторыми видами растений. В природе они способны подвергаться микробиологическому окислению. Непредельные углеводородыХимические и физические свойства алкеновАлкены (этиленовые углеводороды) – органические соединения, содержащие одну двойную связь. Температура плавления и кипения увеличивается по гомологическому ряду. При нормальных условиях с этена по бутен – газы, с пентена по гептадецен – жидкости, а далее твердые вещества. Они не растворяются в воде, но растворимы в эфирах. π- связь менее прочная, чем σ-связь. Это связано с тем, что у негибридных облаков глубина перекрывания меньше. Для алкенов наиболее характерны реакции присоединения. Кроме того, алкены – это доноры электронов и их рассматривают как основания Льюиса. I. Реакции присоединения Электроны π-связи находятся вне плоскости, поэтому они более доступны для атакующей электрофильной частицы. Реакция протекает под воздействием температуры и катализатора никеля. Реакционная способность уменьшается в ряду HJ-HBr-HCl-HF. В этих реакциях действует правило Марковникова. Он утверждал, что при взаимодействии галогеноводородов или воды с несимметричными алкенами, водород присоединяется к более гидрированному атому углерода, а галоген – к менее. Правило имеет несколько исключений.
Реакция подразумевает присоединение бромоводорода в присутствии перекиси водорода. Присутствие в молекуле алкена электроно-акцепторных функциональных групп в sp 3 -части. Спирты образуются при присоединении алкенов с водой в присутствии серной кислоты, высоких температурах и при оксиде алюминия. II. Реакции полимеризации Полимер – это соединение, состоящее из множества мономеров. Полимеризация не приводит к изменению качественного и количественного состава мономеров. Получение полиэтилена из этена имеет цепной или ступенчатый характер. III. Реакции замещения (галогенирование) Реакции замещения водорода могут проходить и у непредельных алкенов, но в их sp 3 -части. Проходят при жестких условиях – температура свыше 500°С. IV. Окисление Идет легко и образует разные продукты в зависимости от условий. Алкены горят желтым светящимся пламенем. Осуществляется в нейтральной среде при окислении с помощью перманганата калия. В результате образуются диолы, причем гидроксильные группы присоединяются к атомам углерода кратной связи. Проходит в кислой среде. При окислении с помощью кипящего раствора перманганата калия происходит полное разрушение кратной связи, и атомы углероды способны создать карбоновую кислоту или углекислый газ. В симметричной молекуле алкена образуется две молекулы одной и той же кислоты. Если в соединении при кратной связи содержится два углеродных заместителя, то при окислении происходит образование кетона. Жесткое окисление проходит и в щелочной среде. Те же реакции проходят в присутствии дихромата калия. Алкены – это исходный продукт в производстве полимеров и других органических веществ. Химические и физические свойства диеновАлкадиены – это органические соединения, имеющие две двойные связи. Существует несколько видов диенов:
В нормальных условиях пропадиен и бутадиен-1,3 являются газами, а изопрен – летучей жидкостью. Алкадиены с изолированными связями – жидкости. Высшие диены находятся в твердом состоянии. I. Реакции присоединения У кумулированых и изолированных сначала взаимодействует с реагентом одна связь, а затем другая. А у сопряженных кратные связи образуют единую систему в центре молекулы, при этом параллельно идет процесс присоединения. CH2=CH-CH=CH2 + Br2 → Br-CH2-CH=CH-CH2-Br С помощью этой реакции обесцвечивание бромная вода. Реакция идет при нагревании в 60°С. II. Полимеризация В процессе этих реакций образуются эластомеры (синтетические каучуки). Проводится в присутствии натрия. Алкадиены могут обесцвечивать раствор перманганата калия. Из диенов получают каучуки, из которых производят резину различных марок. Химические и физические свойства алкиновАлкины – это органические соединения, имеющие одну тройную связь. По гомологическому ряду температура плавления и кипения увеличивается. В нормальных условиях этин, пропин, бутин – газы, с пентина по гексадецентин – это жидкости, а далее, по увеличению молекулярной массы, — твердые вещества. Температуры кипения у алкинов выше, чем у соответствующих алкенов. Плохо растворяются в воде, хорошо – в органических растворителях. I. Реакции присоединения В процессе реакции присоединение происходит сначала по одной π-связи, а затем по другой. Идут по механизмам электрофильного и нуклеофильного присоединения. Электрофильное присоединение Идет под действием катализатора никеля. CH≡CH + Cl2 → Cl-CH=CH-Cl Гидратация (реакция Кучерова) Вышеперечисленные реакции могут подразумевать как присоединение одной молекулы, так и нескольких. В гидратации возможно присоединение только одной молекулы воды. Реакция Кучерова проходит при температуре в 70°С и катализатора в виде сульфата ртути. Нуклеофильное присоединение
Проходит в присутствии меди в аммиачном растворе. Присоединение уксусной кислоты II. Полимеризация Протекает в присутствии солей меди и повышенных температурах. Тримеризация (реакция Зелинского) Протекает в присутствии активированного углерода и температурах свыше 500°С. 3 III. Реакции замещения Замещение происходи у водорода, стоящего при углероде с кратной связью.
Взаимодействие с аммикатами серебра или одновалентной медью Получающиеся соединения взрывоопасны. Чтобы их нейтрализовать, необходимо залить их соляной кислотой. IV. Окисление Этин горит с большим выделением тепла. В нейтральной и слабощелочной средах образуются соли щавелевой кислоты , а окисление гомологов провоцирует разрыв тройной связи с образование солей карбоновых кислот. 3 CH≡CH + 8 KMnO4 → 3 KOOC-COOK + 8MnO2 + 2 KOH + 2 H2O В кислой среде окислитель расщепляет кратную связь с образованием карбоновых кислот. Только ацетилен используется в промышленности, и именно он является важным химическим сырьем. Ароматические углеводородыХимические и физические свойства бензолаНаличие ароматического кольца влияет на характер химических реакций. Единая 6π-система электронов устойчива, поэтому ароматическим углеводородам характерны реакции электрофильного замещения. Бензол – это бесцветная жидкость, имеющая резкий запах. Горит сильно коптящим пламенем. Образует с воздухом взрывчатые смеси. I. Реакции замещения Все эти реакции протекают по механизму бимолекулярного нуклеофильного замещения. II. Реакции присоединения Протекают только в жестких условиях. Присоединяться способны только богатые энергией реагенты. Идет под воздействием температуры и катализаторов в виде платины. Галогенирование под воздействием света При нормальных условиях азотная кислота, хромовая кислота и др. не могут окислить бензол. Он окисляется только в жестких условиях под действием кислорода, катализатора оксида ванадия и при температуре в 450°С. Химические и физические свойства гомологов бензолаУ гомологов бензола такие же физические свойства, что и у самого бензола. Во многом и химические свойства схожи. I. Электрофильное замещение Радикалы гомологов бензола повышают электронную плотность на кольце в орто- и параположениях. Катализатор – хлорид алюминия. Нитрование в ядро Сульфирование в ядро Алкилирование в ядро II. Реакции по боковой цепи Осуществляется в присутствии света. Принцип замещения схож с реакцией алканов. В отличие от бензола его гомологи способны вступать в реакции окисления. Окисление дизамещенных гомологов происходит по такому же принципу. Получение непредельных соединений Реакция проходит под действием оксида цинка. Химические и физические свойства стиролаСтирол – это бесцветная жидкость, имеющая резкий запах. Плохо растворяется в воде, но хорошо в органических растворителях. I. Реакции присоединения Стирол обесцвечивает бромную воду. Реакция идет не по бензольному кольцу, а по виниловой группе. II. Полимеризация В ходе реакции образуется полистирол – твердая стекловидная масса. При производстве полимеров активно используется стирол. На его основе создаются полистирол, пенопласт, пластики. Источник |
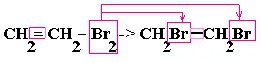 2. Изменение окраски раствора
2. Изменение окраски раствора