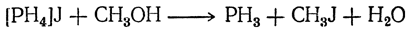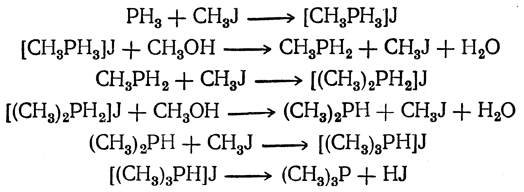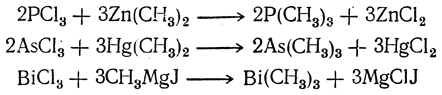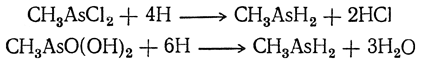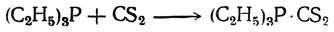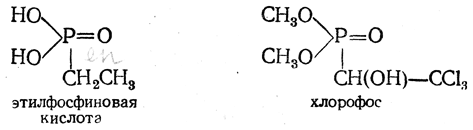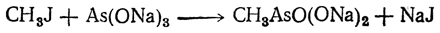- Летучие водородные соединения
- Строение и физические свойства
- Способы получения силана
- Способы получения аммиака
- Способы получения фосфина
- Способы получения сероводорода
- Химические свойства силана
- Химические свойства фосфина
- Химические свойства сероводорода
- Химические свойства прочих водородных соединений
- Способы получения фосфинов, арсинов, стибинов и висмутинов
- Номенклатура неорганических соединений (по правилам ИЮПАК)
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения. Это метан, силан, аммиак, фосфин, арсин, сероводород, вода, галогеноводороды. Способы получения и химические свойства.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды) при нормальных условиях.
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Источник
Способы получения фосфинов, арсинов, стибинов и висмутинов
а затем фосфористый водород, галоидный алкил и спирт реагируют дальше, образуя, в конце концов, третичные фосфины:
Если же нагревать иодистый фосфоний [PH4]J с галоидными алкилами при 100—150° С в присутствии окиси цинка, то получается смесь первичных и вторичных фосфинов, а третичные не образуются
2. Действие металлоорганических соединений на трехгалоидные производные. Третичные соединения образуются из трехгалоидных производных фосфора, мышьяка и т. д. при взаимодействии с металлоорганическими соединениями:
3. Восстановление алкилгалоидарсинов и арсинов ых кислот. Первичные и вторичные арсины могут быть получены восстановлением алкилгалоидарсинов и соответствующих алкиларсиновых кислот:
Фосфины — нерастворимые в воде вещества с сильным отвратительным запахом; они очень токсичны. Метилфосфин СН3РН2 кипит при —14° С, диметилфосфин (СН3)2РН — при 25° С, триметилфосфин (СН3)3Р — при 41° С. У фосфинов склонность к окислению настолько велика, что они могут самовоспламеняться на воздухе. Не обладая в водном растворе щелочной реакцией (как аммиак и амины), фосфины с сильными кислотами все же дают соли.
Для третичных фосфинов характерна способность давать с сероуглеродом ярко-красные, малорастворимые продукты присоединения (реакция применяется для открытия и идентификации сероуглерода):
Алкилфосфиновые и диалкилфосфиновые кислоты — бесцветные кристаллические вещества, легко растворимые в воде; обычными восстановителями не переводятся в соответствующие фосфины.
Эффективным инсектицидом, безвредным для теплокровных, является производное этилфосфиновой кислоты — хлорофос:
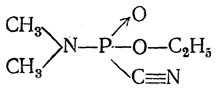
Из производных кислородных кислот фосфора следует отметить этиловый зфир N-диметиламиноцианфосфиновой кислоты:
Это соединение, получившее название табун, представляет собой жидкость (относительная плотность 1,056, т. кип. 250° С), несколько растворимую в воде при обычных температурах (2—3%). Табун обладает слабым фруктовым запахом. Это вещество сильно ядовито. После вдыхания его паров появляется головная боль, сужение зрачков и чувство стеснения в груди; при больших концентрациях наступает смерть. Вещество проникает через кожу и слизистые оболочки и вызывает при этом такой же токсический эффект, как и при вдыхании.
Арсины — малорастворимые в воде вещества с сильным неприятным запахом; чрезвычайно токсичны. Метиларсин CH3AsH2 кипит при 2° С, диметиларсин (CH3)2AsH — при 35° С. Арсины очень легко окисляются кислородом, могут самовоспламеняться. Они представляют собой нейтральные вещества и неспособны образовывать соли.
Алкиларсиновые и диалкиларсиновые кислоты — бесцветные кристаллические вещества, легко растворимые в воде. Это сильные кислоты, которые с сильными основаниями дают нейтральные соли. Они могут сравнительно легко восстанавливаться в соединения трехвалентного мышьяка.
Метиларсиновая кислота может быть получена действием галоидных алкилов на мышьяковистокислый натрий:
Натриевая соль метиларсиновой кислоты CH3AsO(ONa)2·6Н2О под названием арренала, а также натриевая соль диметиларсиновой (какодиловой) кислоты (CH3)2AsO(ONa) применяются в медицине. Токсичность мышьяка, вводимого в организм в этой форме, значительно ниже, чем в виде солей мышьяковой кислоты.
Этилдихлорарсин C2H5AsCl2 — тяжелая жидкость (относительная плотность 1,68) с резким раздражающим запахом, кипящая при 155° С. Применялся во время первой мировой войны как боевое отравляющее вещество.
Источник
Номенклатура неорганических соединений (по правилам ИЮПАК)
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Номенклатура неорганических соединений (по правилам ИЮПАК).
- 1.4.1. Названия для групп элементов
- 1.4.2. Систематические названия для соединений
- 1.4.3. Названия для катионов и анионов
- 1.4.4. Номенклатура оснований и гидратов
- 1.4.5. Номенклатура кислот
- 1.4.6. Номенклатура солей
- 1.4.7. Комплексные соли. Номенклатура комплексных соединений
ИЮПАК – международный союз теоретической и прикладной химии. Правила ИЮПАК 1970 г. являются международной моделью, по которой создаются номенклатурные правила для химических соединений на языке соответствующей страны. Эти правила являются компромиссными, т.к. допускают не только систематические, но и тривиальные наименования, т.е. они не в полной мере совершенны. Вместе с тем, правила ИЮПАК передают эмпирическую формулу, а иногда и основные структурные свойства соединения, отражая таким образом состав и очевидные свойства вещества.
Названия для групп элементов.
Элементы классифицируются как металлы, полуметаллы и неметаллы. Применение названия «металлоид» не рекомендуется.
Допускается использование следующих групповых названий: щелочные металлы (от Li до Fr), щелочноземельные металлы (от Ca до Ra), галогены (от F до At), халькогены (от О до Ро), благородные газы (от Не до Rn). Переходные элементы – элементы, атомы которых имеют незаполненную d-оболочку, или образующие катионы с незаполненной d – оболочкой. Редкоземельные элементы – металлы – Sc, Y, элементы от La до Lu. Лантаноиды – элементы от La до Lu, аналогично используются названия актиноиды, ураноиды и кюроиды.
Систематические названия для соединений.
Систематические названия соединений образуются путем указания составляющих и их соотношений в соответствии со следующими принципами. Многие природные химические соединения по существу бинарны, остальные соединения можно считать бинарными с точки зрения номенклатуры.
Электроположительная составляющая (катион) в формулах и названиях всегда занимает первое место, например, NaCl – натрий хлорид. Для соединений, содержащих более одного катиона и более одного аниона, внутри каждого класса составляющих должен быть алфавитный порядок их символов. Кислоты рассматриваются как водородные соли. Чтобы определить место комплексных ионов, во внимание принимается только символ центрального атома.
Если электроотрицательная составляющая – моноатомная или гомополиатомная, ее название изменяется в окончании на –ид. В формулах и названиях бинарных соединений неметаллов на первое место следует помещать составляющую, стоящую раньше (левее) в следующем ряду:
Rn, Xe, Kr, B, Si, C, Sb, As, P, N, H, Te, Se, S, At, J, Br, Cl, O, F.
Для бинарных соединений название элемента, стоящего дальше в этом ряду, изменяется в окончании на –ид, например, HCl – водород хлорид, OF2 – кислород дифторид.
Летучие гидриды, кроме элементов VII группы, кислорода и азота, можно называть с использованием суффикса –ан, например, Si2H6 – дисилан.
Допускаются названия вода, аммиак, гидразин, фосфин, арсин, стибин, висмутин.
Если электроотрицательная составляющая является гетерополиатомной, ее следует обозначить окончанием –ат. Термины сульфат, фосфат и т.д. обозначают, как правило, отрицательную группу с серой или фосфором в качестве центрального атома независимо от его состояния и количества и природы лигандов. Комплекс заключается в квадратные скобки [ ], но это не всегда обязательно.
Na2[SO4 ] – динатрий тетраоксосульфат
Na2 [S2O3 ] – динатрий триоксотиосульфат
K [PF2O2 ] – калий диоксодифторфосфат
Во многих случаях (если нет особой необходимости) эти названия могут быть сокращены, например, натрий сульфат, натрий тиосульфат.
Стехиометрические соотношения можно указывать с помощью приставок моно-, ди-, три-, тетра-, пента-, гекса-, гепта-, окта-, нона-, дека-, ундека-, додека-, геми- (полу-), сескви- (полтора-) и т.д. (приставку моно- «можно опускать в случаях, исключающих неоднозначность толкования»), а также , исходя из степени окисления электроположительной составляющей. Например:
N2O – диазот оксид, азот (I) оксид
NO2 – азот диоксид, азот (IV) оксид
V2O3 – диванадий триоксид, ванадий (III) оксид
VO1,5 – ванадий сесквиоксид, ванадий (III) оксид
V2O5 – диванадий пентаоксид, ванадий (V) оксид
N2S5 – диазот пентасульфид, азот (V) сульфид
FeCl2 – железо дихлорид или феррум дихлорид, железо (II) хлорид или феррум (II) хлорид
K4[ Ni(CN)4 ] – калий тетрацианоникколат (0).
«Функциональная» терминология, например, употребление названия «азотный ангидрид» для N2O5 не рекомендуется.
Названия для катионов и анионов.
Моноатомные катионы следует обозначать по названию элемента без его изменения для добавления суффикса. Например:
Cu 1+ – медь (I) ион
Сu 2+ – медь (II) ион
I + – иод (I) катион
Полиатомные катионы, образованные из моноатомных катионов путем добавления к ним других ионов, нейтральных атомов или молекул (лигандов), могут рассматриваться как комплексы. Например:
[Al(H2O)6 ] 3+ – гексаакваалюминий ион
[ COCl(NH3)5 ] 2+ пентаамминхлорокобальт (II) ион.
Названия для полиатомных катионов, возникающих при добавлении к моноатомным анионам большего числа протонов, чем требуется для получения нейтральной частицы, образуются путем добавления окончания –оний к корню названия элемента аниона: оксоний, фосфоний, арсоний, стибоний, сульфоний, селеноний, теллуроний, фтороний, иодоний ионы.
Исключением из этого правила является название аммоний для NH4 +
Названия для моноатомных анионов состоят из названия элемента с окончанием –ид:
Рекомендуется для названий моноатомных ионов всегда употреблять окончание – ид, когда заряд иона соответствует вышеуказанному.
Некоторые полиатомные анионы имеют названия, оканчивающиеся на –ид:
Названия для других полисульфидов, полигалогенидов и других подобных ионов, содержащих элементы одного класса, могут быть образованы аналогичным образом. Ион НО – не следует называть гидроксил ион. Название гидроксил сохраняется для группы НО, нейтральной или положительно заряженной. Такие ионы, как HS – и HO2 – , называются соответственно водородсульфид и водородпероксид ионы.
Названия для других многоатомных анионов должны состоять из корня названия центрального атома с окончанием –ат. Атомы и группы, присоединенные к центральному атому, обычно рассматриваются как лиганды в комплексе, например, [Sb(OH)6] – гексагидроксоантимонат (V) ион.
Название кислорода в анионах принято опускать, а присутствие этого элемента и пропорции указывать посредством приставок гипо-, пер- и т.д., а иногда также и суффикса –ит вместо –ат (для обозначения низших степеней окисления). Суффикс –ит можно сохранить в следующих традиционных названиях:
Номенклатура оснований и гидратов.
Номенклатура оснований подчиняется в принципе тем же правилам, что и для бинарных соединений. Наименования оснований складываются из названия электроположительной составляющей и слова гидроксид. Для металлов, имеющих различные степени окисления и образующих несколько оснований, к слову гидроксид добавляют приставки моно, ди и т.д. или указывают степень окисления:
КОН – калий гидроксид
Мо(ОН)2 – магний гидроксид
Fe(ОН)2 – железо гидроксид, железо (II) гидроксид.
Термины «смешанные оксиды» и смешанные гидроксиды» не рекомендуются. Такие соединения нужно назвать двойными, тройными и т.д.
У оксидов и гидроксидов металлы перечисляются в алфавитном порядке, например, AlLiMn2O4(OH)4 – алюминий литий димарганец (IV) тетрагидроксид тетраоксид.
Окончание -ат теперь является принятым окончанием для анионов и его не следует использовать для молекулярных соединений. Однако одно исключение признается. В соответствии со своим окончанием гидрат теперь твердо применяется для соединений, содержащих кристализационную воду, и допускается для обозначения воды, связанной неопределенным образом. Названия гидратов можно образовывать из названий отдельных соединений, записывая их через дефис и указывая в конце число молекул арабскими цифрами, разделенными дробной чертой:
3CdSO4· 8H2O – кадмий сульфат-гидрат (3/8)
Na2CO3 ·10H2O – натрий карбонат-гидрат (1/10) или натрий карбонат декагидрат
В случае, если имеются данные о структуре, возможно, например, такое обозначение: Fe(H2O)6SO4·H2O – гексаакважелезо (II) сульфат моногидрат.
Номенклатура кислот.
Номенклатура кислот имеет давнюю историю с прочно укоренившимися традициями. Правила ИЮПАК сохраняют наиболее полезные из старых названий, и в то же время в них делается попытка дать руководство для более рациональных названий новых соединений.
Кислоты, от которых образованы названия анионов с окончанием –ид, рассматриваются как двойные и псевдодвойные соединения водорода, например, H2S – водород сульфид, HCN – водород цианид.
Кислоты, от которых происходят названия анионов с окончаниями –ат и –ит, можно рассматривать как и в предыдущем пункте, но в соответствии со сложившейся практикой их названия получаются путем присоединения к слову кислота прилагательного с окончанием (-ый, -ыватый) и (-истый, -ватистый) в зависимости от окончания анионов –ат и –ит соответственно. Таким образом, хлорноватая кислота соответствует хлорату, серная – сульфату, азотистая – нитриту. Окончание –ит употребляется для обозначения низших степеней окисления.
В ряде случаев различие между разными степенями окисления характеристических атомов в оксокислотах указывается приставками. Но это обозначение не следует распространять за пределы случаев, перечисленных ниже.
Приставка гипо- применяется, чтобы обозначить более низкую степень окисления: HСlO гипохлористая кислота, HВrO – гипобромистая кислота, HJO – гипоиодистая кислота. В русской химической терминологии для этих соединений укоренились соответственно названия: хлорноватистая, бромноватистая, иодноватистая кислоты.
Приставка пер- применяется, чтобы обозначить более высокую степень окисления и сохраняется только для HСlO4 (перхлорная кислота) и для соответствующих кислот других элементов VII группы. Применение приставки пер- не должно распространяться на элементы других групп.
Приставки орто– и мета- применяются, чтобы распознать кислоты, различающиеся по «содержанию воды». Одобряются следующие названия:
H3BO3 – ортоборная кислота
H2SiO4 – ортокремниевая кислота
H3PO4 – ортофосфорная кислота
H5IO6 – ортопериодная кислота
H6TeO6 – ортотеллуровая кислота
(HBO2)n – метаборная кислота
(H2SiO3)n – метакремниевая кислота
(HPO3)n – метафосфорная кислота
Приставка пиро- применяется для обозначения кислоты, состоящей из двух молекул ортокислоты с вычетом одной молекулы воды. Название пирофосфорная кислота можно сохранить для H4P2O7, хотя название дифосфорная кислота предпочтительнее.
Когда приставка пероксо- применяется с тривиальными названиями кислот, она указывает замещение иона – О – ионом – О – О –. Например:
HNO4 – пероксоазотная кислота
Кислоты, образованные из оксокислот путем замещения кислорода серой, называются тиокислотами. Когда замещено более одного атома кислорода, количество атомов серы желательно указывать:
HSCN – тиоциановая кислота
Кислоты, содержащие другие лиганды, а не кислород и серу, обозначаются обычно по номенклатуре координационных соединений.
Нижеприведенный список содержит принятые названия для некоторых оксокислот и их пероксо- и тио- производных.
H2CO3 – угольная кислота
HOCN – циановая кислота
HNCO – изоциановая кислота
HONC – гремучая кислота
HNO3 – азотная кислота
HNO2 – азотистая кислота
H2NO2 – нитроксильная кислота
H2N2O2 – гипоазотистая кислота
H3PO5 – пероксомонофосфорная кислота
H2PHO3 – фосфоновая кислота
H3AsO4 – мышьяковая кислота
H2SO4 – серная кислота
H2S2O7 – дисерная кислота
H2S2O3 – тиосерная кислота
H2SO3 – сернистая кислота
H2SeO4 – селеновая кислота
H2SeO3 – селенистая кислота
H2CrO4 – хромовая кислота
H2Cr2O7 – дихромовая кислота
HСlO3 – хлорновая кислота
HBrO4 – пербромная кислота
HBrO3 – бромноватая кислота
HIO3 – иодноватая кислота
HMnO4 – пермарганцовая кислота
H2ReO4 – рениевая кислота
Номенклатура солей.
Простые соли относятся к классу бинарных соединений, и их названия образуют из названий составных ионов.
Названия солей, содержащих не полностью замещенный в кислоте водород («кислые соли»), с добавлением слова «водород». В случае необходимости перед водородом указывается числовой префикс. За водородом без пробела следует название аниона:
NaHCO3 – натрий водородкарбонат
LiH2PO4 – литий диводородфосфат
KHS – калий водородсульфид
В формулах двойных, тройных и др. солей катионы, кроме водорода, перечисляются в алфавитном порядке. Водород называется последним среди катионов. Если необходимо отметить присутствие какого-либо конкретного гидратированного катиона, его рассматривают как комплексный ион и указывают в названии в порядке алфавита:
KMgF3 – калий магний фторид
NaTl (NO3)2 – натрий таллий (I) нитрат или натрий таллий динитрат
Na(UO2)3[Zn(H2O)6](C2H3O2)9 – нонаацетат гексааквацинк натрий триуранил (VI)
Оксидные и гидроксидные («основные») соли для целей номенклатуры следует рассматривать как двойные соли, содержащие анионы О 2- и НО – . Сначала указывают название металла, затем слово «оксид» или «гидроксид», а затем название кислотного остатка:
BiClO – висмут оксид хлорид
MgCl(OH) – магний гидроксид хлорид
VOSO4 – ванадий (IV) оксид сульфат
ZrCl2O · 8H2O – цирконий оксид дихлорид октагидрат
Комплексные соли. Номенклатура комплексных соединений.
В названиях координационных соединений центральный атом следует указывать после лигандов.
Название соединений с комплексным анионом, например К3[Fе(СН)6], комплексным катионом [Li(H2О)4]NO3 и нейтральным комплексом [Pt(C2H4)(NH3)Cl2], в целом, строится так же, как и названия соответствующих солей или других сложных соединений. Для сравнения приведем названия этих комплексных соединений и соответствующих «некомплексных» аналогов:
Названия лигандов, являющихся нейтральными молекулами, обычно берутся без изменения.
Стехиометрические отношения можно указывать с помощью стехиометрических префиксов или не указывать вообще:
K3[Fe(CN)6] – гексацианоферрат (III) калия или трикалий гексацианоферрат
K4[Fe(CN)6] – гексацианоферрат (II) калия или тетракалий гексацианоферрат
Для сложных лигандов, которые сами содержат числительные, употребляют особые числительные: бис – 2, трис – 3, тетракис – 4:
[Co(NH3)3(NO2)3] 3+ – тринитротриамминкобальт (III)
K2[Zn(CNS)4] – тетрароданоцинкат(II) калия
[Zn(H2O)4](NO3)2 – тетрааквацинка (II) нитрат
K[Au(OH)4] – тетрагидроксоаурат (III) калия
[Pt(P(C6H5)3)2Cl2] – дихлорбистрифенилфосфинплатина (III)
Na2[Fe(CN)5NO] – нитрозилпентацианоферрат (III) натрия
K3[Fe(CN)5CO] – карбонилпентацианоферрат (II) калия
В соответствии с рекомендациями Международного союза теоретической и прикладной химии название комплексного аниона начинают с указания состава внутренней сферы. Во внутренней сфере, прежде всего называют лиганды – анионы, прибавляя к их латинскому названию окончание «о». Например: С1 – – хлоро, CN – – циано, SО3 2- – сульфито, ОН – – гидроксо
CH3COO – – ацетато
CH3OSOO – – метилсульфито
F – – фторо
I – – иодо
O2 – – оксо
H – – гидридо или гидро
OH – – гидроксо
O2 2 – – пероксо
Далее называют нейтральные лиганды. При этом пользуются терминами: для координированного аммиака – аммин, для воды – аква, для оксида углерода (II) – карбонил. Число лигандов указывают греческими числительными: 1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Затем называют комплексообразователь, используя корень его латинского названия и окончание ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя. После обозначения состава внутренней сферы называют внешнесферные катионы.
В случае неэлектролитов (комплексообразователь и лиганды образуют не внутреннюю, а единственную комплексную сферу с нулевым зарядом) вместе с лигандами степень окисления центрального атома не приводят, так как она однозначно определяется, исходя из электронейтральности комплекса.
Если центральный атом входит в состав комплексного катиона, то используют русское название элемента и в скобках указывают его степень окисления. Приведем другие примеры:
Источник