- Аммиак плюс вода что будет
- § 24. Аммиачная вода
- Аммиак: получение и свойства
- Аммиак
- Строение молекулы и физические свойства
- Способы получения аммиака
- Химические свойства аммиака
- Аммиак плюс вода что будет
- Аммиачная вода: что это такое, образование и содержание аммиака в питьевой жидкости, чем опасен его избыток, свойства и польза
- Что это такое
- Нормативная концентрация аммиака
- Определение и норма содержания аммиака в питьевой воде
- Физические характеристики
- Химические свойства
- Сфера использования
- Сельское хозяйство
- Промышленность
- Медицина
- Виды аммиачной воды
- Получение и хранение аммиачной воды
- Меры предосторожности
- Как сделать аммиачную воду для использования на даче
- Борьба с вредителями
- Образование аммиачной воды и приготовление для подкормки
- Соли аммония
- Как хранить гидроокись аммония
- Плюсы вещества
Аммиак плюс вода что будет
§ 24. Аммиачная вода
Водородные соединения уже изученных нами неметаллов растворяясь в воде, реагируют с нею с образованием ионов гидроксония. Реагирует с водой при растворении в ней и аммиак, но иначе.
Опустим в кристаллизатор с водой сосуд, наполненный аммиаком, отверстием вниз. Вода быстро заполнит сосуд доверху, то показывает, что аммиак очень хорошо растворяется в воде. В 1 объеме воды ПРИ обычной температуре растворяется до 700 объемов аммиака. Водный раствор аммиака называется аммиачной водой.
Водородные соединения изученных вами неметаллов диссоциируют в растворе, как кислоты. Исследуем и аммиачную воду при помощи прибора для обнаружения электропроводности растворов (рис. 1). При погружении в нее электродов лампочка засветится. Следовательно, в растворе содержатся ионы
Какие же ионы образуются при растворении аммиака в воде. Прильем к раствору несколько капель раствора фиолетового лакмуса или фенолфталеина: в аммиачной воде лакмус окрашивается не в красный цвет (как в растворах галогеноводородов, сероводорода), а в синий, фенолфталеин — в малиновый цвет. Мы обнаружили присутствие в аммиачной воде ионов гидроксила ОН — . Откуда они появились? Молекулу аммиака можно рассматривать, как ион азота 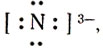
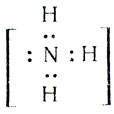
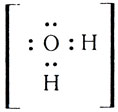
Одна электронная пара при атоме азота остается свободной, не участвующей в образовании химической связи. Молекулу же воды мы уже рассматривали как ион кислорода 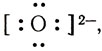
Не участвуют в образовании связей у атома кислорода две электронные пары. Атомы неметаллов в таких водородных соединениях могут за счет свободных электронных пар связывать дополнительные ионы Н + (вспомните ион гидроксония).
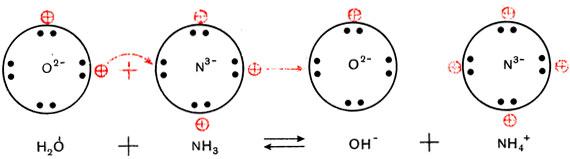
Трехзарядный ион азота в молекуле аммиака сильнее удерживает связанные с ним протоны и сильнее притягивает добавочный протон, чем двухзарядный ион кислорода в молекуле воды. Поэтому при взаимодействии аммиака с водой происходит перемещение протонов из молекул воды в молекулы аммиака:
(Кружки с крестиками изображают ионы водорода Н + , или протоны.)
Образуются ионы гидроксила ОН
и положительно заряженные ионы NH4 + , которые получили название «аммоний».
Упрощенно реакция между аммиаком и водой изображается так:
Эта реакция обратимая. Лишь малая доля растворенного аммиака присутствует в растворе в виде ионов аммония, большая часть его содержится в виде молекул NH3. Потому аммиачная вода пахнет аммиаком и при стоянии на открытом воздухе или при нагревании выделяет весь растворенный в ней аммиак.
В молекуле аммиака атом азота образует три ковалентные связи, а в ионе аммония — четыре. Но из этих четырех связей по-прежнему лишь три образованы за счет спаривания электронов атома азота с электронами присоединенных атомов. А мы определили валентность именно как число электронов, затраченных рассматриваемым атомом на спаривание с электронами присоединенных атомов. Поэтому валентность азота в зоне аммония, как и в аммиаке, остается равной 3.
Независимо от различного происхождения все 4 связи в зоне аммония совершенно равноценны, и этот ион имеет форму правильной трехгранной пирамиды — тетраэдра.
В медицине и в быту разбавленный раствор аммиака называется аммиачной водой или нашатырным спиртом. Его дают нюхать при обмороке для приведения в сознание. В домашнем хозяйстве он применяется в качестве слабой щелочи при стирке белья и выведении пятен.
В сельском хозяйстве концентрированную аммиачную воду используют в качестве жидкого удобрения.
- Что представляет собой водный раствор аммиака? Какие молекулы и ионы в нем присутствуют? Как эти ионы образуются?
- * Во что превратилась бы молекула метана СН4, если бы в ядро углеродного атома внедрился протон?
- Перед нами стакан, наполненный аммиаком и закрытый пластинкой, и второй открытый стакан. Как «перелить» аммиак из первого стакана во второй, чтобы аммиак по возможности не смешался с воздухом? Как обнаружить результаты опыта, если в нашем распоряжении имеется бумага, пропитанная раствором фенолфталеина?
Источник
Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Источник
Аммиак плюс вода что будет
Аммиак прекрасно растворим в воде, плотность растворов при повышении концентрации аммиака понижается. Высокая растворимость аммиака связана с образованием прочных водородных связей и гидратов состава NH3·nH2O.
В растворе имеет место взаимодействие:
Образование гидроксид-ионов создает щелочную среду раствора, но реакция протекает обратимо, при взаимодействии ионов NH4 + и OH — вновь образуются молекулы аммиака и воды, между которыми имеет место водородная связь. Следовательно, ионного соединения NH4OH не существует ни в водном растворе, ни в твердой фазе, известен сходный с ним по составу гидрат NH3·H2O и гидрат 2NH3·H2O, они существуют при низкой температуре, молекулы аммиака и воды связаны друг с другом водородными связями и образуют трехмерный каркас.
Трехмерный каркас
Наличие свободной электронной пары обуславливает донорные свойства:
За счет ионов водорода аммиак может быть окислителем и вступать в реакции с сильными восстановителями, например, при взаимодействии с натрием образуется амид натрия:
другие металлы при взаимодействии с аммиаком образуют нитриды:
Фтор мгновенно окисляет аммиак до трифторида:
хлор реагирует в зависимости от кислотности среды:
Источник
Аммиачная вода: что это такое, образование и содержание аммиака в питьевой жидкости, чем опасен его избыток, свойства и польза

Бесцветный газ NH3 с резким запахом отлично растворяется в жидкости и при этом выделяет тепло. Смесь получается во время взаимодействия вещества с молекулами Н2О. Она получила широкое применение в растениеводстве и животноводстве, в пищевой и медицинской отраслях, в промышленности для производства кальцинированной соды, марганца и ферросплавов. В статье мы постараемся подробно рассказать вам о составе и свойствах аммиачной воды, применении и формуле, о пользе и вреде и о том, чем опасен избыток аммиака.
Что это такое

Водный раствор приобретает ряд качеств, которые позволяют его использовать в самых различных отраслях. Наиболее известное — нашатырь. За счет резкого запаха он применялся как средство выведения из обморочных состояний. Этим же соединением хозяйки мыли окна,так как оно заменяло современные моющие средства, эффективно удаляло грязь и не оставляло разводов на стекле.
Знакомой картиной являются огромные бочки, стоящие в полях. Еще двадцать лет назад это было очень популярное удобрение, способствующее насыщением почвы азотом. На сегодняшний день такая форма стала неактуальной из-за высоких затрат и резкого запаха.
Нормативная концентрация аммиака

В зависимости от целей, разработаны оптимальные и минимально допустимые количества растворенного вещества. Как правило, доля гидроокиси аммония составляет от 22 до 25 процентов. В бытовых нуждах применяются более слабые смеси. Это обусловлено соображениями безопасности.
Основным требованием к хранению является герметично закрытая тара и сбережение от нагрева. Сосуд должен быть сделан из пластика или стекла. Допустимо использование алюминия.
Определение и норма содержания аммиака в питьевой воде

В естественных природных условиях азотные соединения присутствуют часто, так как они являются одним из продуктов разложения биологических материалов. Поэтому возможно их попадание и в систему водоснабжения. Самым ярким признаком является резкий запах, который невозможно перепутать с другим. При подозрениях необходимо отдать образец на исследования в химическую лабораторию. В малых дозах это вещество практически безвредно, но при некоторых реакциях получаются опасные соединения. Поэтому целесообразно избавиться от нитратов с помощью фильтров. На даче или в полевых условиях можно дать влаге отстояться. Летучие соединения достаточно быстро выветриваются.
Однако этот метод не решает всех проблем. Правильнее будет использование фильтрующих систем одного из надежных производителей, например, от компании «Вода Отечество».
Нормативом по содержанию гидроокиси аммония в питьевой жидкости является не более 2 миллиграмм на один литр.
Физические характеристики

За счет того, что азот — один из самых легких химических элементов, плотность аммиачной воды составляет 888 грамм на кубический дециметр при концентрации ингредиента 25 %.
Температура замерзания — от -31 до -54 градуса. Все остальные свойства подобны чистому Н2О. При повышенной t происходит активное выветривание вещества. Этим обусловлены потери при транспортировке и хранении.
Молярная масса составляет 35,046 г/моль.
Химические свойства

Этот продукт довольно активно вступает в реакции. Он окисляет почти все цветные металлы. За счет образования катионов аммония и анионов -ОН он окрашивает лакмус в синий цвет, а фенолфталеин — в малиновый. Активно реагирует с кислотами, сильными окислителями, галогенами, серебром и ртутью.
Сфера использования

MBFT-75 Мембрана на 75GPD
SF-mix Clack до 0,8 м3/ч
SF-mix Runxin до 0,8 м3/ч
За счет ряда специфичных свойств раствор нашел широкое применение в разных сферах народного хозяйства. В быту мы часто используем нашатырь для очищения стеклянных поверхностей, удаления загрязнений на ковровых покрытиях и одежде, для чистки серебряных предметов, устранения неприятных запахов.
Сельское хозяйство

В восьмидесятые годы прошлого столетия на каждом поле стояли цистерны. Их задействовали для хранения азотистых жидких удобрений. Внесение производилось непосредственно перед посевом или уже по росткам. Метод был обусловлен быстрым выветриванием вещества из грунта. Сейчас фактически все аграрии отказались от такой формы и перешли на гранулированное удобрение. Второй причиной замены является опасность аммиачной воды для здоровья человека. Единственный плюс — низкая стоимость продукта. Необходимая концентрация азота в почве достигается затратами в несколько раз меньше, чем при использовании твердых соединений.
Чтобы предотвратить преждевременное испарение, практиковалось внесение раствора на глубину 10-15 сантиметров при помощи специальной техники.
В животноводстве до сих пор широко употребляется гидроокись аммония для обработки грубых кормов и дезинфекции помещений для скота.
Промышленность

Высокая химическая активность азота обеспечило ему применение в самых разных сферах производственной деятельности.
- Военная индустрия. На основе этого элемента изготавливается большая часть взрывчатых веществ.
- Аммиачная вода является необходимым компонентом при окрашивании тканей, выработке хладагентов для морозильных камер.
- Использование массы для предотвращения размораживания бетонных конструкций при возведении зданий в условиях Крайнего Севера.
- Добавка Е 527 широко распространена в пищевой промышленности.
- Химики на основе NH3 выпускают соду, марганцовку, лакокрасочные материалы, полимеры. Без этого состава нельзя обойтись и в металлургии.
- С давних времен и по сей день реакция субстанции с серебром употребляется при изготовлении зеркал.
Медицина

В лечебных учреждениях нашатырь разной концентрации применяется как противообморочное средство, для вызывания рвоты при отравлениях, для обработки рук медицинских работников. Кроме того, раствор используют как препарат при невралгии, миозите.
Следует отметить, что в этой сфере имеет применение массы с низкой концентрацией аммиака. В противном случае такое действие может привести к травмам (химический ожог, паралич дыхания и т.д.).
Виды аммиачной воды

В зависимости от назначения промышленность выпускает разные категории. Они могут отличаться по процентному содержанию NH3 и степени очистки.
Для внесения удобрения в почву или мойки окон вполне достаточно марки «В», так как незначительные примеси не повлияют на желаемый результат. При производстве такой смеси используются ингредиенты низкого уровня фильтрации.
Если сферой применения является медицина, то к химическому составу предъявляются более высокие требования. В производстве под маркой «А» наличие посторонних примесей сведено до минимума. Более подробную информацию можно найти в соответствующих ГОСТах.
Подобное внимание к чистоте вещества требуется в некоторых химических и промышленных процессах (копировальная техника, светопоглощающие покрытия и т.д.).
Получение и хранение аммиачной воды

SF-mix ручной до 0,8 м3/ч
АМЕТИСТ — 02 М до 2 куб.м./сут.
Аэрационная установка AS-1054 VO-90
Наиболее широкое распространение при изготовлении получили три технологии.
- Обогащение Н2О газообразной фракции аммиака. Процесс заключается в многократном пропускании через жидкость с последующим охлаждением.
- Смешивание двух компонентов в жидком состоянии под давлением.
- Непрерывная подача в смеситель дозированных объемов ингредиентов. Этот способ позволяет сделать большие партии субстанции.
При транспортировке и последующем складировании особое внимание уделяется предотвращению испарения. Тара должна быть герметичной. Не допускается нагрев. Емкость изготавливается из материалов нейтральных к этой субстанции (многие цветные металлы подвержены коррозии).
Меры предосторожности

Основным фактором опасности является резкий запах и возможность химического ожога. Особенно это актуально при высоких концентрациях. Поэтому при работе с составом необходимо применять перчатки и средства защиты органов дыхания.
Ожог может вызвать и попадание на кожу. Поэтому лучше использовать спецодежду.
Самая распространенная опасность исходит от паров, вдыхание которых может вызвать головокружение, рвотные позывы, дезориентацию в пространстве и слезоточивость. При первых симптомах необходимо прервать работу и обеспечить проветривание. Обычно, если вовремя выполнить рекомендацию, то тяжелых последствий не наступает. Однако при длительном контакте возможны варианты, когда без обращения в медицинские учреждения не обойтись.
Как сделать аммиачную воду для использования на даче
За счет своей дешевизны этот состав нашел широкое применение у огородников. Подкормка вносится на глубину 10-15 сантиметров непосредственно перед посевом. Если не заглублять, то происходит быстрое выветривание и резко снижается эффективность удобрения. Садоводам следует знать, что длительное применение любых азотных смесей приводит к закислению почвы. Поэтому необходимо параллельное введение извести содержащих препаратов.
Растворы, продающиеся в магазинах, обычно готовы к работе. Но при желании можно довести концентрацию до более низкой, обеспечивающей безопасность и технологичность процесса.
Борьба с вредителями
Основной эффект заключается в отпугивании вредных насекомых, таких как тля, медведка, луковая муха. Вещество не является ядом, поэтому обработка овощных культур против нелетающих паразитов неэффективна.
При использовании необходимо помнить, что избыток азотсодержащих препаратов не менее вреден, чем их недостаток. Растения имеют свойства впитывать состав через листья.
Обработка должна производиться по правилам.
- В сухую и безветренную погоду.
- Полив молодых саженцев запрещен во избежание получения ожогов.
- Соблюдать дозировку.
- Применять раз в семь дней.
- Хранить в герметичном сосуде, чтобы не потерялись свойства.
Образование аммиачной воды и приготовление для подкормки

Большинство агрономов рекомендуют применять смесь низкой концентрации параллельно с поливом. Поэтому владельцы садовых участков обычно разводят нашатырный спирт в емкости и вносят в почву. В зависимости от возраста растения меняется и процентное содержание. При применении следует учитывать, что ряд агротехнических приемов также приводит к появлению азота в грунте. Например, внесение навоза нежелательно вместе с гидроокисью аммония.
Слишком крепкий состав может привести к ожогам растений и повреждению корневой системы.
Соли аммония

Диспенсер магистральный настольный AquaPro 919H/RO (горячая и холодная вода)
Диспенсер магистральный настольный AquaPro 929CH/RO (охлаждение/нагрев)
Диспенсер напольный AquaPro 311 (пустой, без охлаждения)
Эта группа химических продуктов получается при реакции с различными кислотами.
- Нитраты используются как удобрения и при производстве взрывчатых веществ.
- Сульфаты — подкормка для растений более дешевого класса.
- Гидрокарбонаты применяются в пищевой промышленности как разрыхлитель и консервант.
- Карбонаты являются частью технологической цепочки по получению красителей и пластиков.
- Хлориды задействуют в ветеринарии.
Все материи имеют яркие признаки классических солей, наиболее близкие по характеристикам к натриевым соединениям. Хорошо растворяются с диссоциацией на ионы. При нагревании разлагаются. Под воздействием щелочей выделяется аммиак.
Как хранить гидроокись аммония
Для того чтобы субстанция не изменила своей химической структуры, необходимо:
- использовать герметичные емкости;
- применять для тары материал, нейтральный к реагенту (стекло, полиэтилен, пластик, черные металлы);
- не допускать перегрева от обогревательных приборов или прямых солнечных лучей;
- соблюдать меры предосторожности и режим вентиляции складского помещения.
Плюсы вещества

Благодаря своим уникальным свойствам и достаточно простом способе изготовления, этот продукт используется со времен древнего Египта. Если раньше он находил применение исключительно в медицине и как чистящее средство, то с развитием науки и технологий его сфера потребления резко увеличилась.
Несложные процессы и относительная безопасность производства обеспечили задействованность препарата в сельском хозяйстве и химической индустрии.
Наиболее важным преимуществом является низкая себестоимость состава. Это позволяет применять его в самых разных сферах хозяйства. Простота и безопасность хранения существенно снижают расходы на эти процессы. При соблюдении технологии срок годности неограничен. Исключено слеживание — большая проблема для хозяйственников при использовании селитры.
Усвоение азота растениями проходит без дополнительной траты воды. Поэтому такая подкормка очень популярна в регионах, где имеется недостаток влаги.
Многие удобрения на основе N взрывоопасны. Раствор лишен такого качества и совершенно безвреден. Если при нештатной ситуации допустить аварийный разлив, то не произойдет катастрофического заражения площади. За счет испарения пространство очищается через короткий промежуток времени, что невозможно при попадании больших объемов гранулированных удобрений на почву. Например, при рассыпании селитры, грунт становится непригодным для выращивания растений на очень длительный срок. Благодаря нитрификации внесенный аммиак создает в земле устойчивые соединения, не подверженные разложению.

Из-за ошибок агрономов, когда удобрение вносится каждый год на протяжении нескольких лет в больших объемах, произошло уничтожение почвенных микроорганизмов в некоторых областях нашей страны. Поэтому владельцы земельных угодий стараются сократить применение аммиака. Стабильную урожайность принесет только «живая» земля, на которой происходит естественный биоценоз грунта и растительности.
Наличие аммиака и его превышение в сточной воде привело к гибели почвенного покрова в Соединенных Штатах Америки и Украине. На сегодняшний день экологичность выращенных продуктов оставляет желать лучшего. В погоне за кратковременной прибылью хозяйственники этих стран превратили плодородные земли просто в субстрат.
Кроме этого, попавший аммиак в водопроводную сеть, способен нанести непоправимый вред здоровью человека. Если употреблять неотфильтрованную жидкость, то могут возникнуть проблемы в желудочно-кишечном тракте. Чтобы защитить себя и своих близких от негативных последствий, необходимо воспользоваться насадкой на кран или поставить очистительную систему. Желательно, чтобы данную услугу предоставляли специалисты с высокой квалификацией, например, компания «Вода Отечество». По результатам проведенных исследований менеджеры помогут вам подобрать наиболее оптимальное оборудование для очистки.
Мы предоставляем вам наглядное пособие, по которому вы поймете, что такое аммиачная вода, как определить концентрацию аммиака в скважине и как помочь земле насытиться азотом.
Источник