- Аммиак: получение и свойства
- Аммиак
- Строение молекулы и физические свойства
- Способы получения аммиака
- Химические свойства аммиака
- Аммиачная вода: формула, свойства и возможности применения в агротехнике
- Только ли плюсы?
- Показания к применению
- Формула и химия
- Видео: применение аммиака (нашатырного спирта) в огороде
- Формы выпуска и свойства
- Порядок и нормы внесения
- Нормы и способы обработки
- Вывод
- Видео: аммиачный раствор как удобрение и против вредителей клубники
Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
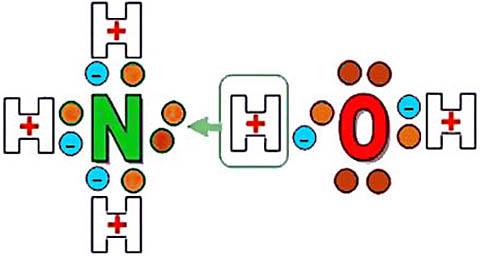
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Источник
Аммиачная вода: формула, свойства и возможности применения в агротехнике
Аммиачная вода представляет собой водный раствор аммиака NH4 для технических целей. От медицинского нашатырного спирта отличается неглубокой очисткой и большей концентрацией – 25% вместо 10%. В агротехнике больших площадей применяется механизированным способом преим. на монокультуре зерновых под зяблевую вспашку, см. рис. справа, как безбалластное азотное моноудобрение. В таком случае сказываются след. преимущества аммиачной воды как удобрения:
- Стоимость единицы массы активного вещества в 1,5-2 раза меньше, чем у самой дешевой селитры.
- Возможно и экономически оправдано ведение конкурентоспособного высокомеханизированного хозяйства.
- Отпадает необходимость в штатных единицах, производственных площадях и оборудовании для приготовления баковых и рабочих растворов – аммиачная вода представляет собой готовое удобрение.
- Резко снижается потребность почвы во влаге для преобразования аммонийной формы азота в нитратную, усваиваемую растениями, что особенно важно в засушливых местах с малоснежной зимой.
Только ли плюсы?
Однако в настоящее время использование аммиачной воды в агротехнике неуклонно сокращается. Причина – водный аммиак вне герметически закрытой емкости активно выделяет газообразную составляющую, в больших концентрациях губительную для всего живого. Поскольку нитрификация в почве (см. далее) происходит не мгновенно, регулярная обработка аммиачной водой уничтожает почвенные микроорганизмы. Земля, будучи и насыщенной питательными веществами, превращается в мертвое или полумертвое образование, но стабильную урожайность может обеспечить только биоценоз живой почвы и растительного покрова на ней.
Яркий пример отдаленных последствий погони за кратковременной выгодой – агротехника бывшего СССР. С площадей, в 60-е – 70-е дававших урожаи по 60-70 ц/га ценного и твердого зерна, ныне удается снимать по 9-14 ц/га фуражного. В РФ в настоящее время аммиачная вода выведена из списка разрешенных к применению удобрений, но пока остается в перечне допущенных. Ее использование все еще практикуется, однако в силу условий мирового рынка продовольствия все более уступает агрикультуре, основанной на поддержании плодородия живой почвы. По такому же пути идут ведущие сельскохозяйственные государства и регионы.
Внесение аммиачной воды в почву под зябь механизированным способом
В настоящее время стабильно широкое использование аммиачной воды в агротехнике имеет место только в США и на Украине. В первом случае сказывается насыщенность продовольственного рынка: малейшее снижение рентабельности делает фермерские хозяйства убыточными. Продуктивность почвы поддерживается, как в свое время в СССР, насыщением их минеральными удобрениями и централизованным вмешательством государства – компьютерным мониторингом сельхозугодий, дотациями на удобрения и т.п. Но земля при этом превращается просто в субстрат, экологичность продукции с которого оставляет желать много лучшего, и агротехника США не последняя из причин, по которой Америка не в состоянии была подписать Киотские соглашения по климату и оказалась вынуждена отказаться от Парижских.
Примечание: земляных червей для любительской рыбалки в США приходится покупать в спецмагазинах или хозяйствах, ведущих вермикультуру. Накопать самому нереально – свободная от использования земля или частная, или охраняемая, или червяков в ней просто нет.
Тем не менее, применение аммиачной воды в частных хозяйствах может быть безвредно и вполне оправдано в засушливых местностях либо в годы с сухой осенью и/или малоснежной зимой. Удобрения, содержащие готовые нитраты (селитры, нитрофос, нитрофоска) в таких условиях к весне теряют большую часть активного азота; почва, обработанная аммиачной водой, хранит его до тех пор, пока до него не доберутся корни растений.
Показания к применению
Нитрификация происходит в присутствии влаги. В водном аммиаке ее вдоволь. Внесенный в мало увлажненную землю, он жадно поглощается почвенными коллоидами. В них же азот переходит из аммиачной формы в нитратную, прочно удерживаемую коллоидными конгломератами до весеннего тепла и влаги; свободные нитраты из минеральных удобрений весной активно мигрируют и сильно вымываются, прежде чем коллоидные образования активизируются и успеют их связать. Таким образом, аммиачная вода в условиях осенне-зимнего недостатка влаги представляет собой удобрение замедленного действия, активация которого инициируется условиями, оптимальными для начала вегетации растений. Вред свободного аммиака для почвенной микрофлоры в таком случае минимален, т.к. на зиму почвенные организмы или уходят в глубину, или приобретают стойкие зимовочные формы – споры, цисты, коконы и др. К весне свободный аммиак улетучивается и нейтрализуется.
Примечание: на легких проницаемых почвах аммиак как удобрение лучше использовать в составе карбамидно-аммиачной смеси (КАС), см. далее.
Формула и химия
Полезные качества аммиачной воды на участке могут быть реализованы только при правильном ее использовании. В общем дачники и мелкие хозяева применяют аммиачную воду как и нашатырный спирт, только дозы препарата в рабочий раствор дают в 2,5 раза меньшие, см. напр. видео:
Видео: применение аммиака (нашатырного спирта) в огороде
Однако возможно и более эффективное использование аммиачной воды для растений. Производить его нужно грамотно, чтобы спустя несколько лет или даже по весне не ломать голову – что делать с убитой почвой. Так что ознакомимся вначале подробнее, что же это такое – аммиачная вода?
Химическая формула водного раствора аммиака не просто (NH3)H2O. Растворяясь в воде, аммиак образует с ее молекулами т. наз. водородные связи, см. рис. ниже. Молекулярный азот N2 химически весьма инертен – им наполняют дешевые лампы накаливания. Но атомарный азот весьма активен и пытается «отодрать» ион водорода от ближайшей молекулы воды. Полностью ему это не удается – кислород химические еще активнее – но обе молекулы оказываются связаны; «спорный» ион водорода как бы принадлежит ими обеим. Вполне человеческая аналогия – единственный ребенок супружеской пары в процессе ее развода.
Схема образования водородной связи между молекулами воды и аммиака
Водородная связь много слабее ионной и ковалентной, поэтому такие «спарки» легко распадаются. Раствор при этом выделяет газообразный аммиак. Разрыву водородных связей способствует повышение температуры и открытая поверхность раствора. В закрытом сосуде при +20 градусах в состав раствора входит одна связанная молекула аммиака на 250 свободных, а парциальное давление его паров составляет при нуле градусов составляет прим. 0,07 МПа. При +50 парциальное давление повышается до прим. 0,4 атмосферного. Если теперь открыть сосуд, то большая часть азота «пыхнет» и улетучится в виде аммиачных паров.
Указанные свойства аммиачной воды определяют ее «замедленность» как удобрения. Связанные водородной связью молекулы проявляют свойства иона амммония NH4+ и поэтому легко нитрифицируются до питательных нитратных NO3+. Если выход аммония NH4+ из раствора невысок, то по законам химического равновесия его состав сдвигается в сторону образования (NH3)H2O. Если же NH4+ активно поглощается почвенными коллоидами, равновесие сдвигается в направлении (NH3)H2O –> (NH4+)(OH–), пока коллоидные агломераты не насытятся им. При дальнейшем падении наружной температуры нитрификаторы «засыпают», а весной при ее повышении отдают обратно в почву уже нитраты NO3+. Скорость выделения нитратов растет с повышением температуры примерно так же, как и скорость усвоения их растениями. Это ценное качество, которым обладают также значительно менее доступные органические удобрения. Отсюда следуют важные для сельскохозяйственной практики выводы:

Как не надо поливать почву аммиачной водой
Аммиачная вода сразу не замерзает. Температура начала выпадения из нее твердой фазы ниже –30 градусов. Парциальное давление паров аммиака над его раствором в воде остается достаточно высоким и при нуле градусов. Поэтому полив аммиачной водой так, как показано на рис. справа, бесполезен, даже если сразу же заворачивать грунтом канавки. Водный аммиак вносится в почву или культиватором на глубину 10-5 см подачей через капилляр, или методом фертигации, см. далее.
Внесение аммиачной воды сильно закисляет почву, поэтому спустя неделю после ее применения нужно произвести нейтрализацию известкованием. На ведро (12 л) использованной аммиачной воды по той же площади вносят 3-4 кг известковой муки. Не доломитовой – нейтрализует карбонат кальция!
Формы выпуска и свойства
Продажные формы выпуска аммиачной воды
25% аммиачная вода прозрачная жидкость плотностью 910 г/куб. дм с резким запахом. Содержит 20,5% активного азота (без учета улетучивания газообразного аммиака в процессе использования раствора). Вес 1 л 25% водного аммиака 0,88 кг; из них на азот приходится 0,22 кг. До температуры ок. 50 градусов Цельсия парциальное давление газообразного аммиака в закрытом сосуде повышается медленно, и поэтому до наружной температуры 43 градуса (для гарантии) аммиачная вода может храниться в герметичной упаковке обычной прочности. Раствор и пары токсичны, разъедают слизистые. Симптомы отравления: тошнота, головокружение, потеря ориентации, кашель, резкие боли в области живота, удушье. Меры первой помощи: покой, свежий воздух, немедленная госпитализация.
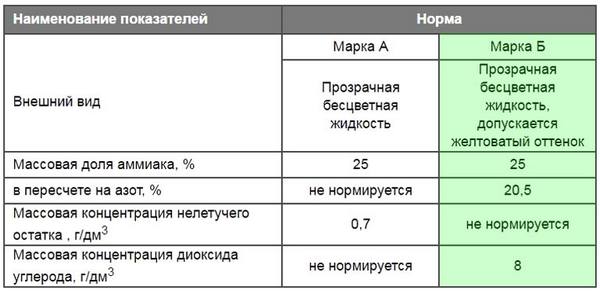
Водный аммиак выпускается марок А и Б. Обе формы – бесцветная жидкость, см. рис. справа. Для марки Б допустим желтоватый оттенок, но и она может быть совершенно прозрачной. К использованию в агротехнике допущена только марка Б, но отличить бесцветную марку Б от такой же марки А на вид и по запаху невозможно. Поэтому, приобретая препарат, убедитесь, что на упаковке значится «Марка Б», указан химический состав продукта и он соответствует приведенному в табл.:
Химический состав аммиачной воды марок А и Б
Примечание: хранение аммиачной воды затруднено и в условиях большого промышленного хозяйства. Водный аммиак в мелкой расфасовке после вскрытия тары хранению не подлежит и должен быть использован весь сразу.
Порядок и нормы внесения
Как указано выше, длительное систематическое внесение аммиачной воды губит естественный почвенный биоценоз. Полученный таким образом субстрат поддается рекультивации медленно и с большими затратами. Поэтому применять аммиачную воду для растений настоятельно рекомендуется эпизодически в след. случаях:
- При остром недостатке медленно нитрифицирующихся органических удобрений: навоза, компоста, перегноя;
- В аномально сухие годы;
- После аномально малоснежной и ветреной зимы.
В первых 2-х случаях аммиачная вода вносится осенью после уборки урожая и оголения почвы. Вносить нужно в период, когда дневная температура не выше +13 градусов, среднесуточная не более +10, а ночная не опускается ниже 0. Последнее условие важно, т.к. при температуре замерзания воды и ниже почвенные нитрификаторы «засыпают». Химическое равновесие в растворе сдвигается в сторону (NH3)H2O, и свободный аммиак отравляет почву вместо того, чтобы преобразоваться в нитраты. Обработку проводят ближе к вечеру, чтобы меньше азота выделялось в летучем аммиачном виде.
То же самое имеет место на легких проницаемых почвах, поэтому аммиак в них нужно вносить в составе карбамидно-аммиачной смеси (КАС). Она содержит все 3 формы активного азота: нитратную, аммонийную и амидную. КАС вносится весной. Температурные условия те же, что и в пред. случае, но ждать нужно уже не понижения, а повышения температуры. КАС действует ступенчато: ее нитраты сразу идут на питание растений. Взамен использованным по законам химического равновесия нитрифицируются аммонийные, а их таким же образом замещают амидные. Недостаток у КАС всего один – дороговизна.
Аммиачная вода в средние и тяжелые почвы вносится весной после иссушающей зимы. Температурные условия те же. Посев и посадка растений допускаются не ранее недели после весеннего внесения аммиачной воды. Если есть вероятность следующей ветреной сухой зимы, то в теплый сезон обязательно принимаются меры по рекультивации почвы: внесение в нее перегноя, компоста, гуматов в сочетании с достаточным поливом. Нет таких возможностей – лучше примириться с невысоким урожаем, чем рисковать угробить землю надолго.
Нормы и способы обработки
Благодаря плавному медленному действию дозировка аммиачной воды несложна: 0,4-0,5 кг на сотку для пропашных культур, 0,5-0,6 кг/сотка для овощных и травянистых ягодных и 60-70 г/10 кв. м приствольного круга или междурядья для кустарников и деревьев. В общем, если на малых участках вносить по бутылке 0,5 л на сотку, то худа не будет. Под пропашные и овощи водный аммиак вносится культиватором с дозатором на глубину 10 см на тяжелых почвах, 15 см на средних и 25-30 см на легких. Шаг борозд (расстояние между ними) 25-30 см. Если используется культиватор с 2-мя и более сошниками, расстояние между ними должно быть не менее 25 см. Больше – не страшно. Пропускная способность дозатора устанавливается исходя из скорости перемещения культиватора; при передвижении пешком за мотоблоком – 3 км/ч или 0,8 м/с.
Под деревья и кустарниковые насаждения аммиачную воду удобнее вносить методом подпочвенного орошения или фертигации. Инжектор-фертигатор можно сделать своими руками из воронки, к которой приспособлена трубка из прочного химически стойкого материала, напр. нержавеющей стали, монолитного поликарбоната или акрилового пластика. Длина трубки – 35 см. Ее нижний конец заглушается заостренной пробкой. Выше пробки на 5 см вверх сверлятся 12 отверстий диаметром 2-2,5 мм. Располагаются они 4-мя вертикальными рядами по 3 в ряду; ряды распределяются равномерно по окружности.
Для использования устройства сначала по площади приствольных кругов определяют расход раствора. В порядке пользования делают не менее 6 инъекций в приствольный круг, распределяя их равномерно по его площади. В воронку каждый раз вливают часть отмеренной дозы так, чтобы вся она распределилась равномерно. Инжектор погружают в грунт на глубину, соответствующую почве, см. выше. При фертигации кустарников инъекции делают в междурядья с шагом 25-60 см не ближе 25 см к кустам.
Вывод
Аммиачную воду в качестве заменителя нашатырного спирта в небольших агрохозяйствах применяют более в качестве инсектицида в составе средств от вредителей. Дозировку при этом уменьшают в 2,5 раза: вместо аптечного пузырька на 10 мл дают 4 мл; вместо 25 мл нашатырного спирта 10 мл аммиачной воды.
Однако против тли результаты оказываются нестабильны и сомнительны. Во всяком случае, пока не изведешь на участке муравьев, от тли не избавишься. Более-менее эффективен аммиачный азот как средство против вредителей клубники, см. ролик:
Видео: аммиачный раствор как удобрение и против вредителей клубники
Что же касается азотного удобрения аммиачной водой – систематически не надо. Кратковременный эффект будет, но потом затраты на агрохимию резко возрастут, а стабильность урожайности упадет, и на малых площадях ждать этого придется не полвека, а считанные годы.
Внесение аммиачной воды в почву может выручить на следующий год после аномально жаркого и сухого. Но в таком случае обязательно постарайтесь обеспечиться на него же поливной водой, хотя бы верховой из скважины. Также обязательно найдите место для компостной кучи или ящика, с весны начинайте его заполнять и готовить компост одного сезона – земле для поддержания жизнеспособности после «аммиачного удара» потребуется полноценное питание.
Источник