- Аммиак плюс вода равно
- Урок №30. Аммиак. Физические и химические свойства. Получение и применение
- Аммиак плюс вода равно
- Реакции, идущие без изм енения степени окисления атома азота (присоединение)
- Аммиак
- Характеристики и физические свойства аммиака
- Получение аммиака
- Химические свойства аммиака
- Применение аммиака
- Примеры решения задач
Аммиак плюс вода равно
Аммиак прекрасно растворим в воде, плотность растворов при повышении концентрации аммиака понижается. Высокая растворимость аммиака связана с образованием прочных водородных связей и гидратов состава NH3·nH2O.
В растворе имеет место взаимодействие:
Образование гидроксид-ионов создает щелочную среду раствора, но реакция протекает обратимо, при взаимодействии ионов NH4 + и OH — вновь образуются молекулы аммиака и воды, между которыми имеет место водородная связь. Следовательно, ионного соединения NH4OH не существует ни в водном растворе, ни в твердой фазе, известен сходный с ним по составу гидрат NH3·H2O и гидрат 2NH3·H2O, они существуют при низкой температуре, молекулы аммиака и воды связаны друг с другом водородными связями и образуют трехмерный каркас.
Трехмерный каркас
Наличие свободной электронной пары обуславливает донорные свойства:
За счет ионов водорода аммиак может быть окислителем и вступать в реакции с сильными восстановителями, например, при взаимодействии с натрием образуется амид натрия:
другие металлы при взаимодействии с аммиаком образуют нитриды:
Фтор мгновенно окисляет аммиак до трифторида:
хлор реагирует в зависимости от кислотности среды:
Источник
Урок №30. Аммиак. Физические и химические свойства. Получение и применение
Аммиак – NH 3
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH 2 ) 2 CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан . Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH 4 Cl, который при нагревании испаряет аммиак.
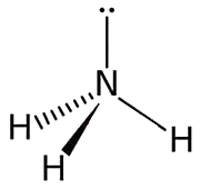
Строение молекулы
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH 4 + .
Вид химической связи: ковалентная полярная, три одинарные σ — сигма связи N δ- ← H δ+
Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH 3 в воде чрезвычайно велика — около 1200 объёмов (при 0°C) или 700 объёмов (при 20°C) в объёме воды.
Получение аммиака
В лаборатории
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH 4 Cl + NaOH = NH 3 ↑ + NaCl + H 2 O
(NH 4 ) 2 SO 4 + Ca(OH) 2 = 2NH 3 ↑ + CaSO 4 + 2H 2 O
Внимание! Гидроксид аммония неустойчивое основание, разлагается:
NH 4 OH ↔ NH 3 ↑ + H 2 O
При получении аммиака держите пробирку — приёмник дном кверху, так как аммиак легче воздуха.
В промышленности
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N 2(г) + 3H 2(г) ↔ 2NH 3(г) + 45,9 кДж
катализатор – пористое железо
температура – 450 – 500 ˚С
давление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Химические свойства аммиака
Реакции с изменением степени окисления атома азота (реакции окисления)
N -3 → N 0 → N +2
NH 3 – сильный восстановитель
1. Горение аммиака
4NH 3 + 3O 2 = t = 2N 2 + 6H 2 О
2. Каталитическое окисление аммиака
4NH 3 + 5O 2 = t, кат. Pt – Rh = 4NO + 6H 2 O
3. С оксидами металлов
2NH 3 + 3CuO = 3Cu + N 2 + 3H 2 O
4. С сильными окислителями
2NH 3 + 3Cl 2 = t = N 2 + 6HCl
5. Аммиак – непрочное соединение, при нагревании разлагается
2NH 3 = t = N 2 + 3H 2
Реакции без изменения степени окисления атома азота
Присоединение происходит по донорно-акцепторному механизму с образованием иона аммония NH 4 + , входящего в состав соединений аммония:
(NH 4 ) n А – соли аммония
NH 4 ОН – гидроксид аммония (правильная запись NH 3 •H 2 O )
1. С водой образуется аммиачная вода (нашатырный спирт), обладающий основными свойствами – фенолфталеин в таком растворе окрашивается в малиновый цвет, а красная лакмусовая бумага – в синий:
NH 3 + H 2 O ↔ NH 4 OH ↔ NH 3 •H 2 O ↔ NH 4 + + OH —
NH 3 +HCl = NH 4 Cl
NH 3 +H 2 SO 4 = NH 4 HSO 4 – гидросульфат аммония
2NH 3 +H 2 SO 4 = (NH 4 ) 2 SO 4 – сульфат аммония
Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH 3 . Огромные количества аммиака далее используются для получения азотной кислоты , которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин . Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон , например, нейлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка . В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Источник
Аммиак плюс вода равно
Водородная связь — это химическая связь между атомами водорода одной молекулы и атомами очень электроотрицательных элементов (фтора, кислорода, азота), имеющих неподеленные электронные пары другой молекулы.
Это очень слабая связь — примерно в 15—20 раз слабее ковалентной. Благодаря ей некоторые низкомолекулярные вещества (т. е. имеющие небольшую молекулярную массу) образуют ассоциаты, что приводит к повышению температур плавления и кипения веществ.
2. Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
Д ля получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
Внимание ! Гидроксид аммония неустойчивое основание, разлагается:
При получении аммиака держите пробирку — приёмник дном кверху, так как аммиак легче воздуха:
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
катализатор – пористое железо
температура – 450 – 500 ˚С
давление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
4. Химические свойства аммиака
Реакции, идущие с изменением степени окисления атома азота (реакции окисления)
1. Взаимодействие аммиака с кислородом
4 NH 3 + 3 O 2 → 2 N 2 + 6 H 2 О
Б. Каталитическое окисление амииака (к атализатор Pt – Rh , температура)
2 NH 3 + 3CuO = 3Cu + N 2 + 3 H 2 O
2 NH 3 + 3 Cl 2 = N 2 + 6 HCl (при нагревании)
Реакции, идущие без изм енения степени окисления атома азота (присоединение)
Реакции без изменения степени окисления атома азота — о бразование иона аммония NH 4 + по донорно-акцепторному механи зму
Три неспаренных электрона атома азота участвуют в образовании полярных ковалентных связей с электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH 4 + .
NH 3 + H2О ↔ NH 4 ОН ↔ NH 3 * H2О
(гидроксид аммония)
Раствор аммиака в воде — это основание. Его можно обнаружить по посинению влажной лакмусовой бумажки
NH 3 + HCl → NH 4 Cl (соль хлорид аммония)
5. Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3. Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Егоприменяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка. В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
Источник
Аммиак
Характеристики и физические свойства аммиака
Аммиак очень хорошо растворим в воде: 1 объем воды растворяет при комнатной температуре около 700 объемов аммиака. Концентрированный раствор содержит 25% NH3 (масс.) и имеет плотность 0,91 г/см 3 . Раствор аммиака в воде иногда называют нашатырным спиртом. С повышением температуры растворимость аммиака уменьшается.
При низкой температуре из раствора аммиака может быть выделен кристаллогидрат NH3×H2O, плавящийся при -79 o С. Известен также кристаллогидрат состава 2NH3×H2O.
Рис. 1. Строение молекулы аммиака.
Таблица 1. Физические свойства аммиака.
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Температура кипения, o С
Растворимость в воде (0 o С), г/100мл
Получение аммиака
В лаборатории аммиак обычно получают6 нагревая хлорид аммония с гашеной известью:
Выделяющийся аммиак содержит пары воды. Для осушения его пропускают через натронную известь (смесь извести с едким натром).
Химические свойства аммиака
В химическом отношении аммиак довольно активен; он вступает во взаимодействие со многими веществами.
Если пропускать ток NH3 по трубке, вставленной в другую широкую трубку, по которой проходит кислород, то аммиак можно легко зажечь; он горит зеленоватым пламенем. При горении аммиака образуется вода и свободный азот:
При других условиях аммиак может окисляться до оксида азота NO.
При замещении в молекулах аммиака только одного атома водорода металлами образуются амиды металлов. Так, пропуская аммиак над расплавленным натрием, можно получить амид натрия NaNH2 в виде бесцветных кристаллов:
Аммиак реагирует с кислотами, находящимися в свободном состоянии или в растворе, нейтрализуя их и образуя соли аммония. Например, с соляной кислотой получается хлорид аммония NH4Cl:
Взаимодействие аммиака с водой тоже приводит к образованию не только гидратов аммиака, но частично и иона аммония:
Применение аммиака
Аммиак – одно из важнейших соединений азота: в больших количествах он расходуется в производстве азотных удобрений, взрывчатых веществ, полимеров, азотной кислоты и соды, используется в качестве холодильного агента в морозильных установках, а также в медицине.
Примеры решения задач
| Задание | Чему равна константа кислотности иона аммония? |
| Решение | Реакцию диссоциации кислоты NH4 + в воде |
Значения Kw и K b равны 1,0×10 -14 и 1,76×10 -5 соответственно.
K a (NH4 + ) = 1,0×10 -14 / 1,76×10 -5 = 5,68×10 -10 .
| Задание | Рассчитайте рН 0,1М раствора аммиака. |
| Решение | Степень диссоциации аммиака в 1.0×10 -1 М водном растворе меньше 5% (по табличным данным h = 1,3%). Следовательно, |
Значения Kw и K b равны 1,0×10 -14 и 1,76×10 -5 соответственно. Тогда,
[H + ] = 1,0×10 -14 / 1,76×10 -5 × 1.0×10 -1 = 7,52×10 -12 ;
Источник