- Аммиак: получение и свойства
- Аммиак
- Строение молекулы и физические свойства
- Способы получения аммиака
- Химические свойства аммиака
- Аммиак с водой условия
- § 24. Аммиачная вода
- Аммиак в промышленной и питьевой воде
- Эффективное очищение воды от аммиака
- Фильтрация
- Установка водоочистки
- Биологический метод
- Флорация и кавитация
- Аэрация воды
- Этапы очистки воды
Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
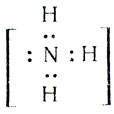
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Источник
Аммиак с водой условия
§ 24. Аммиачная вода
Водородные соединения уже изученных нами неметаллов растворяясь в воде, реагируют с нею с образованием ионов гидроксония. Реагирует с водой при растворении в ней и аммиак, но иначе.
Опустим в кристаллизатор с водой сосуд, наполненный аммиаком, отверстием вниз. Вода быстро заполнит сосуд доверху, то показывает, что аммиак очень хорошо растворяется в воде. В 1 объеме воды ПРИ обычной температуре растворяется до 700 объемов аммиака. Водный раствор аммиака называется аммиачной водой.
Водородные соединения изученных вами неметаллов диссоциируют в растворе, как кислоты. Исследуем и аммиачную воду при помощи прибора для обнаружения электропроводности растворов (рис. 1). При погружении в нее электродов лампочка засветится. Следовательно, в растворе содержатся ионы
Какие же ионы образуются при растворении аммиака в воде. Прильем к раствору несколько капель раствора фиолетового лакмуса или фенолфталеина: в аммиачной воде лакмус окрашивается не в красный цвет (как в растворах галогеноводородов, сероводорода), а в синий, фенолфталеин — в малиновый цвет. Мы обнаружили присутствие в аммиачной воде ионов гидроксила ОН — . Откуда они появились? Молекулу аммиака можно рассматривать, как ион азота 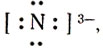
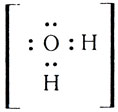
Одна электронная пара при атоме азота остается свободной, не участвующей в образовании химической связи. Молекулу же воды мы уже рассматривали как ион кислорода 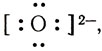
Не участвуют в образовании связей у атома кислорода две электронные пары. Атомы неметаллов в таких водородных соединениях могут за счет свободных электронных пар связывать дополнительные ионы Н + (вспомните ион гидроксония).
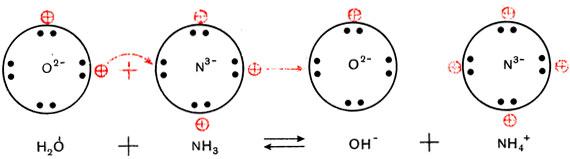
Трехзарядный ион азота в молекуле аммиака сильнее удерживает связанные с ним протоны и сильнее притягивает добавочный протон, чем двухзарядный ион кислорода в молекуле воды. Поэтому при взаимодействии аммиака с водой происходит перемещение протонов из молекул воды в молекулы аммиака:
(Кружки с крестиками изображают ионы водорода Н + , или протоны.)
Образуются ионы гидроксила ОН
и положительно заряженные ионы NH4 + , которые получили название «аммоний».
Упрощенно реакция между аммиаком и водой изображается так:
Эта реакция обратимая. Лишь малая доля растворенного аммиака присутствует в растворе в виде ионов аммония, большая часть его содержится в виде молекул NH3. Потому аммиачная вода пахнет аммиаком и при стоянии на открытом воздухе или при нагревании выделяет весь растворенный в ней аммиак.
В молекуле аммиака атом азота образует три ковалентные связи, а в ионе аммония — четыре. Но из этих четырех связей по-прежнему лишь три образованы за счет спаривания электронов атома азота с электронами присоединенных атомов. А мы определили валентность именно как число электронов, затраченных рассматриваемым атомом на спаривание с электронами присоединенных атомов. Поэтому валентность азота в зоне аммония, как и в аммиаке, остается равной 3.
Независимо от различного происхождения все 4 связи в зоне аммония совершенно равноценны, и этот ион имеет форму правильной трехгранной пирамиды — тетраэдра.
В медицине и в быту разбавленный раствор аммиака называется аммиачной водой или нашатырным спиртом. Его дают нюхать при обмороке для приведения в сознание. В домашнем хозяйстве он применяется в качестве слабой щелочи при стирке белья и выведении пятен.
В сельском хозяйстве концентрированную аммиачную воду используют в качестве жидкого удобрения.
- Что представляет собой водный раствор аммиака? Какие молекулы и ионы в нем присутствуют? Как эти ионы образуются?
- * Во что превратилась бы молекула метана СН4, если бы в ядро углеродного атома внедрился протон?
- Перед нами стакан, наполненный аммиаком и закрытый пластинкой, и второй открытый стакан. Как «перелить» аммиак из первого стакана во второй, чтобы аммиак по возможности не смешался с воздухом? Как обнаружить результаты опыта, если в нашем распоряжении имеется бумага, пропитанная раствором фенолфталеина?
Источник
Аммиак в промышленной и питьевой воде
Аммиак является органическим соединением, которое имеет специфический запах. Это загрязнитель природных, а также промышленных вод. Присутствует он в стоках животноводческих и садоводческих предприятий и ряда производств. Также он попадает в воду из-за нарушений в процессах предварительной водообработки, когда аммиак попадает за пару секунд до хлорирования в воду с целью обеспечения длительного обеззараживания. ПДК (предельно допустимая концентрация) аммиака в жидкости составляет 2 мг/дм3.
Сегодняшние технологии очищения воды от аммиачных соединений подразумевают под собой предварительное изучение уровня кислотности, типа и жесткости жидкости. Кроме ионов аммония в воде могут, а зачастую и присутствуют также и иные загрязнители, как, например, фториды, сероводород, хлориды, сульфаты и иные вещества. Прежде чем выбрать метод и способ очистки воды от аммиака, следует провести химический анализ состава воды. Это поможет в результате подобрать оптимальный вариант очистки воды от загрязнителей.
В воде обычно содержатся две формы: аммоний и аммиак. Аммиак сам по себе не опасен, но в воде с другими элементами он может создавать очень токсичные соединения, которые могут нанести вред здоровью человека. Сумма аммиака и аммоний составляет общий аммонийный азот. Содержание аммиака, аммония, а также их производной в воде зависит напрямую от показателя жесткости воды. Как правило, при рН меньше 8 в воде обнаруживаются ионы аммония. Если рН больше 11, то в воде присутствуют ионы аммиака. В промежутке между 8-11 содержатся оба вещества.
Эффективное очищение воды от аммиака
Существует несколько методов очистки воды от аммиака и аммония:
- Самым популярным в России остается хлорирование.
- Биологический метод
- Ионообменный метод (ИОМ) на сильно кислотном катионите
- ИОМ на неорганическом ионите
- ИОМ на природном цеолите
- Аэрация
- Обратноосмотический метод
- Низкотемпературная дистилляция
Метод выбирают, исходя из ряда факторов: состава воды и элементов, содержание которых нужно снизить в воде, от производительности установки, от затрат по эксплуатации, степени очистки, требуемой селективности очистки и, конечно, финансовых вложений. Фильтрация стала самым эффективным методом очистки воды от примесей и газов.
Фильтрация
Одним из самых эффективных способов очистки воды считается именно фильтрация с применением импрегнированного угля. Когда убирают аммиак и иные загрязнители из воды, в первую очередь уделяют особое внимание удалению неприятного запаха и вкуса. Потому стоит ознакомиться с применяемыми при фильтрации материалами, их характеристиками и свойствами.
Приобретая тот или иной фильтр, предварительно уточните, может ли он удалять неприятные запахи из воды. Особенно это касается установок, которые фильтруют сточные воды.
Методы очистки стоков применяют на сегодняшний день комплексно, что позволяет провести процесс не только быстро, но и максимально качественно. Используются чаще всего в процессе химические элементы, которые производят на основе каменного угля, который может очистить буквально любую жидкость даже при фильтрации природным способом.
Самым эффективным наполнителем фильтра при очищении воды от аммиака считается активированный уголь. Его применяют на больших площадях водной поверхности.
Примечательно, что насыпная плотность этого материала считается оптимальной для такого простого вида очистки, а адсорбция варьируется примерно на уровне 60%, что считается достаточно неплохим показателем.
Для собственных скважин и большого количества воды лучше устанавливать специальные фильтры, которые подходят под очищаемый тип воды. Для их установки лучше вызвать мастеров, которые знают все нюансы своей работы. Небольшое количество воды можно очистить с помощью фильтра-кувшина, который имеет в основе уголь, помогающий нейтрализовать аммиачные соединения. В крайнем случае, например, для аквариумов используют специальные средства и реагенты. Купить такие реагенты можно в магазинах, которые представляют фильтры разных типов и назначений, а также специальное оборудование, предназначенное для очистки аквариумов.
Еще один способ – низкотемпературная дистилляция, во время которой обрабатываемая жидкость контактирует со специальным газом-носителем, чья температура обычно находится в пределах 80 градусов по Цельсию. Но такой метод больше подходит для промышленного применения, так как дистиллированную воду в качестве питья применять вредно.
Также в качестве реагента может быть добавлена щелочь, которая при контакте с водой быстро разогревается до достаточно высокой температуры. Таким образом повышается парциальное давление находящегося в воде загрязнителя. Так как ионы аммония не растворяются в жидкости, при таком изменении давления вывести их из воды довольно просто. Но и этот метод больше подходит для больших производств, так как требует постоянного контроля со стороны специалистов, а также определенных знаний в этой области. Кроме того большая часть перечисленных выше методов в большей мере дорогая и требует определенных финансовых затрат. Поэтому для домов, квартир и загородных коттеджей зачастую выбирают именно фильтрацию, которая окупается быстрее и рассчитана для домашнего пользования.
Установка водоочистки
Качественные установки водоочистки включают в себя специальные установки и фильтры. По сути дела вода проходит несколько этапов очистки, которые помогают избавить жидкость от неприятного запаха.
Но в первую очередь проводится, естественно, химический анализ воды. Так определяется уровень содержания в ней аммиака и иных загрязнителей. Это очень важно, так как некоторые фильтрующие элементы могут просто «не работать» в тех условия, которые есть у заказчика (например, если вода содержит кроме аммиака еще и нефтепродукты). Присутствие аммиака в скважине может потребовать первоначально сделать данный источник воды безопасным в применении.
Токсичность аммиачной воды зависит от уровня содержания аммиака и его производных. Небольшие количества опасности человеческому здоровью не несут. Неприятный запах может сигнализировать о том, что в воде повышено содержание ионов аммония. Поступают такие загрязнения обычно из грунта, а потому лучше пользоваться глубокими артезианскими скважинами. В установках, в которых проводится очистка воды от аммиака, используется метод обратного осмоса. В таком агрегате используется сорбционное и сетчатое фильтрующее оборудование, а также колбово-картриджная система.
Биологический метод
Ранее упоминаемый биологический метод подразумевает очистку воды от аммиака с помощью микроорганизмов. Обычно это простейшие бактерии, водоросли, грибы, беспозвоночные. Очистка воды от аммиаков микроорганизмами происходит естественным образом. Но такой способ очистки достаточно непростой, так как требует:
- Применения микроорганизмов
- Последующей очистки
- Обеззараживания воды
Потому он остается весьма затратным. Также он требует наблюдения специалистов и определенного контроля за происходящими процессами с помощью специального оборудования. Да и дальнейшая очистка воды от микроорганизмов проводится только при наличии обеззараживающих фильтров.
Флорация и кавитация
Еще один метод очистки воды – флотация, кавитация. Это современные технологии, которые предусматривают тщательный выбор реагента. Применяя подобную методику, не только удаляется аммиак, но и происходит обеззараживание воды. Кроме того, находящиеся в воде взвешенные частицы, отработанные субстанции можно таким способом раздробить и измельчить, прежде чем перейти к другим этапам очистки воды. Примечательно, что кавитацию осуществляют с помощью биосырья. Данный метод нашел свое применение как в быту, так и в промышленных условиях.
Аэрация воды
Аэрация воды считается одним из самых популярных способов очищения воды. Она избавляет не только от аммиака, но также и от железа, метана и иных соединений. По сути, идет процесс дегазации и окисления растворенных в жидкости веществ. Данный способ применяют в быту – для домов и коттеджей.
Для очистки воды от аммиака используют обычно специальные насосы дозаторы. Это специальные аппараты, которые воздух нагнетают в окислительный бак (либо аэрационную колонну) с помощью компрессора. Одними из самых важных частей этой установки считаются датчики потока, газоотделительный клапан (через него выводится избыток воздуха вместе с выделяемыми газами), система управления и небольшие компрессоры.
Этапы очистки воды
Под этапами очистки воды понимается водоподготовка. Зависит их количество от исходного качества воды. Современные фильтры позволяют удалять многие примеси в воде, растворенные газы, микроорганизмы и иные загрязнители в несколько этапов:
- Предварительная очистка подразумевает под собой удаление механических примесей, как, например, песок, волокнистые включения, яйца гельминтов и другое. Используются в данном случае чаще всего сетчатые и патронные фильтры. Примерами могут стать фильтры фирмы Honywell или Pentek.
- Демангация и обезжелезивание – процесс удаления из воды метана, марганца, сероводорода, железа и других примесей и газов. В их числе обычно и аммиак. Но стоит уточнять у компании, которая занимается распространением фильтров. Применяемое оборудование: аэрационная колонна, воздушный компрессор, воздухоотделительный клапан, датчик потока, фильтрующая среда, корпус фильтра, управляющий многоходовой клапан. В установке нагнетается воздух, который вместе с водой поступает в аэрационную колонну, где происходит окисление и дегазация. Проходя через фильтрующий материал, окисленные вещества остаются на нем, а излишек газов и воздуха выходит через клапан. Стоит отметить, что фильтрующий элемент меняется всего раз в 4 года.
- Следующий этап – умягчение. Вода, проходя через фильтрующий элемент, теряет соли жесткости. Говоря о жесткости воды, имеется в виду уровень рН. Обычно применяется метод ионного обмена. Фильтрующим элементом является насыщенная ионами натрия смола. Замену производят раз в 4-5 лет.
- Тонкая очистка воды подразумевает очистку воды от механических примесей, которые остались от предыдущих этапов очистки – мелкого фильтрующего элемента, а также проводится процесс кондиционирования. Под последним подразумевается запах, привкус, цветность, мутность. Для такого типа очистки используют обычно патронные фильтры. Примером может стать американская фирма Pentek, которая производит картриджи такого типа. Замену картриджей осуществляют по-разному – от одного месяца и до года. Сроки колебаться могут в зависимости от интенсивности пользования фильтрующим элементом.
- Обеззараживание воды. На этом этапе удаляются микроорганизмы, которые несут вред здоровью человека. Используются для этой цели либо химические методы, либо физические. Химические идут с применением реагентов, а физические – с помощью кипячения, УФ-лучей или ультразвука. Примечательно, что установки для обеззараживания могут стоить дорого, но их применение более безопасно для здоровья человека, чем реагентов.
- Питьевое водоснабжение, при котором подготавливается вода с качеством очистки в 99%. Но это далеко не дистиллированная вода, так как подобные установки имеют специальный элемент, который насыщает уже очищенную воду необходимыми элементами. Яркий представитель такой установки – Atoll. Чаще всего установку монтируют под раковиной. Принцип действия – обратный осмос.
Качество воды напрямую влияет на здоровье человека. Это уже доказано учеными. По их данным, около 80% заболеваний на земле связано именно с некачественной, а временами и вовсе отравляющей организм водой. Именно поэтому стоит потреблять только фильтрованную воду. Но заниматься самостоятельной установкой подобных агрегатов лучше не стоит, так как фильтрация может в результате быть практически нулевой. Исключение составляет фильтр-кувшин, в котором замена фильтрующего элемента сведена к простой смене картриджа.
Источник