Большая Энциклопедия Нефти и Газа
Ангидрид — муравьиная кислота
Ангидрид муравьиной кислоты неизвестен. [1]
Ангидрид муравьиной кислоты , Н — СО-О-СО-Н, подобно хлористому формилу является лишь гипотетическим начальным членом этого ряда. При попытках его получения образуются вода и окись углерода. [2]
Ангидрид муравьиной кислоты , как уже упоминалось, не известен. [3]
Ангидрид муравьиной кислоты не существует. Однако известен смешанный ангидрид муравьиной и уксусной кислот СН3СООСИО, образующийся при взаимодействии хлористого ацетила с формиатом натрия. [4]
Ангидрид муравьиной кислоты не существует. Однако известен смешанный ангидрид муравьиной и уксусной кислот СН3СООСНО, образующийся при взаимодействии хлористого ацетила с формиатом натрия. [5]
Ангидрид муравьиной кислоты неизвестен. [6]
За исключением ангидрида муравьиной кислоты , который, по-видимому, не может существовать, все ангидриды жирных кислот легко доступны. Низшие члены ряда представляют собой подвижные жидкости, обладающие резким запахом; высшие — твердые вещества без запаха. [7]
За исключением ангидрида муравьиной кислоты , который, по-видимому, не может существовать, все ангидриды жирных кислот легко доступны. Низшие члены ряда представляют собой подвижные жидкости, обладающие резким запахом; высшие — — твердые вещества без запаха. [8]
Формально СО — это ангидрид муравьиной кислоты ( НСООН), что, однако, не существенно для его химии. Одно из важных свойств СО — способность выступать в качестве лиганда по отношению к переходным металлам, несмотря на то что он является чрезвычайно слабым основанием. Токсичность СО обусловлена его способностью связываться с атомом железа гемоглобина крови ( гл. Только железо и никель прямо реагируют с СО ( гл. [9]
Окись углерода СО формально является ангидридом муравьиной кислоты , но ее растворимость в воде и основаниях незначительна. Тем не менее при нагревании со щелочами она вступает в реакцию с ними и образует соответствующий форми-ат. [10]
Эта реакция показывает, что окись углерода можно рассматривать как ангидрид муравьиной кислоты . [11]
Тем не менее взгляд на окись углерода, как на ангидрид муравьиной кислоты , не является только формальным. [12]
Почему оксид углерода ( II) только формально можно считать ангидридом муравьиной кислоты . [13]
Исходя из последнего превращения, чисто формально можно считать СО ангидридом муравьиной кислоты . [14]
Эта реакция показывает, что оксид углерода ( II) можно рассматривать как ангидрид муравьиной кислоты . [15]
Источник
Большая Энциклопедия Нефти и Газа
Ангидрид — муравьиная кислота
Ангидрид муравьиной кислоты неизвестен. [1]
Ангидрид муравьиной кислоты , Н — СО-О-СО-Н, подобно хлористому формилу является лишь гипотетическим начальным членом этого ряда. При попытках его получения образуются вода и окись углерода. [2]
Ангидрид муравьиной кислоты , как уже упоминалось, не известен. [3]
Ангидрид муравьиной кислоты не существует. Однако известен смешанный ангидрид муравьиной и уксусной кислот СН3СООСИО, образующийся при взаимодействии хлористого ацетила с формиатом натрия. [4]
Ангидрид муравьиной кислоты не существует. Однако известен смешанный ангидрид муравьиной и уксусной кислот СН3СООСНО, образующийся при взаимодействии хлористого ацетила с формиатом натрия. [5]
Ангидрид муравьиной кислоты неизвестен. [6]
За исключением ангидрида муравьиной кислоты , который, по-видимому, не может существовать, все ангидриды жирных кислот легко доступны. Низшие члены ряда представляют собой подвижные жидкости, обладающие резким запахом; высшие — твердые вещества без запаха. [7]
За исключением ангидрида муравьиной кислоты , который, по-видимому, не может существовать, все ангидриды жирных кислот легко доступны. Низшие члены ряда представляют собой подвижные жидкости, обладающие резким запахом; высшие — — твердые вещества без запаха. [8]
Формально СО — это ангидрид муравьиной кислоты ( НСООН), что, однако, не существенно для его химии. Одно из важных свойств СО — способность выступать в качестве лиганда по отношению к переходным металлам, несмотря на то что он является чрезвычайно слабым основанием. Токсичность СО обусловлена его способностью связываться с атомом железа гемоглобина крови ( гл. Только железо и никель прямо реагируют с СО ( гл. [9]
Окись углерода СО формально является ангидридом муравьиной кислоты , но ее растворимость в воде и основаниях незначительна. Тем не менее при нагревании со щелочами она вступает в реакцию с ними и образует соответствующий форми-ат. [10]
Эта реакция показывает, что окись углерода можно рассматривать как ангидрид муравьиной кислоты . [11]
Тем не менее взгляд на окись углерода, как на ангидрид муравьиной кислоты , не является только формальным. [12]
Почему оксид углерода ( II) только формально можно считать ангидридом муравьиной кислоты . [13]
Исходя из последнего превращения, чисто формально можно считать СО ангидридом муравьиной кислоты . [14]
Эта реакция показывает, что оксид углерода ( II) можно рассматривать как ангидрид муравьиной кислоты . [15]
Источник
Ангидрид муравьиной кислоты вода
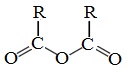
Ангидридами называют производные карбоновых кислот, у которых атом водорода карбоксильной группы замещен на ацильную группу.
Классификация. Номенклатура
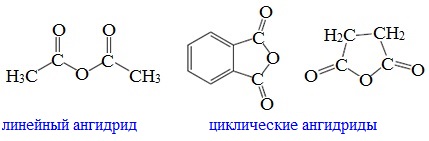
Ангидриды являются продуктами дегидратации карбоновых кислот. Различают линейные и циклические ангидриды карбоновых кислот:
Линейные ангидриды, в молекулу которых входят остатки разных кислот, в том числе и минеральных, называются смешанными ангидридами.
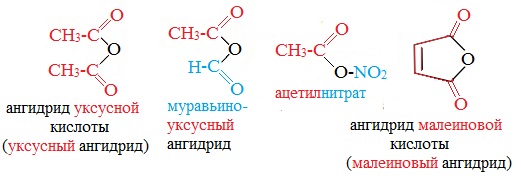
Названия ангидридов образуют из тривиальных названий соответствующих кислот:
Способы получения
1. Дегидратация карбоновых кислот
Линейный ангидриды можно получить из карбоновых кислот при взаимодействии с сильными водоотнимающими реагентами (P2O5, ангидрид трифторуксусной кислоты С4F6O3).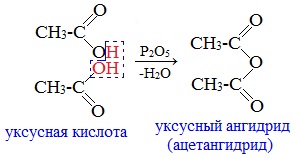
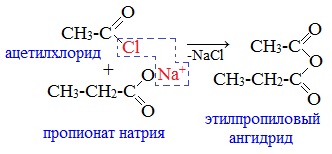
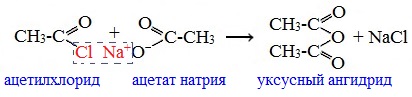
2. Взаимодействием галогенангидридов с солями карбоновых кислот
Линейные ангидриды получают взаимодействием хлорангидридов с натриевыми или калиевыми солями карбоновых кислот:
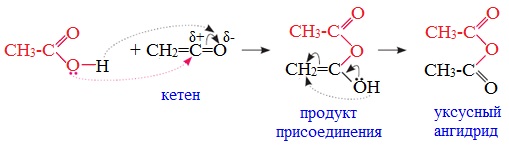
3. Взаимодействие карбоновых кислот с кетенами
Ангидриды получают при взаимодействии карбоновых кислот с кетенами:
Данный метод используется в промышленности для получения уксусного ангидрида.
Первый представитель гомологического ряда – ангидрид муравьиной кислоты – нестабилен.
Физические свойства
Ангидриды карбоновых кислот представляют собой бесцветные жидкости или кристаллические вещества. Низшие представители гомологического ряда обладают раздражающим запахом. Ангидриды карбоновых кислот малорастворимы в воде и медленно с ней реагируют.
Характеристика реакционной способности
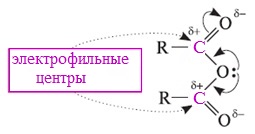
Ангидриды карбоновых кислот, подобно галогенангидридам, являются весьма активными электрофильными реагентами . Связи в молекулах ангидридов карбоновых кислот сильно поляризованы.
Ангидриды карбоновых кислот имеют менее выраженный электрофильный характер, чем галогенангидриды, но проявляют большую электрофильность по сравнению с карбоновыми кислотами, поскольку у них атом кислорода, проявляющий +М-эффект, приходится на две ацильные группы:
Ангидриды карбоновых кислот легко реагируют с различными нуклеофильными реагентами и используются для введения в их структуру ацильных групп.
Химические свойства
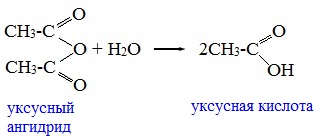
1. Взаимодействие с водой (гидролиз)
При взаимодействии с водой ангидриды медленно гидролизуются с образованием соответствующих кислот:
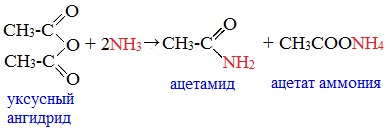
2. Взаимодействие с аммиаком (аммонолиз)
При взаимодействии линейных ангидридов с аммиаком, первичными или вторичными аминами образуются амиды карбоновых кислот:
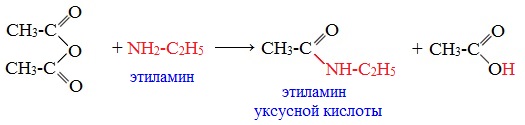
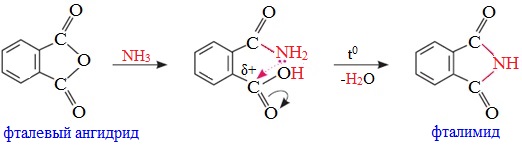
Циклические ангидриды реагируют с аммиаком и первичными аминами с образованием неполных амидов дикарбоновых кислот, которые при нагревании циклизуются в имиды:
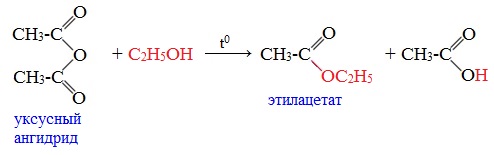
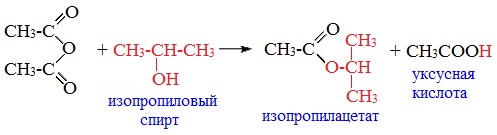
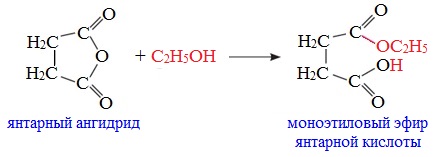
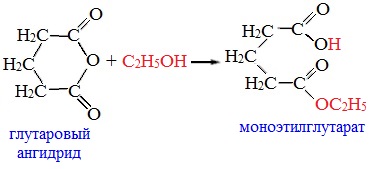
3. Взаимодействие со спиртами (алкоголиз)
При обработке линейных ангидридов спиртами образуются сложные эфиры:
Циклические ангидриды реагируют со спиртами с образованием неполных (кислых) эфиров дикарбоновых кислот:
4. Реакции α-водородного атома
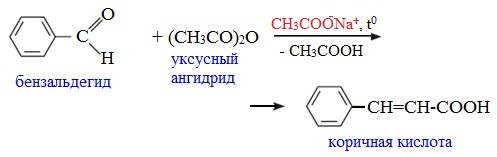
Как и в случае карбоновых кислот, в молекулах ангидридов атомы водорода при α-углеродных атомах подвижны. С участием связи С-Н в α-положении ангидриды карбоновых кислот в присутствии оснований (соли карбоновых кислот, третичные амины) вступают в реакцию конденсации с ароматическими альдегидами, образуя ненасыщенные аренкарбоновые кислоты.
5. Образование ароматических кетонов
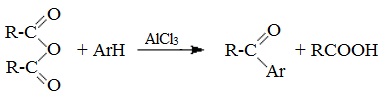
При взаимодействии ангидридов с аренами в присутствии хлорида алюминия образуются кетоны (реакция Фриделя-Крафтса):
Отдельные представители
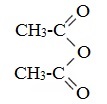
Применяется в качестве ацетилирующего реагента в производстве ацетилцеллюлозы, винилацетата, диметилацетамида, лекарственных средств (ацетилсалициловой кислоты и др.).
Используют в синтезе лекарственных препаратов (фталазол, фтазин и др.), в производстве алкидных смол, пластификаторов, красителей.
Источник