- Ароматические амины и их производные. Анилин
- Применение и получение анилина
- Анилин может взаимодействовать с бромной водой
- Владельцы сайта
- Анилин
- Анилин. Его свойства и применение .mp4
- 35 Анилин.mp4
- Изучение физических свойств анилина.mp4
- Реакция анилина с соляной кислотой.mp4
- Раствор анилина, изучение среды.mp4
- Бромирование анилина.mp4
- Окисление анилина раствором дихромата калия.mp4
- Окисление анилина раствором хлорной извести.mp4
- 3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот.
- Амины
- Общие особенности строения аминов
- Химические свойства предельных аминов
- Взаимодействие с кислотами
- Взаимодействие с галогеналканами
- Химические свойства анилина
- Взаимодействие анилина с кислотами
- Взаимодействие анилина с галогенами
- Взаимодействие анилина с азотистой кислотой
- Реакции алкилирования анилина
- Получение анилина
- Химические свойства аминокислот
- Кислотные свойства аминокислот
- Образование солей с щелочами и карбонатами щелочных металлов
- Этерификация аминокислот
- Основные свойства аминокислот
- Образование внутренних солей аминокислот в водном растворе
- Получение аминокислот
Ароматические амины и их производные. Анилин
2. Анилин взаимодействует с бромной водой. Это свойство, обусловленное радикалом, но эта реакция протекает не так, как у бензола.

Реакция взаимодействия анилина с бромной водой протекает так же, как у фенола, т. е. следующим образом:

3. В связи с ослаблением основных свойств аминогруппы под влиянием бензольного кольца анилин не способен взаимодействовать с водой, но взаимодействует с кислотами, образуя соли:

Если на раствор образовавшейся соли подействовать щелочью, вновь образуется анилин.


Особенность этой кислоты заключена в том, что в ее составе находятся две функциональные группы с противоположными свойствами. Но поскольку аминогруппа обладает слабыми основными свойствами, а сульфогруппа (остаток серной кислоты) — сильными, в полученном соединении преобладают кислотные свойства. Сульфаниловая кислота — важный промежуточный продукт в синтезе красителей и лекарственных препаратов (сульфаниламидные препараты). К сульфаниламидным препаратам относятся стрептоцид, норсульфазол, этазол и др. Они используются для лечения воспаления легких, гнойных и других заболеваний.
4. Анилин легко окисляется. При действии на анилин хлорной известью (окислитель) наблюдается фиолетовое окрашивание, этой реакцией пользуются для обнаружения анилина.
При действии на анилин хромовой смеси (K2Cr2O7 + H2SO4) вначале образуется промежуточное темно-зеленое соединение, которое затем переходит в черный анилин, используемый в качестве красителя — «анилинового черного».
Свойство анилина легко окисляться лежит в основе производства анилиновых красителей.
Применение и получение анилина
Ароматические амины широко используются в химической промышленности. Наиболее распространенным сырьем служит анилин, из которого производят анилиновые красители, лекарственные вещества (например, сульфаниламидные препараты, применяющиеся при лечении инфекционных заболеваний — ангины, менингита, дизентерии и др., а также анестезин, новокаин), взрывчатые вещества, высокомолекулярные соединения и другие важнейшие для человека вещества. К ароматическим аминам принадлежат многие практически используемые вещества, имеющие и более сложное строение.
Анилин сыграл огромную роль в создании анилинокрасочной промышленности.
С развитием текстильной промышленности в начале XIX в. возросла потребность в красителях. Поскольку природные красители не могли удовлетворить быстро развивающуюся текстильную промышленность, возникла острая необходимость получения красителей.
Источник
Анилин может взаимодействовать с бромной водой
3640 дн. с момента
как существует сайт
Владельцы сайта
Анилин
Анилин. Его свойства и применение .mp4
35 Анилин.mp4
Анилин – это ароматический амин. Его называют так, потому что аминогруппа у него связана непосредственно с атомом углерода бензольного кольца.
Анилин, или фениламин, имеет формулу С 6 H 5 NH 2 .
Он представляет собой бесцветную маслянистую жидкость с характерным запахом, мало растворим в воде, но хорошо растворяется в этаноле и бензоле. (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Изучение физических свойств анилина.mp4
Свойства аминогруппы: Рассмотрим химические свойства анилина. Он реагирует с кислотами. Так, в реакции анилина с соляной кислотой образуется хлорид фениламмония.
Реакция анилина с соляной кислотой.mp4
Эта реакция подтверждает тот факт, что аммиак и амины – основания, причём амины более сильные основания.
Однако анилин – более слабое основание, чем алифатические амины. Это объясняется наличием в его молекуле бензольного кольца, которое оказывает влияние на неподелённую пару электронов атома азота. Электронная пара электронов атома азота также взаимодействует с электронным облаком бензольного кольца, что приводит к ослаблению основных свойств.
Анилин с водой не реагирует и не изменяет окраску индикатора.
Раствор анилина, изучение среды.mp4
Таким образом, основные свойства у аммиака выражены сильнее, чем у анилина; у первичных аминов осно вные свойства выражены сильнее, чем у аммиака, а наиболее выраженными основными свойствами обладают вторичные амины.
Для анилина характерна реакция горения, при этом образуется оксид углерода (IV), азот и вода.
4C6H 5 NH 2 + 31O 2 → 24CO 2 ↑ + 2N 2 ↑ + 14H 2 O
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
Для анилина характерны свойства бензольного кольца – действие аминогруппы на бензольное кольцо приводит к увеличению подвижности водорода в кольце в орто- и пара- положениях:
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
Бромирование анилина.mp4
Для анилина характерны реакции галогенирования. Так, в реакции анилина с бромной водой образуется белый осадок 2,4,6-триброманилина.
C 6 H 5 NH 2 + 3Br 2 → C 6 H 2 NH 2 Br 3 ↓ + 3HBr

Эту реакцию используют для обнаружения анилина. Эта реакция подтверждает влияние аминогруппы на бензольное кольцо. Аминогруппа активирует бензольное кольцо, поэтому реакция бромирования анилина идёт легче, чем в бензоле.
Окисление анилина раствором дихромата калия.mp4
Окисление анилина раствором хлорной извести.mp4
В реакции анилина с хлорангидридом уксусной кислоты получают ацетанилид, который использовали как первое синтетическое жаропонижающее средство.
В реакции анилина с серной кислотой образуется вещество, которое называют ещё сульфаниловой кислотой, это вещество используют как промежуточное вещество в синтезе лекарственных средств и красителей.
С древних времён люди использовали природный краситель синего цвета – индиго. Из-за того, что этот краситель стоил очень дорого, учёные давно пытались его синтезировать.
Адольф Байер − немецкий химик, профессор Страсбургского и Мюнхенского университетов. Ему принадлежат замечательные синтезы органических соединений, в том числе синтез индиго − важнейшего природного красителя. Исследовал реакции конденсации. Изучал многие классы органических соединений. Лауреат Нобелевской премии
В 1840 году Фрицше обнаружил, что при нагревании со щёлочью синяя окраска индиго исчезает и образуется вязкая масса. Очистив это вещество, Фрицше получил жидкость с характерным запахом и назвал её анилином (от арабского an-nil «синий»).
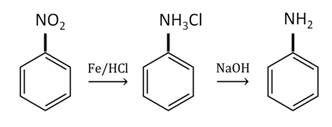
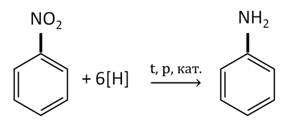
В 1841 г русский химик Зинин открыл способ восстановления нитробензола до ароматического амина – бензамида.
Николай Николаевич Зинин − выдающийся русский химик-органик, академик Петербургской академии наук, первый президент Русского химического общества.
Анилин в лаборатории получают восстановлением нитробензола железом в присутствии соляной кислоты.
В промышленности анилин получают по реакции Зинина, то есть восстановлением нитробензола. Эта реакции идёт под давлением в присутствии катализаторов.
Анилин находит широкое применение. Его используют для синтеза красителей, лекарств и взрывчатых веществ. Таким образом, представителем ароматических аминов является анилин. Свойства анилина обусловлены наличием аминогруппы и бензольного кольца. Анилин реагирует с кислотами, вступает в реакцию с бромной водой. Получают анилин в промышленности по реакции Зинина. Анилин используют в производстве красителей, лекарств и взрывчатых веществ.
Источник
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот.
Амины
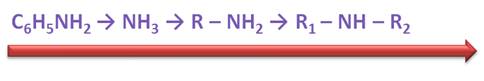
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
| первичные | вторичные | третичные |
| R-NH2 |
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
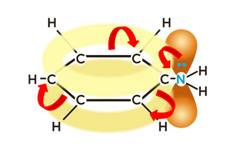
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н + .
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H + .
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
Получение анилина
1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей:
2. Далее полученную соль обрабатывают щелочью для высвобождения анилина:
В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности.
Реакция хлорбензола с аммиаком:
Химические свойства аминокислот
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Кислотные свойства аминокислот
Образование солей с щелочами и карбонатами щелочных металлов
Этерификация аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
Основные свойства аминокислот
1. Образование солей при взаимодействии с кислотами
2. Взаимодействие с азотистой кислотой
Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
4. Взаимодействие аминокислот друг с другом
Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
Образование внутренних солей аминокислот в водном растворе
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов):
Получение аминокислот
1) Реакция хлорпроизводных карбоновых кислот с аммиаком:
2) Расщепление (гидролиз) белков под действием растворов сильных минеральных кислот и щелочей.
Источник