- Химия, Биология, подготовка к ГИА и ЕГЭ
- Качественные реакции органической химии
- 4.1.5. Качественные реакции органических соединений.
- Ароматические амины и их производные. Анилин
- Применение и получение анилина
- Химические свойства алкинов
- Химические свойства алкинов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкинов
- 1.3. Гидрогалогенирование алкинов
- 1.4. Гидратация алкинов
- 1.5. Димеризация, тримеризация и полимеризация
- 2. Окисление алкинов
- 2.1. Горение алкинов
- 2.2. Окисление алкинов сильными окислителями
- 3. Кислотные свойства алкинов
Химия, Биология, подготовка к ГИА и ЕГЭ
Качественные реакции органической химии
В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны.
Это означает, что качественные реакции — это реакции с ощутимым эффектом -цвет, запах, изменение состояния вещества. «Селективность» — означает, что желательно, чтобы такая реакция на данный класс веществ или на данное вещество была уникальна. Высокая чувствительность — даже очень небольшое количество вещества должно проявляться в такой реакции.
С уникальностью в органической химии немного проблематично, но тем не менее, есть достаточно много реакций для определения того или иного вещества .
Итак, классы органических соединений и соответствующие им качественные реакции:
| Класс органических соединений | Качественные реакции |
| Алканы | У алканов нет качественных реакций. Их определяют методом исключения |
| Алкены | 1. Обесцвечивание бромной воды: 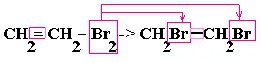 2. Изменение окраски раствора 2. Изменение окраски раствора 3СH2=CH2 + 2 KMnO4 + 4H2O → 3C2H4(OH)2 + 2 MnO2 + 2KOH |
| Циклоалканы | Обесцвечивание бромной воды: 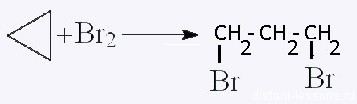 |
| Алкины | 1. Обесцвечивание бромной воды, 2. Образование ацетиленидов серебра и меди:  3. Изменение окраски перманганата калия: (KMnO4 → MnO2) C2H2 → HOOC-COOH |
| Алкадиены | Т.к. алкадиены содержат 2 двойные связи, то они так же как и алкены, обесцвечивают бромную воду |
| Арены | 1. Взаимодействие с бромом (в присутствии катализатора) 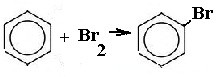
|
| Спирты | Реакция с оксидом меди — в осадок выпадает медь: 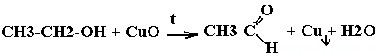 |
| Многоатомные спирты | С гидрокисдом меди (II) — Cu(OH)2 образуется комплекс синего цвета |
| Альдегиды | Реакция «серебряного зеркала» и реакция «медного зеркала»: 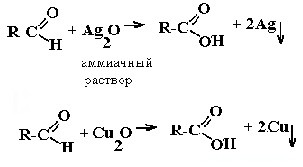 |
| Кислоты органические | Дают окрашенные соли тяжелых металлов — см. таблицу растворимости |
| Амины | Качественных реакций нет (только анилин — имеет характерный запах) |
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам.
Источник
4.1.5. Качественные реакции органических соединений.
| Соединение, функциональная группа | Реагент | Что наблюдается, уравнение реакции | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Фенол | Бромная вода | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Светло-желтая окраска разбавленного раствора соли трехвалентного железа сменяется на фиолетовую | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Анилин | Бромная вода | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Многоатомные спирты | Свежеосажденный Cu(OH)2 (II) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лакмус | Окрашивание лакмуса в красный цвет | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Карбонаты, например, K2CO3 | Любая сильная неорганическая кислота или кислота средней силы H2SO4 (разб.) HCl HI HBr HNO3 (разб.) H3PO4 |
| Энергия связи, кДж/моль | Длина связи, нм | |
| С – С | 348 | 0,154 |
| С ≡ С | 814 | 0,120 |
| С – Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С , поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С ≡ С с разрывом π-связей.
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
| Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан. |
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
| Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1. |
1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь. |
| Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан. |
Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
| Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан. |
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен. |
1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
| Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид. |
Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
| Например, при гидратации пропина образуется пропанон (ацентон). |
1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:
Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):
Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации ацетилена образуется полимер линейного или циклического строения. |
… –CH=CH–CH=CH–CH=CH–…
2. Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
Уравнение сгорания алкинов в общем виде:
| Например, уравнение сгорания пропина: |
2.2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C ≡ | R-COOH | -COOMe |
| CH ≡ | CO2 | Me2CO3 (MeHCO3) |
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C ≡ , поэтому образуется уксусная кислота:
При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:
При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
| Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C ≡ , поэтому образуется соль уксусной кислоты – ацетат калия |
Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:
Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
3. Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp 2 и sp 3 -гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
| Гибридизация: | sp | sp 2 | sp 3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н + , т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
| Ацетилен и его гомологи с тройной связью на конце молекулы R–C ≡ C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов. |
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
| Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия. |
| Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия. |
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):
| Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра или аммиачным раствором хлорида меди (I) с образованием белого или красно-коричневого осадка соответственно. Это качественная реакция на алкины с тройной связью на конце молекулы. |
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).
Источник

 Так же как и в случае фенола, где сказывается влияние на бензольное кольцо гидроксильной группы, у анилина на бензольное кольцо оказывает влияние аминогруппа —NH2. Под ее влиянием увеличивается электронная плотность в бензольном кольце, особенно в орто- и пара- (2,4,6)-положениях. В этих положениях и происходит замещение атомов водорода бензольного кольца на другие атомы или группы атомов.
Так же как и в случае фенола, где сказывается влияние на бензольное кольцо гидроксильной группы, у анилина на бензольное кольцо оказывает влияние аминогруппа —NH2. Под ее влиянием увеличивается электронная плотность в бензольном кольце, особенно в орто- и пара- (2,4,6)-положениях. В этих положениях и происходит замещение атомов водорода бензольного кольца на другие атомы или группы атомов. 

























