Опыты по химии. Непредельные углеводороды
Постановка опытов и текст – к.п.н. Павел Беспалов.
Взаимодействие ацетилена с хлором
В цилиндр насыпаем небольшое количество кристаллов перманганата калия и бросаем кусочек карбида кальция. Затем приливаем в цилиндр соляную кислоту. В сосуде наблюдаются вспышки, стенки цилиндра покрываются сажей. При взаимодействии соляной кислоты с перманганатом калия выделяется газ хлор
16 HCI + 2KMnO4 = 5CI2 + 2 KCI + 2 MnCI2 + 8H2O
С соляной кислотой карбид кальция дает ацетилен
СаС2 + 2 HCI = С2Н2 + СаCI2
Хлор с ацетиленом взаимодействуют, образуя хлороводород и уголь
С2Н2 + CI2 = 2С + 2 НCI
Оборудование: цилиндр, шпатель.
Техника безопасности. Соблюдать правила работы с горючими газами. Опыт проводить только под тягой. После проведения опыта цилиндр залить водой.
Взаимодействие этилена с бромной водой
Получаем этилен нагреванием смеси этилового спирта с концентрированной серной кислотой. Выделяющийся этилен пропустим через раствор брома в воде, который называют бромной водой. Бромная вода очень быстро обесцвечивается. Бром присоединяется к этилену по месту двойной связи. При этом образуется 1,2-дибромэтан.
СН2=СН2 + Br2 = CH2Br — CH2Br
Реакция обесцвечивания водного раствора брома служит качественной реакцией на непредельность органических соединений.
Оборудование: колба Вюрца, капельная воронка, промывалка, газоотводная трубка, стакан или пробирка, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами, концентрированными кислотами и огнеопасными жидкостями.
Взаимодействие ацетилена с бромной водой
Ацетилен получаем действием воды на карбид кальция. Пропустим выделяющийся ацетилен через бромную воду. Наблюдаем обесцвечивание бромной воды. Бром присоединяется к ацетилену по месту тройной связи. При этом образуется соединение с четырьмя атомами брома в молекуле — 1,1,2,2-тетрабромэтан.
СН ≡ СН + 2Br2 = CHBr2 — CHBr2
Обесцвечивание бромной воды доказывает непредельность ацетилена.
Оборудование: колба Вюрца, делительная воронка, газоотводная трубка, стакан или пробирка, штатив.
Техника безопасности. Опыт следует проводить под тягой. Соблюдать правила работы с горючими газами.
Взаимодействие ацетилена с раствором перманганата калия
Ацетилен получаем действием воды на карбид кальция. При пропускании ацетилена через подкисленный раствор перманганата калия наблюдаем быстрое обесцвечивание раствора. Происходит окисление ацетилена по месту разрыва тройной связи с образованием продукта окисления – щавелевой кислоты. В избытке перманганата калия щавелевая кислота окисляется до углекислого газа и воды.
Обесцвечивание раствора перманганата калия служит доказательством непредельности ацетилена.
Оборудование: колба Вюрца, делительная воронка, газоотводная трубка, стакан, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами.
Взаимодействие этилена с раствором перманганата калия.
Получаем этилен нагреванием смеси этилового спирта с концентрированной серной кислотой. Опустим газоотводную трубку с выделяющимся этиленом в подкисленный раствор перманганата калия. Раствор быстро обесцвечивается. При этом этилен окисляется в двухатомный спирт этиленгликоль.
СН2=СН2 + [О] + Н-ОН = CH2ОН — CH2ОН
Эта реакция является качественной реакцией на двойную связь.
Оборудование: колба Вюрца, капельная воронка, промывалка, газоотводная трубка, стакан или пробирка, штатив.
Техника безопасности.
Соблюдать правила работы с горючими газами, концентрированными кислотами и огнеопасными жидкостями.
Взрыв смеси ацетилена с кислородом
Смесь ацетилена с кислородом при поджигании взрывается с большой силой. Поэтому безопасно экспериментировать только небольшими объемами смеси — в этом нам поможет раствор мыла. В фарфоровую ступку с водой и раствором мыла добавим немного пероксида водорода. К полученному раствору прибавим катализатор — диоксид марганца. Сразу же начинается выделение кислорода.
В эту смесь опустим небольшой кусочек карбида кальция. При взаимодействии с водой он дает ацетилен.
На поверхности раствора, благодаря присутствию мыла, образуются пузыри, заполненные смесью ацетилена с кислородом. При поджигании пузырей происходят сильные взрывы смеси ацетилена с кислородом.
Оборудование: фарфоровая ступка, лучина.
Техника безопасности. Соблюдать правила работы с горючими газами. Поджигать можно только небольшой объем смеси.
Горение ацетилена
Получим ацетилен из карбида кальция и воды. Закроем колбу пробкой с газоотводной трубкой. В конец газоотводной трубки вставлена игла для инъекций. Через некоторое время, когда ацетилен полностью вытеснит воздух из колбы, подожжем выделяющейся газ. Ацетилен горит белым ярким пламенем. При горении ацетилена образуется углекислый газ и вода.
Внесем пробирку в пламя горящего ацетилена. На пробирке оседает сажа. При недостатке кислорода ацетилен не успевает полностью сгорать и выделяет углерод в виде сажи. Светимость пламени объясняется большим процентным содержанием углерода в ацетилене и высокой температурой его пламени, в котором раскаляются несгоревшие частицы углерода.
Оборудование: круглодонная колба, пробка с иглой от медицинского шприца, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами. Поджигать ацетилен можно только после отбора пробы на чистоту.
Горение этилена
Получаем этилен нагреванием смеси этилового спирта с концентрированной серной кислотой. Смесь готовят из одной части спирта и трех частей серной кислоты. Серная кислота играет роль водоотнимающего средства. При нагревании смеси выделяется этилен.
Собираем этилен в цилиндр способом вытеснения воды. Этилен – бесцветный газ, малорастворимый в воде. Этилен сгорает на воздухе с образованием углекислого газа и воды.
Оборудование: колба Вюрца, делительная воронка, промывалка, газоотводная трубка, штатив, цилиндр.
Техника безопасности. Соблюдать правила работы с горючими газами, концентрированными кислотами и огнеопасными жидкостями.
Получение ацетиленида меди
Ацетилен получаем действием воды на карбид кальция. Атомы водорода в молекуле ацетилена обладают большой подвижностью. Поэтому они легко могут быть замещены металлами. Пропустим через аммиачный раствор хлорида меди (I) ацетилен. Выпадает красный осадок ацетиленида меди (I) .
СН ≡ СН + 2CuCI → CuC ≡ CCu ↓ + 2HCI
Оборудование: колба Вюрца, делительная воронка, газоотводная трубка, стакан или пробирка, полипропиленовая воронка, фильтровальная бумага, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами. Получать только небольшие количества ацетиленида меди. Высушеный ацетиленид меди — очень опасное взрывчатое вещество. Его уничтожают обработкой концентрированной соляной кислотой.
Получение ацетиленида серебра
Ацетилен получаем действием воды на карбид кальция. Атомы водорода в молекуле ацетилена обладают большой подвижностью. Поэтому они легко могут быть замещены металлами. Пропустим через аммиачный раствор оксида серебра ацетилен. Выпадает осадок ацетиленида серебра.
СН ≡ СН + Аg2O → AgC ≡ CAg ↓ + H2O
Оборудование: колба Вюрца, делительная воронка, газоотводная трубка, стакан или пробирка, полипропиленовая воронка, фильтровальная бумага, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами. Получать только небольшие количества ацетиленида серебра. Высушенный ацетиленид серебра — очень опасное взрывчатое вещество. Его уничтожают обработкой концентрированной соляной кислотой.
Непрочность ацетиленидов металлов
Ацетилениды металлов — неустойчивые соединения. Во влажном состоянии ацетиленид серебра устойчив, высушенный он легко взрывается. Поднесем к сухому ацетилениду серебра тлеющую лучинку — он взрывается. Проведем аналогичный эксперимент с ацетиленидом меди (I). Так же как и ацетиленид серебра, ацетиленид меди (I) во влажном состоянии устойчив, но легко разлагается, если его высушить. Горящая лучинка, поднесенная к сухому ацетилениду меди (I), приводит к взрыву. При этом появляется пламя, окрашенное в зеленый цвет.
Оборудование: огнезащитная прокладка, лучина.
Техника безопасности. Получать и разлагать можно только небольшие количества ацетиленида серебра и меди. Высушеные ацетилениды серебра и меди — опасные взрывчатые вещества. Ацетилениды уничтожают обработкой концентрированной соляной кислотой.
Источник
Алкины
Алкины — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну тройную связь С≡С. Каждая такая связь содержит одну сигма-связь (σ-связь) и две пи-связи (π-связи).
Алкины также называют ацетиленовыми углеводородами. Первый член гомологического ряда — этин — CH≡CH (ацетилен). Общая формула их гомологического ряда — CnH2n-2.
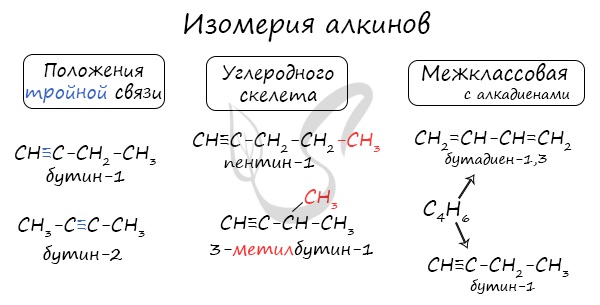
Номенклатура и изомерия алкинов
Названия алкинов формируются путем добавления суффикса «ин» к названию алкана с соответствующим числом: этин, пропин, бутин и т.д.
При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь. Нумерация атомов углерода в ней начинается с того края, к которому ближе тройная связь. В конце названия указывают атом углерода у которых начинается тройная связь.
Для алкинов характерна изомерия углеродного скелета, положения тройной связи, межклассовая изомерия с алкадиенами.
Пространственная геометрическая изомерия для них невозможна, ввиду того, что каждый атом углерода, прилежащий к тройной связи, соединен только с одним единственным заместителем.
Некоторые данные, касающиеся алкинов, надо выучить:
- В молекулах алкинов присутствуют тройные связи, длина которых составляет 0,121 нм
- Тип гибридизации атомов углерода — sp
- Валентный угол (между химическими связями) составляет 180°
Получение алкинов
Ацетилен получают несколькими способами:
- Пиролиз метана
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород.
Осуществляется напрямую, из простых веществ. Протекает на вольтовой (электрической) дуге, в атмосфере водорода.
2C + H2 → (t, вольтова дуга) CH≡CH
Разложение карбида кальция
В результате разложения карбида кальция образуется ацетилен и гидроксид кальция II.
Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена расположены у одного атома углерода или у двух соседних атомов.
Химические свойства алкинов
Алкины — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим тройную связь. Пи-связи (π-связи) рвутся, остается единичная сигма-связь (σ-связь).
CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции участвует 1 моль водорода)
CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции участвует 2 моль водорода)
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
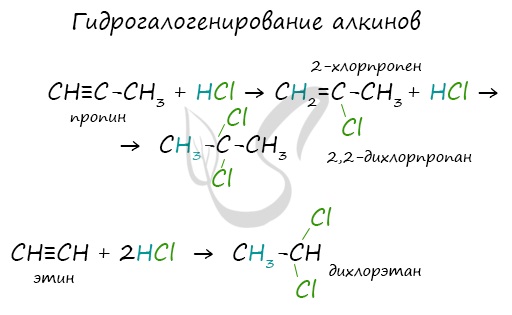
Алкины вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода.
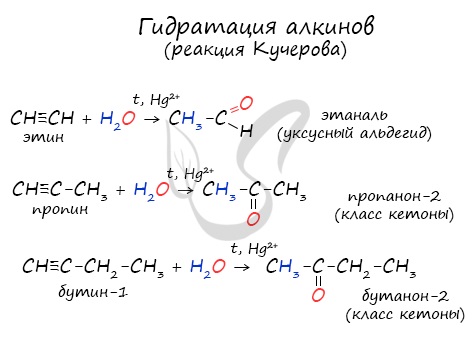
Реакцией Кучерова называют гидратацию ацетиленовых соединений с образованием карбонильных соединений. Открыта русским химиком М.Г. Кучеровым в 1881 году. Катализатор — соли ртути Hg 2+ .
Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются кетоны.
При горении алкины, как и все органические соединения, сгорают с образование углекислого газа и воды — полное окисление.
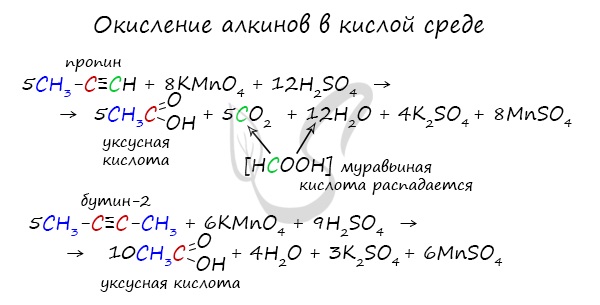
Сильные окислители (особенно в подкисленной среде) способны разрывать молекулы алкинов в самом слабом месте — в месте тройной связи.
Так, при окислении пропина, образуется уксусная кислота и муравьиная кислота, окисляющаяся до угольной кислоты, которая распадается на углекислый газ и воду.
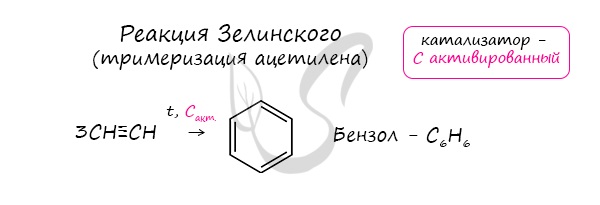
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.
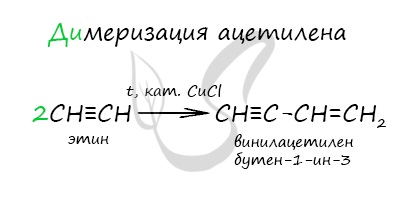
Димеризация ацетилена происходит при наличии катализатора — солей меди I. В результате реакции две молекулы ацетилена соединяются, образуя винилацетилен.
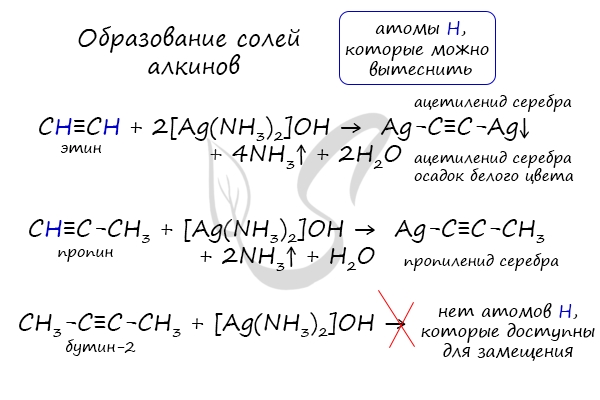
В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла. Если тройная связь спрятана внутри молекулы, то образование солей невозможно.
Реакция аммиачного раствора серебра и ацетилена — качественная реакция, в ходе которой выпадает осадок ацетиленида серебра.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник