- Ацетилен
- Содержание
- Физические свойства
- Химические свойства
- История
- Способ производства
- Применение
- Безопасность
- Ацетилен, получение, свойства, химические реакции
- Ацетилен, получение, свойства, химические реакции.
- Ацетилен, формула, газ, характеристики:
- Физические свойства ацетилена:
- Химические свойства ацетилена:
- Получение ацетилена в промышленности и лаборатории. Химические реакции – уравнения получения ацетилена:
- Применение и использование ацетилена:
- Взрывоопасность ацетилена и безопасность при обращении с ним:
Ацетилен
| Ацетилен | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Этин |
| Традиционные названия | Ацетилен |
| Химическая формула | C2H2 |
| Физические свойства | |
| Молярная масса | 26,038 [1] г/моль |
| Плотность | 0,001173 [1] г/см³ |
| Термические свойства | |
| Температура плавления | -80, 6 °C |
| Температура кипения | −83,8 °C |
| Энтальпия образования (ст. усл.) | 226,88 кДж/моль |
| Химические свойства | |
| pKa | 25 |
| Структура | |
| Гибридизация | sp |
| Классификация | |
| Рег. номер CAS | 74-86-2 |
| SMILES | C#C |
| Номер ООН | 1001 |
Содержание
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2H2 обнаружен на Уране и Нептуне.
Химические свойства
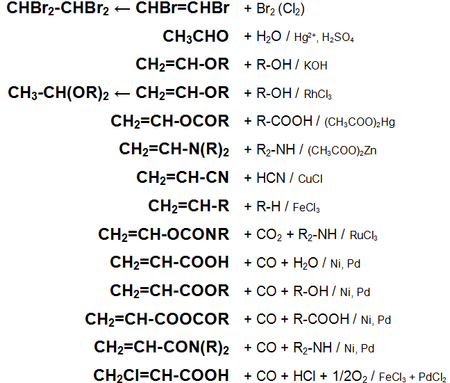
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
Применение
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях(вместе с аммиаком) [2]
Безопасность
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном. При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м 3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Источник
Ацетилен, получение, свойства, химические реакции
Ацетилен, получение, свойства, химические реакции.
Ацетилен, C2H2 – органическое вещество класса алкинов, непредельный углеводород.
Ацетилен, формула, газ, характеристики:
Ацетилен (также – этин) – органическое вещество класса алкинов, непредельный углеводород , состоящий из двух атомов углерода и двух атомов водорода.
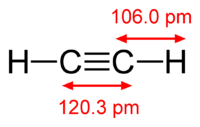
Химическая формула ацетилена C2H2. Структурная формула ацетилена СH≡CH. Изомеров не имеет.
Строение молекулы ацетилена:
Ацетилен имеет тройную связь между атомами углерода .
Ацетилен – бесцветный газ, без вкуса и запаха. Однако технический ацетилен содержит примеси – фосфористый водород , сероводород и пр., которые придают ему резкий запах.
Легче воздуха . Плотность по сравнению с плотностью воздуха 0,9.
Очень горючий газ . Пожаро- и взрывоопасен.
Ацетилен относится к числу немногих соединений, горение и взрыв которых возможны в отсутствии кислорода или других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом , метаном или пропаном .
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух , может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны , заполненные пористым материалом, пропитанным ацетоном. В них ацетилен хранится в виде раствора с ацетоном.
Малорастворим в воде . Очень хорошо растворяется в ацетоне. Хорошо растворяется в других органических веществах (бензине, бензоле и пр.)
Ацетилен обладает незначительным токсическим действием.
Физические свойства ацетилена:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,0896 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,173 |
| Температура плавления, °C | -80,8 |
| Температура кипения, °C | -80,55 |
| Тройная точка, °C | 335 |
| Температура самовоспламенения, °C | 335 |
| Давление самовоспламенения, МПа | 0,14-0,16 |
| Критическая температура*, °C | 35,94 |
| Критическое давление, МПа | 6,26 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,1 до 100 |
| Удельная теплота сгорания, МДж/кг | 56,9 |
| Температура пламени, °C | 3150-3200 |
| Молярная масса, г/моль | 26,038 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства ацетилена:
Химические свойства ацетилена аналогичны свойствам других представителей ряда алкинов. Поэтому для него характерны следующие химические реакции:
- 1. галогенирование ацетилена:
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен);
Реакция протекает стадийно с образованием производных алканов .
В ходе данной реакции ацетилен обесцвечивает бромную воду .
- 2. гидрогалогенирование ацетилена:
- 3. гидратация ацетилена (реакция Михаила Григорьевича Кучерова, 1881 г.):
- 4. тримеризация ацетилена (реакция Николая Дмитриевича Зелинского, 1927 г.):
3СH≡CH → C6H6 (бензол) (kat = активированный уголь, t o = 450-500 о С).
Реакция тримеризации ацетилена является частным случаем реакции полимеризации ацетилена и происходит при пропускании ацетилена над активированным углем при температуре 450-500 о С.
- 5. димеризация ацетилена:
СH≡CH + СH≡CH → CH2=CH-С≡CH (винилацетилен) (kat = водный раствор CuCl и NH4Cl).
Реакция димеризации ацетилена является частным случаем реакции полимеризации ацетилена.
- 6. горение ацетилена:
Ацетилен горит белым ярким пламенем.
- 7. окисление ацетилена.
Протекание реакции и её продукты определяются средой, в которой она протекает.
- 8. восстановления ацетилена:
СH≡CH + Н2 → C2H4 ( этилен ) (kat = Ni, Pd или Pt, повышенная t o );
СH≡CH + 2Н2 → C2H6 ( этан ) (kat = Ni, Pd или Pt, повышенная t o ).
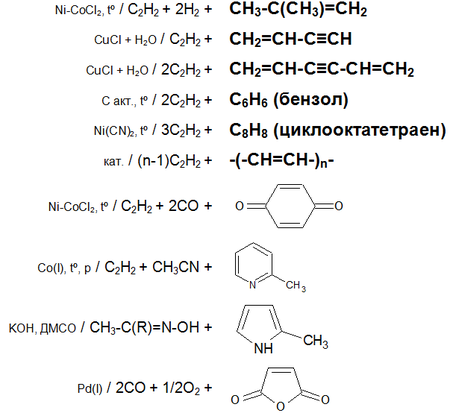
Получение ацетилена в промышленности и лаборатории. Химические реакции – уравнения получения ацетилена:
Ацетилен в лабораторных условиях получается в результате следующих химических реакций:
- 1. действия воды на карбид кальция:
- 2. дегидрирования метана:
- 3. дегидрирования этилена:
Ацетилен в промышленности получают следующими способами и методами:
- 4. карбидным методом:
Сначала получают известь из карбоната кальция.
CаСО3 → CаО + CO2. (t o = 900-1200 о С).
Затем получают карбид кальция , сплавляя оксид кальция и кокс в электропечах при температуре 2500-3000 °С.
CаО + 3С → CаС2 + CO. (t o = 2500-3000 о С).
Далее карбид кальция обрабатывают водой по известной реакции.
В итоге получается ацетилен высокой чистоты – 99,9 %.
- 5. высокотемпературным крекингом метана:
Высокотемпературный крекинг метана осуществляется по известной реакции дегидирования метана в электродуговых печах при температуре 2000-3000 °С и напряжении между электродами 1000 В. Выход ацетилена составляет 50 %.
- 6. различными способами пиролиза метана:
Разновидностью высокотемпературного крекинга метана являются регенеративный пиролиз (Вульф-процесс), окислительный пиролиз (Заксе-процесс или BASF-процесс), гомогенный пиролиз, пиролиз в среде низкотемпературной плазмы .
Так, в ходе регенеративного пиролиза сначала сжигают метан и разогревают насадку печи до 1350-1400 °С. Затем через разогретую насадку на доли секунды пропускают метан, в результате образуется ацетилен.
В ходе окислительного пиролиза метан смешивают с кислородом и сжигают. Образующееся тепло служит для нагрева остатка метана до 1600 °С, который дегидрирует в ацетилен. Выход ацетилена составляет 30-32 %.
В ходе гомогенного пиролиза метан и кислород сжигают в печи при температуре 2000 °С. Затем предварительно нагретый до 600 °С остаток метана пропускают через печь, в результате образуется ацетилен.
При пиролизе в среде низкотемпературной плазмы метан нагревают струей ионизированного газа ( аргона или водорода ).
Применение и использование ацетилена:
– как сырье в химической промышленности для производства уксусной кислоты, этилового спирта, растворителей , пластических масс, синтетических каучуков , ароматических углеводородов,
– для газовой сварки и резки металлов,
– для получения технического углерода ,
– как источник очень яркого, белого света в автономных светильниках , где он получается реакцией карбида кальция и воды.
Взрывоопасность ацетилена и безопасность при обращении с ним:
Ацетилен обладает взрывоопасными свойствами.
Поэтому обращение с ацетиленом требует строгого соблюдения правил техники безопасности.
Ацетилен горит и взрывается даже в отсутствии кислорода и других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций.
Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Взрываемость ацетилена зависит от множества факторов: давления, температуры, чистоты ацетилена, содержания в нем влаги, наличия катализаторов и пр. веществ и ряда других причин.
Температура самовоспламенения ацетилена при нормальном – атмосферном давлении колеблется в пределах 500-600 °C. При повышении давления существенно уменьшается температура самовоспламенения ацетилена. Так, при давлении 2 кгс/см 2 (0,2 МПа, 1,935682 атм.) температура самовоспламенения ацетилена равна 630 °C. А при давлении 22 кгс/см 2 (2,2 МПа, 21,292502 атм.) температура самовоспламенения ацетилена равна 350 °С.
Присутствие в ацетилене частиц различных веществ увеличивают поверхность его контакта и тем самым снижает температуру самовоспламенения при атмосферном давлении. Например, активированный уголь снижает температуру самовоспламенения ацетилена до 400 °С, гидрат оксида железа (ржавчина) – до 280-300 °С, железная стружка – до 520 °С, латунная стружка – до 500-520 °С, карбид кальция – до 500 °С, оксид алюминия – до 490 °С, медная стружка – 460 °С, оксид железа – 280 °С, оксид меди – до 250 °С.
Взрывоопасность ацетилена уменьшается при разбавлении ацетилена другими газами , например азотом, метаном или пропаном.
При определенных условиях ацетилен реагирует с медью , серебром и ртутью образуя взрывоопасные соединения. Поэтому при изготовлении ацетиленового оборудования (например, вентилей баллонов) запрещается применять сплавы , содержащие более 70 % Cu.
Для хранения и перевозки ацетилена используются специальные стальные баллоны белого цвета (с красной надписью «А»), заполненные инертным пористым материалом (например, древесным углём). При этом ацетилен хранится и перевозится в указанных баллонах в виде раствора ацетилена в ацетоне под давлением 1,5-2,5 МПа.
Источник