Азеотроп, или можно ли прыгнуть выше головы?
pic1.jpg Азеотроп, или можно ли прыгнуть выше головы? Вопросы ректификаторов.
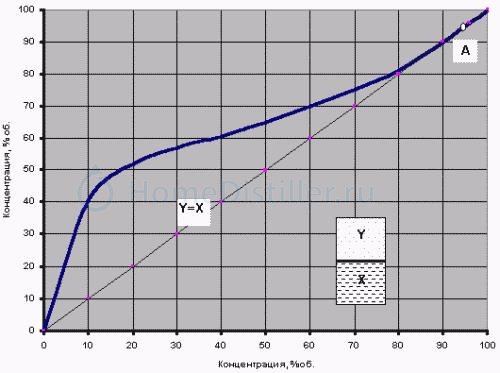
Кривая равновесия фаз бинарной водно-спиртовой смеси (при давлении 760 мм рт.ст.)
Рассматривая этот график, стоит обратить внимание на диагональ Y=X. Именно благодаря тому, что почти вся кривая равновесия лежит выше этой диагонали, можно при испарении водно-спиртовой смеси получать концентрацию спирта в парах большую, чем его концентрация в исходной жидкости. Исключением является только точка А — пересечение кривой равновесия с диагональю, где X=Y=96,4%. Это особая точка азеотропы.
Азеотропными или нераздельно кипящими называют смеси, у которых пар, находящийся в равновесии с жидкостью, имеет тот же состав, что и жидкая смесь (X=Y). При перегонке азеотропных смесей образуется конденсат того же состава, что и исходная смесь. Разделение таких смесей перегонкой и ректификацией исключается .
Посл. ред. 12 Янв. 10, 19:06 от Sergey_Gusev
Все просто. В точке азеотропии жидкость испаряется без изменения состава: сколько спирта в жидкости, столько и в паре, укрепления нет. В этой точке энергия молекул воды сравнивается с энергией молекул спирта в Броуновском движении. В заазеотропной области энергия воды становится выше и при перегонке происходит обеднение спиртом до точки азеотропии.
Азеотропию в принципе можно обмануть на основе первого закона Вревского. В сильно упрощенном виде: при понижении давления точка азеотропии повышается по диагонали линии равновесия. При остаточном давлении 76 мм рт. ст. она упирается в 100% и смесь становится идеальной, подчиняясь закону Рауля.
Плюс можно воду отобрать химически, например добавив вещества не реагирующие с спиртом, но поглощающие воду, классика: обезвоженный медный купорос CuSO4.
Посл. ред. 12 Янв. 10, 19:14 от mak210
это несоответствие пока у меня окончательно не случилось раздвоение личности. Sergey_Gusev, 12 Янв. 10, 18:55
По крайней мере спирт 97 с плюсом градусов увидел только на СПН.
Игорь, 11 Янв. 10, 22:05
KD, ты первый дал толковый ответ.
Азеотропная точка для спирта — не 96% и не 96,4%. ХЗ кто придумал эту ересь. По крайней мере эта кривулька с цифрой 96,4 взата из руковыодства по перегонке и ректификации, нашкрябанного пр.г.м.т.х.никой.
Sergey_Gusev, запомни и передай внукам. Азеотроп — 97,17 объемных процентов спирта. Это максимальная концентрация, которую можно получить при перегонке или ректификации без специальных приёмов с давлением и прочих хитростей.
Спирт с собственной колонны, который Роман Николаевич отдал на лабораторные исследования, имел концентрацию 97%, что соответствует минимум 35-ти ступеням разделения в его колонне.
В пересчете на объемные доли (которые имеряет ареометр) — 97,17% и 2,83% соответственно.Плюс почти всегда меньшее давление чем 760 мм рт. ст., вранье ареометра, неточная температура, нетрезвый взляд KD, 12 Янв. 10, 20:26
Во-во!
Но взгляд KD, у меня если и вечером нетрезв иногда, то на утро как алмаз! Подопечные на работе, точно взгляда не выдерживают!
И вот не давеча, после очередной ректификации замерял АСПТ 60-100 двумя штуками, АСП 90-100 — после чего измерив температуру спирта (калиброванными-электронными) и воспользовавшись калькулятором Руди = получил 97,2%, ну давление было тогда 750 мм или 755 мм ртути (знаю потому, что тогда купил очередной барометр и выставлял его по телефону с гидрометеослужбой).
Классный кстати барометр купил, какой-то Российский (вроде Питерский) в деревянном корпусе с разными штампиками ОТК и прочими контрольными отметками. Показывают с гидрометеослужбой с точностью до мм ртути!
Спирт с собственной колонны, который Роман Николаевич отдал на лабораторные исследования, имел концентрацию 97%, что соответствует минимум 35-ти ступеням разделения в его колонне. Игорь, 12 Янв. 10, 20:39
Посл. ред. 13 Янв. 10, 01:52 от Роман Николаевич
Источник
Что такое азеотроп со спиртом и чем он важен самогонщику
Иногда на форумах можно встретить загадочное слово “азеотроп” или сочетание “точка азеотропа”. Это понятие пришло в самогоноварение из химии и промышленной дистилляции и относится к “чистому” спирту” крепостью более 97%. Что за зверь этот азеотроп и зачем его нужно знать самогонщику — разбираемся вместе.
Что такое азеотроп?
Азеотроп — это нераздельнокипящая смесь двух и более жидкостей. Каждая из жидкостей азеотропа при стабильном атмосферном давлении образует пар и конденсат того же состава, что и она сама. Азеотроп не обязательно постоянен, чаще есть точка (точки) азеотропа, в которой совпадают все условия для неизменности состава смеси. Поэтому азеотроп обычно описывают графиком:
Зачем самогонщику точка азеотропа?
У азеотропа спирта с водой тоже есть точка — 97,17% объемных долей спирта. Точка азеотропа во время перегонки наступает при температуре 78,1оС и нормальном атмосферном давлении. До этой точки и температуры спирт с водой кипит и пары обогащаются спиртом более, чем водой. После этой точки — менее. Иначе говоря, точка азеотропа связана с конечной точкой перегонки — нет смысла разделять спирт на фракции после точки азеотропа. Здесь надо сказать, что на бытовом оборудовании получить спирт крепче 97,1% не получится вообще. Более крепкий спирт можно получить только если использовать эпюрацию, снизить атмосферное давление, либо обезводить состав, например — обезвоженным медным купоросом (но после купороса пить его будет нельзя).
Кстати, наиболее близко к спирту крепостью выше 97,17% и точке азеотропа можно подойти, используя колонну с высокоэффективной спирально-призматической насадкой (СПН). Благодаря огромной площади контакта СПН дает максимально возможное при атмосферном давлении укрепление и разделение спирта. Такая насадка используется во многих современных аппаратах, например — в Люкссталь 8m.
Источник
Азеотроп этанол вода температура кипения
Сивуха в готовый продукт поступает вообще-то двумя путями:
1. Брызгоунос;
2. В составе азеотропных смесей
И если с брызгоуносом всё более-менее ясно и мерой борьбы, причем замечу, эффективной мерой является снижение скорости потока пара (что, в свою очередь, достигается банальным уменьшением нагрева), то второй путь хотелось бы разглядеть «вооруженным глазом». И наука тут нам в помощь.
Наука гласит:
АЗЕОТРОПНЫЕ СМЕСИ (азеотропы) , жидкие смеси , характеризующиеся равенством составов равновесных жидкой и паровой фаз. При их перегонке образуется конденсат того же состава, что и исходный раствор; поэтому азеотропные смеси наз. также нераздельнокипящими. Наличие азеотропных смесей существенно затрудняет разделение жидких смесей и требует применения специальных методов ректификации .
Азеотропные смеси встречаются как в двойных, так и в многокомпонентных системах . Некоторые вещества особенно склонны к образованию азеотропных смесей, особенно с представителями к.-л. одного гомологического ряда. В многокомпонентных системах можно наблюдать явления полиазеотропии, когда гомологи и их изомеры из различных рядов могут образовывать между собой большое число двух- и многокомпонентных азеотропных смесей, охватывающих широкий концентрац. интервал.
Известно ок. 10 000 систем с азеотропными смесями, что составляет примерно половину всех изученных смесей. Поэтому изучение свойств систем с азеотропизмом необходимо для построения общего учения о фазовых равновесиях и кри.тич. состоянии.
Двухкомпонентные системы. Кривые зависимости общего давления от состава при постоянной т-ре (изотермы общего давления ) имеют максимумы или минимумы (точки А 1 , А 2 , А 3 на рис. 1).
Рис. 1. Диаграмма равновесия жидкость-пар в двойной системе с положит. (а) и отрицат. (б) азеотропами; 1-4-изотермы равновесия жилкой и паровой фаз; A1, А2, А3-азеотропы; К аз -критическая точка азеотропа; ЦС аз -линия азеотропов; М-точка, соответствующая температурному минимуму (а) и температурному максимуму (б) на критической кривой, соответственно К1К аз МК2 и К1МК аз К2.
Тройные системы. Добавление к двойной неидеальной системе третьего компонента может как уменьшить, так и увеличить ее неидеальность. Поэтому в тройной системе может не быть тройного азеотропа и при наличии азеотропных смесей в двойных системах, составляющих данную тройную. И наоборот, тройной азеотроп может появиться при отсутствии в двойных системах азеотропных смесей, причем вероятность появления тройного азеотропа тем больше, чем больше число азеотропных смесей в двойных системах.
Рис. 2. Диаграмма равновесия жидкость-пар в системе с тройным положительным азеотропом К состава А(1, 2, 3) и тремя двойными азеотропами А(1, 2), А(2, 3), А(1, 3). Заштрихована изобарическая поверхность равновесной жидкой фазы.
Экспериментальные исследования систем с тройными азеотропными смесями очень трудоемки. Поэтому большую роль здесь играют теоретические представления о возможных видах диаграмм состояния . Широко используется для этого правило азеотропии, которое качественно связывает количество и типы двойных и тройных азеотропов в системе. Поскольку в тройных системах изобарические поверхности температур кипения имеют хребты и впадины, то для проведения ректификации удобными становятся выделенные ими отдельные области параметров.
Теперь переводим всё вышесказанное на обычный русский язык обывателя, просто желающего получить качественный продукт в бутылке (или, еще лучше – в рюмке).
Итак, в исходной диспозиции мы имеем перебродивший исходный продукт. Кого-то может распирать гордость от того, что у него в бочке бродил виноград, другого может пучить от счастья брожения абрикосов, кто-то может скромно посапывать со своим сахаром. Тем не менее, итог один: мы имеем брагу для перегонки. Сложность исходного состава невообразима. Более десятка простых и сложных веществ и только один нужный – этиловый спирт.
Коварство этанола в том, что он очень легко формирует азеотропы. Поэтому крепость в 100% достигается нетривиальным химическим путем. И то ненадолго, т.к. абсолютизированный этанол осушает воздух и превращается в стабильную азеотропную смесь с концентрацией этилового спирта 96,4%.
Что такое азеотроп? В бытовом смысле – это снежок. Обычный детский шарик, слепленный из снега. Применительно к этиловому спирту мы имеем три более-менее выраженных пика азеотропных смесей. Это соответствует крепости:
10% — теоретически возможная концентрация этанола, которую можно получить на супер-пупер-мега аппарате в конце отгона. Далее вы получаете практически всю смесь перегонного куба за исключением мути.
40% — граничная стадия завершения отгона на заурядных деревенско-колхозных прямоточниках, после чего начинает идти откровенная сивуха. До этой фазы результат еще горит в ложке – классика жанра для подавляющего числа любителей самостоятельного взращивания зеленого змия.
96,4% — вожделенная мечта каждого страждущего профессионала. Рубеж, к которому устремлены умственные и творческие усилия всех самоделкиных в стройных рядах винокуров.
А делать-то чё? Справедливый вопрос. Наука прямо указывает на мегазависимость поведения азеотропа от давления. Углубление в анналы показывает улучшение процесса разделения при снижении давления. Водоструйный насос вполне справляется со своей задачей.
Сам аппарат дополняется нехитрым приспособлением, в итоге получая нечто, похожее на
Разочарую. Для первоначального процесса штука более вредная, нежели полезная. Почему? Потому что мы изначально имеем дело с многокомпонентным азеотропом. Образно говоря, в ваш «снежок» зачерпнуто помимо снега еще и горсточка собачьих какашек. И далеко не факт, что это «дополнение» не испарится при пониженном давлении.
Первый отгон на внятном аппарате с контролируемым температурным режимом весьма неплохо справляется с задачей отсекания основной массы ненужной смеси. Так что эксперименты с давлением лучше оставить на вторую перегонку, когда в «исходнике» осталось не так много ненужного. Ну и приготовьтесь к естественным потерям количества элексира.
Упрощает в определенной степени такой вот дивайс (алонж — по научному)
Изучение анналов химической мысли приводит к однозначному выводу: разделение азеотропов – это физическая задача. Не надо лезть в брагу, СС и другие промежуточные (а тем более – в финал) результаты с химией. (На память приходит одно вычитанное на просторах решение попытки увеличить температуру кипения воды посредством соли. Авторы совета утверждали о феноменальной результативности. Испытав на себе, авторитетно, со всей ответственностью, заявляю: НЕ НАДО этого делать. Хлориды весьма активно реагируют с компонентами браги. В итоге получается неустранимый горький привкус, весьма отрицательно сказывающийся на органолептике.)
Работайте с дефлегматором. Экспериментально подбирайте флегмово число. Весьма перспективным кажется мне использование «узкого места» на пути движения пара. Резкое изменение давления смеси в процессе прохода «щели» ломает азеотропные связи. Опять же как вы это организуете – вам решать. Я наполнил каплеуловитель стеклянными шариками, создав массу щелей, по которым проходит пар. Результат – выше всяких похвал.
Как-то так. Ищите, да обрящите! ( Евангелии от Матфея (гл . 7 , ст . 7 —8))
Источник
Азеотроп этанол вода температура кипения
1. Азеотропная перегонка
Азеотропные смеси. В главе I мы уже рассмотрели некоторые свойства растворов, близких к идеальным. В настоящей главе нам необходимо будет познакомиться с растворами, по своим свойствам далеко отстоящими от идеальных, и в первую очередь с так называемыми нераздельнокипящими, или азеотропными, смесями (азеотропами).
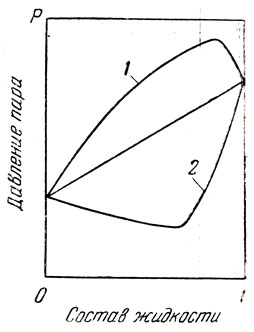
Растворы двух смешивающихся жидкостей могут, в зависимости от природы последних, по своим свойствам в той или иной степени отличаться от идеального раствора. При этом, как было показано на рис. 5, кривая зависимости давления пара от состава содержания в паре нижекипящего компонента) отклоняется от аддитивной прямой. Отклонение свойств двойной смеси от идеального раствора может быть настолько большим, что кривая давления пара будет проходить через максимум (положительное отклонение) или через минимум (отрицательное отклонение) (рис. 70).
Смесь двух жидкостей такого состава, при котором давление пара имеет максимальное значение, обладает самой низкой температурой кипения из всех возможных смесей этих жидкостей. Наоборот, смесь с минимальным давлением пара обладает самой высокой температурой кипения. Согласно второму закону Коновалова — Гиббса «в экстреммах * давлений пара или точек кипения смесей состав жидкой и парообразной фаз совпадают». Следовательно, смеси жидкостей этого состава при перегонке дают дестиллат того же состава, почему они и названы нераздельнокипящими, или азеотропными, смесями. При перегонке смеси двух веществ, способных образовать азеотропную смесь с минимумом температуры кипения, вначале отгоняется азеотропная смесь, а затем тот из компонентов смеси, который имелся в избытке по сравнению с составом азеотропной смеси. Если вещества образуют азеотропную смесь с максимумом температуры кипения, то при перегонке вначале отгоняется один из компонентов, который имеется в избытке по отношению к составу азеотропа, и лишь затем последний.
* ( Точках максимума и минимума на кривой зависимости свойств смеси от ее состава.)
Рис. 70. Зависимость давления пара от состава смеси двух веществ, образующих азеотроп: 1 — положительное отклонение от закона Рауля; 2 — отрицательное отклонение от закона Рауля
Азеотропная смесь с минимальной температурой кипения в дальнейшем для краткости иногда будет называться «минимальный азеотроп», а азеотропная смесь с максимальной температурой кипения — «максимальный азеотроп».
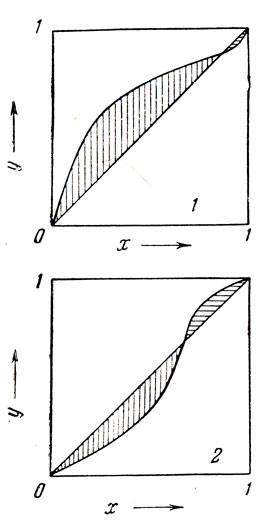
Процесс перегонки азеотропов удобно рассматривать с помощью диаграммы равновесия (рис. 71). Кривая равновесия двойных азеотропных смесей пересекает диагональ в точке, отвечающей составу азеотропной смеси. В этой точке, как гласит второй закон Коновалова-Гиббса у=х (свойство диагонали диаграммы равновесия). При перегонке азеотроп ведет себя как один из компонентов смеси. Поэтому из всей диаграммы равновесия можно вырезать одну из заштрихованных частей, как это показано на рис. 71, и рассматривать эту часть как диаграмму равновесия смеси одного из компонентов и азеотропа.
В растворе двух компонентов, которые могут образовать минимальный азеотроп, «нижекипящим компонентом» всегда является именно азеотроп, независимо от того, какую из заштрихованных частей рассматривать. Максимальный же азеотроп всегда является «вышекипящим компонентом».
В настоящее время известно свыше 3000 минимальных азеотропов и около 300 максимальных. Составы некоторых двойных азеотропных смесей приведены в приложении II. О составе и температуре кипения азеотропов см. также 12, 14, 23, 24, 25 .
Причиной отклонения свойств реальных растворов от свойств идеального раствора является взаимодействие молекул, которое может быть вызвано как физическими силами, так и химическими, например водородной связью. Чем дальше отстоят температуры кипения жидкостей друг от друга, тем большие силы необходимы для того, чтобы образовалась азеотропная смесь, и, наоборот, чем меньше разница температур кипения, тем скорее при прочих равных условиях можно ожидать появления азеотропной смеси. Так, например, этиловый спирт с водой (Δt=22°) образуют азеотропную смесь, между тем как метиловый спирт с водой (Δt=35°) уже не дают азеотропной смеси, хотя природа сил в обоих приведенных примерах одинакова.
Рис. 71. Диаграмма равновесия смеси двух веществ, образующих азеотроп: 1 — минимальный азеотроп; 2 — максимальный азеотроп
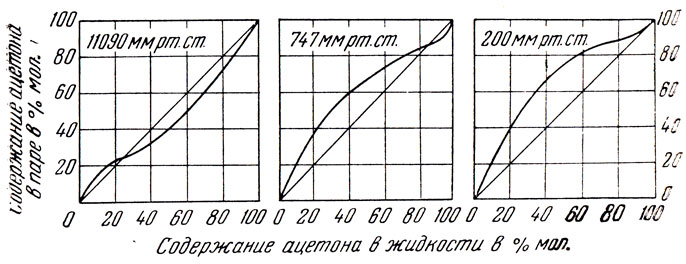
Большое влияние на температуру кипения и состав азеотропной смеси оказывает давление. Это видно, в частности, на примере смеси ацетон — метиловый спирт 76 . На рис. 72 приведены кривые равновесия этой смеси при трех различных давлениях. Как известно, при атмосферном давлении ацетон и метиловый спирт образуют азеотропную смесь, содержащую 12% вес. метилового спирта, с темп. кип. 56,7°. Однако при 200 мм рт. ст. раствор этих двух веществ не образует азеотропной смеси. Как и в обычных условиях, нижекипящим компонентом является ацетон; при 11090 мм рт. ст. азеотропная смесь содержит 75% метилового спирта, но нижекипящим компонентом является при этом уже метиловый спирт; при 15000 мм рт. ст. ацетон и метиловый спирт вновь утрачивают способность давать азеотропную смесь и нижекипящим компонентом является метиловый спирт. Бущмакин и Воейкова 77 показали, что смесь бензол — четыреххлористый углерод, применяемая для определения числа теоретических тарелок колонок, при давлениях ниже 280 мм может превращаться в азеотроп.
Рис. 72. Кривые равновесия смеси ацетона с метиловым спиртом при разных давлениях
Таким образом, смеси, которые обычно считают азеотропными, например смесь ацетона и метилового спирта, при давлении, отличающемся от атмосферного, могут разделяться перегонкой; в то же время смеси, которые обычно относят к неспособным давать азеотроп, как, например, упомянутая выше смесь бензола и четыреххлористого углерода, при давлении, отличающемся от атмосферного, приобретают эту способность.
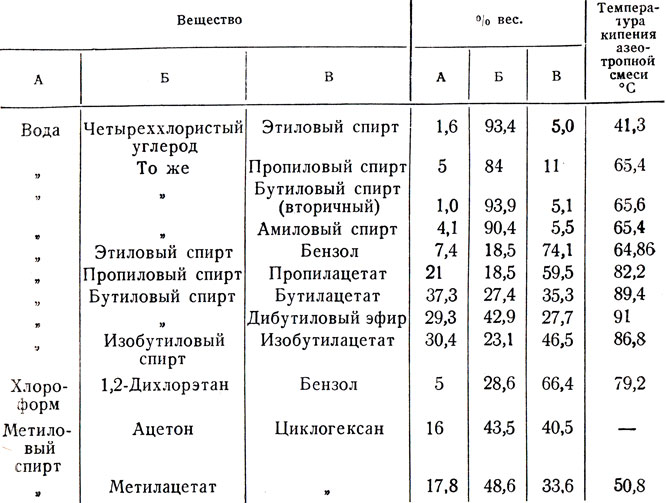
Число компонентов азеотропной смеси может быть и больше двух. В табл. 10 приведены некоторые азеотропные смеси, состоящие из трех компонентов.
Процесс азеотропной перегонки. Если раньше считалось, что образование азеотропной смеси служит только помехой при разделении ее компонентов, то в настоящее время это явление часто используется для выделения чистых веществ. Основным залогом успеха в последнем случае является правильный подбор добавляемого вещества («добавки»). Добавка для азеотропной перегонки может образовывать с компонентами смеси минимальный или максимальный азеотроп. В первом случае желательно подобрать такое вещество, которое давало бы азеотроп с компонентом или компонентами, находящимися в смеси в меньшем количестве; при этом отделение минимального азеотропа потребует меньше времени. Напротив, если добавка приводит к образованию максимального азеотропа, то желательно, чтобы в состав последнего входил компонент смеси, содержащийся в избытке.
Желательно, чтобы добавка при азеотропной перегонке, приводящая к образованию минимального азеотропа, давала азеотроп с одним компонентом смеси, если же все компоненты смеси образуют азеотроп с добавкой, то один из них должен кипеть значительно ниже других. При разделении азеотропной смеси добавка должна давать с одним из компонентов азеотроп, кипящий значительно ниже исходной азеотропной смеси. Иногда целесообразно в качестве добавки взять вещество (или даже два вещества), образующие тройную азеотропную смесь, кипящую намного ниже двойных минимальных азеотропов, если они присутствуют в смеси или образуются при введении добавки.
Общеизвестно, например, что уксусную кислоту, которая не дает азеотропной смеси с водой, очень трудно отделить от последней ректификацией. Добавка этил- или бутилацетата, образующих с водой азеотропную смесь, позволяет полностью удалить из смеси воду и получить чистую кислоту. Ацетон дает, как уже указывалось раньше, азеотропную смесь с метиловым спиртом. Ректификация ацетона с добавкой дихлорэтилена или другого галоидоалкила, дающего азеотроп с метиловым спиртом, который кипит ниже азеотропа ацетона с тем же метиловым спиртом, позволяет получить чистый ацетон. Азеотропная перегонка ацетона, не содержащего метилового спирта, с сероуглеродом позволяет очистить его от примеси ацетальдегида.
Таблица 10. Тройные азеотропные смеси с минимальной температурой кипения
Как указывается в литературе 7 , очистка ацетона азеотропной перегонкой более удобна, чем очистка по бисульфитному методу или с помощью иодистого натрия. Добавление метилового спирта, уксусной кислоты или метилэтилкетона к узким гептан-толуольным фракциям нашло применение в заводских способах выделения толуола из его смеси с парафиновыми и нафтеновыми углеводородами. При этом толуол остается в остатке. Абсолютирование спирта ректификацией с добавкой бензола также нашло промышленное применение. При этом отгоняется тройная азеотропная смесь, кипящая при 64,8°, т. е. ниже двойных азеотропных смесей спирт — бензол (темп. кип. 68,2°) и спирт — вода (темп. кип. 78°). Азеотропной перегонкой пользуются также для высушивания разнообразных веществ, удаления воды из реакционной смеси и очистки разнообразных соединений вплоть до элементоорганических, например хлорсиланов.
Необходимым требованием к добавке, образующей азеотропную смесь с выделяемым веществом, является легкость последующего отделения от него. Для этой цели весьма удобно подбирать добавки, отличающиеся по растворимости от выделяемого вещества. Так, например, при перегонке смеси углеводородов с добавкой спирта последний легко отделить от углеводородов растворением в воде. Если добавка рассчитана на образование азеотропных смесей с минимальной температурой кипения (минимальных азеотропов), то желательно, чтобы температура кипения добавки была ниже температуры вещества, выделяемого азеотропной перегонкой; если же, напротив, добавка дает максимальный азеотроп, то температура кипения ее должна быть выше температуры кипения выделяемого вещества. В этих случаях разность между температурами кипения азеотропной смеси и вещества, не входящего в ее состав, будет значительно больше. Наконец, следует еще раз отметить, что изменение давления при перегонке может иногда привести к азеотропной перегонке в более благоприятных условиях или даже к азеотропной перегонке веществ, не образующих азеотропной смеси при атмосферном давлении.
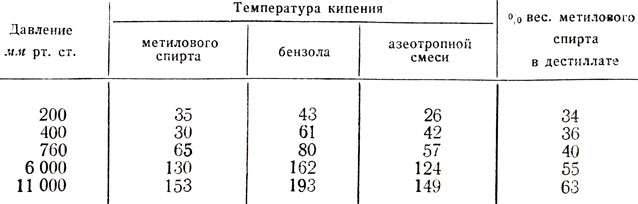
Таблица 11. влияние давления на температуру кипения азеотропной смеси метиловый спирт — бензол и на состав дестиллата
Перегонка смеси бензола и метилового спирта при давлении, меньшем, чем атмосферное, как это видно из табл. 11, увеличивает содержание бензола в дестиллате. Если же задачей азеотропной перегонки этой смеси является выделение метилового спирта, то может оказаться целесообразней перегонку проводить при повышенном давлении.
Источник
 pic1.jpg Азеотроп, или можно ли прыгнуть выше головы? Вопросы ректификаторов.
pic1.jpg Азеотроп, или можно ли прыгнуть выше головы? Вопросы ректификаторов.