Азеотропная смесь бутанол вода
Химия и Химики № 2 2008
Двойные азеотропные смеси
| Компоненты | Т. кип. °С | Состав. % | Компоненты | Т. кип. °С | Состав. % | Компоненты | Т. кип. °С | Состав. % |
| Анилин Этиленгликоль | 181 | 76 24 | Ацетальдегид Этиловый эфир | 20 | 76 24 | Ацетон Вода | 56 | 88 12 |
| Ацетон Гексан | 50 | 59 41 | Ацетон Гептан | 56 | 90 10 | Ацетон 1,1-Дихлорэтан | 58 | 30 70 |
| Ацетон Метанол | 56 | 88 12 | Ацетон Метилацетат | 55 | 48 52 | Ацетон Пентан | 33 | 20 80 |
| Ацетон Сероуглерод | 39 | 33 67 | Ацетон Хлороформ | 65 | 21 79 | Ацетон 1-хлорпропан | 46 | 15 85 |
| Ацетон Циклогексан | 53 | 67 33 | Ацетон Циклопентан | 41 | 36 64 | Ацетон Четыреххлористый углерод | 56 | 88 12 |
| Ацетонитрил Бензол | 73 | 34 66 | Ацетонитрил Вода | 77 | 84 16 | Ацетонитрил 1,2-Дихлорэтан | 79 | 49 51 |
| Ацетонитрил Метанол | 63 | 81 19 | Ацетонитрил Четыреххлористый углерод | 65 | 17 83 | Ацетонитрил Этанол | 73 | 44 56 |
| Ацетонитрил Этилацетат | 75 | 23 77 | Бензиловый спирт Вода | 100 | 9 91 | Бензол 2-Бутанол | 79 | 85 15 |
| Бензол трет-Бутиловый спирт | 74 | 63 37 | Бензол Вода | 69 | 91 9 | Бензол Гептан | 80 | 99 1 |
| Бензол 1,2-Дихлорэтан | 80 | 85 15 | Бензол Изобутиловый спирт | 79 | 92 8 | Бензол Метанол | 58 | 61 39 |
| Бензол Метилэтилкетон | 78 | 62 38 | Бензол Нитрометан | 79 | 87 13 | Бензол 1-Пропанол | 77 | 83 17 |
| Бензол 2-Пропанол | 72 | 66 34 | Бензол Циклогексан | 78 | 55 45 | Бензол Этанол | 68 | 68 32 |
| 1-Бутанол Вода | 93 | 57 43 | 1-Бутанол Гексан | 68 | 3 97 | 1-Бутанол Гептан | 94 | 18 82 |
| 1-Бутанол 1,2-Дибромэтан | 115 | 44 56 | 1-Бутанол Нитрометан | 98 | 29 71 | 1-Бутанол Пиридин | 119 | 70 30 |
| 1-Бутанол Тетрахлорэтилен | 110 | 32 68 | 1-Бутанол Толуол | 106 | 28 72 | 1-Бутанол Трихлорэтилен | 87 | 3 97 |
| 1-Бутанол Циклогексан | 80 | 10 90 | 2-Бутанол Вода | 87 | 73 27 | 2-Бутанол Тетрахлорэтилен | 97 | 57 43 |
| 2-Бутанол Толуол | 95 | 55 45 | 2-Бутанол Циклогексан | 76 | 18 82 | трет-Бутиловый спирт Вода | 80 | 88 12 |
| трет-Бутиловый спирт Гексан | 64 | 22 78 | трет-Бутиловый спирт Сероуглерод | 45 | 7 93 | трет-Бутиловый спирт Циклогексан | 72 | 37 63 |
| трет-Бутиловый спирт Четыреххлористый углерод | 71 | 17 83 | Гексан Вода | 62 | 94 6 | Гексан Метанол | 50 | 74 26 |
| Гексан Метилацетат | 52 | 39 61 | Гексан Тринитрометан | 62 | 79 21 | Гексан 1-Пропанол | 66 | 96 4 |
| Гексан 2-Пропанол | 63 | 77 23 | Гексан Титрагидрофуран | 63 | 46 54 | Гептан Вода | 79 | 87 13 |
| Гептан Метанол | 59 | 46 54 | Гептан Метилацетат | 57 | 4 96 | Гептан Пиридин | 96 | 75 25 |
| Дибромметан Этанол | 70 | 62 38 | 1,4-Диоксан Вода | 88 | 82 18 | 1,4-Диоксан Нитрометан | 100 | 43 57 |
| 1,4-Диоксан 1-Пропанол | 95 | 45 55 | Дихлорметан Вода | 39 | 98 2 | Дихлорметан Метанол | 38 | 93 7 |
| Дихлорметан Этиловый эфир | 41 | 70 30 | 1,1-Дихлорэтан Этанол | 55 | 86 14 | 1,2-Дихлорэтан Метанол | 60 | 65 35 |
| 1,2-Дихлорэтан 2-Пропанол | 73 | 61 39 | 1,2-Дихлорэтан Трихлорэтилен | 82 | 61 39 | 1,2-Дихлорэтан Этанол | 71 | 63 27 |
| Изобутиловый спирт Вода | 90 | 67 33 | Изобутиловый спирт 1,2-Дихлорэтан | 83 | 6 94 | Изобутиловый спирт Толуол | 101 | 45 55 |
| Изобутиловый спирт Трихлорэтилен | 85 | 9 91 | Изобутиловый спирт Циклогексан | 78 | 14 86 | Изобутиловый спирт Четыреххлористый углерод | 76 | 5 95 |
| Иодметан Метанол | 38 | 96 4 | Иодметан 2-Пропанол | 42 | 98 2 | Метанол Метилацетат | 54 | 18 82 |
| Метанол Октан | 63 | 68 32 | Метанол Пентан | 31 | 7 93 | Метанол Тетрахлорэтилен | 64 | 64 36 |
| Метанол Толуол | 64 | 71 29 | Метанол Трихлорэтилен | 69 | 38 62 | Метилацетат Вода | 56 | 95 5 |
| Метилацетат Пентан | 34 | 12 88 | Метилэтилкетон Вода | 73 | 89 11 | Метилэтилкетон Гексан | 64 | 30 70 |
| Метилэтилкетон 2-Пропанол | 78 | 68 32 | Муравьиная кислота Вода | 100 | 74 26 | Муравьиная кислота Толуол | 86 | 50 50 |
| Нитрометан Вода | 84 | 76 24 | Нитрометан 1-Пропанол | 90 | 48 52 | Нитрометан 2-Пропанол | 79 | 28 72 |
| Нитрометан Толуол | 97 | 55 45 | Нитрометан Трихлорэтилен | 81 | 20 80 | Нонан Вода | 95 | 60 40 |
| Октан Вода | 90 | 74 26 | Пентан Вода | 35 | 99 1 | Пентан 2-Пропанол | 36 | 6 94 |
| Пиридин Вода | 94 | 58 42 | Пиридин Тетрахлорэтилен | 113 | 49 51 | Пиридин Толуол | 110 | 22 78 |
| 1-Пропанол Вода | 88 | 72 28 | 1-Пропанол Тетрахлорэтилен | 94 | 48 52 | 1-Пропанол Толуол | 93 | 49 51 |
| 1-Пропанол Трихлорэтилен | 82 | 17 83 | 2-Пропанол Вода | 80 | 88 12 | 2-Пропанол Тетрахлорэтилен | 82 | 81 19 |
| 2-Пропанол Трихлорэтилен | 76 | 30 70 | Сероуглерод Вода | 44 | 98 2 | Сероуглерод Дихлорметан | 36 | 35 65 |
| Сероуглерод 1,1-Дихлорэтан | 46 | 94 6 | Сероуглерод Метанол | 38 | 86 14 | Сероуглерод Метилацетат | 40 | 70 30 |
| Сероуглерод Метилэтилкетон | 46 | 84 16 | Сероуглерод Муравьиная кислота | 43 | 83 17 | Сероуглерод Нитрометан | 44 | 90 10 |
| Сероуглерод Пентан | 36 | 11 89 | Сероуглерод 1-Пропанол | 46 | 95 5 | Сероуглерод 2-Пропанол | 44 | 92 8 |
| Сероуглерод Этанол | 42 | 91 9 | Сероуглерод Этилацетат | 46 | 97 3 | Сероуглерод Этиловый эфир | 34 | 1 99 |
| Сероуглерод Этилформиат | 39 | 63 37 | Тетрахлорэтилен Вода | 88 | 84 16 | Толуол Вода | 85 | 80 20 |
| 1,1,2-Трихлорэтан Вода | 86 | 84 16 | Трихлорэтилен Вода | 73 | 95 5 | Уксусная кислота Бензол | 80 | 2 98 |
| Уксусная кислота Бромбензол | 118 | 95 5 | Уксусная кислота 1-Бутанол | 120 | 43 57 | Уксусная кислота Гептан | 92 | 33 67 |
| Уксусная кислота Дибромметан | 95 | 16 84 | Уксусная кислота 1,2-Дибромэтан | 114 | 55 45 | Уксусная кислота 1,4-Диоксан | 119 | 80 20 |
| Уксусная кислота Пиридин | 138 | 51 49 | Уксусная кислота Тетрахлорэтилен | 107 | 39 61 | Уксусная кислота Толуол | 101 | 28 72 |
| Уксусная кислота Трихлорэтилен | 86 | 4 96 | Уксусная кислота Циклогексан | 80 | 2 98 | Уксусная кислота Четыреххлористый углерод | 76 | 2 98 |
| Хлороформ Вода | 56 | 97 3 | Хлороформ Гексан | 60 | 72 28 | Хлороформ Метанол | 53 | 87 13 |
| Хлороформ Метилацетат | 65 | 77 23 | Хлороформ Метилэтилкетон | 80 | 17 83 | Хлороформ Этанол | 59 | 93 7 |
| Циклогексан Вода | 70 | 92 8 | Циклогексан 1,4-Диоксан | 80 | 75 25 | Циклогексан 1,2-Дихлорэтан | 75 | 50 50 |
| Циклогексан Метанол | 45 | 63 37 | Циклогексан Метилацетат | 55 | 17 83 | Циклогексан Нитрометан | 70 | 73 27 |
| Циклогексан 1-Пропанол | 75 | 81 19 | Циклогексан 2-Пропанол | 69 | 68 32 | Циклогексан Этанол | 65 | 69 31 |
| Циклогексан Этилацетат | 72 | 44 56 | Четыреххлористый углерод Вода | 66 | 96 4 | Четыреххлористый углерод 1,2-Дихлорэтан | 75 | 83 17 |
| Четыреххлористый углерод Метанол | 56 | 79 21 | Четыреххлористый углерод Метилэтилкетон | 74 | 71 29 | Четыреххлористый углерод Муравьиная кислота | 67 | 82 18 |
| Четыреххлористый углерод Нитрометан | 71 | 83 17 | Четыреххлористый углерод 1-Пропанол | 73 | 89 11 | Четыреххлористый углерод 2-Пропанол | 69 | 82 18 |
| Четыреххлористый углерод Этанол | 65 | 84 16 | Четыреххлористый углерод Этилацетат | 75 | 57 43 | Этанол Вода | 78 | 96 4 |
| Этанол Гексан | 58 | 21 79 | Этанол Гептан | 72 | 48 52 | Этанол Иодметан | 41 | 3 97 |
| Этанол Метилэтилкетон | 75 | 34 66 | Этанол Нитрометан | 76 | 71 29 | Этанол Пентан | 61 | 25 75 |
| Этанол Толуол | 77 | 68 32 | Этанол Трихлорэтилен | 71 | 27 73 | Этанол Этилацетат | 72 | 26 74 |
| Этилацетат Вода | 71 | 92 8 | Этилацетат Метанол | 62 | 51 49 | Этилацетат 2-Пропанол | 76 | 75 25 |
| Этилформиат Метанол | 51 | 84 16 | Этиловый эфир Вода | 34 | 99 1 | Этиловый эфир Пентан | 33 | 68 32 |
Источник: Гордон А., Форд Р. Спутник химика. Физико-химические свойства, методики, библиография [Ссылка]
К1 Ацетон: нет азеотропа с водой — см. Коган равновесия справочник
[Коган В.Б., Фридман В.М., Кафаров В.В. Равновесие между жидкостью и паром кн.1, 2 (1966) — . [ссылка]]
К2 В кн. Черножуков Н.И. — Технология переработки нефти и газа. Часть 3. Очистка и разделение нефтяного сырья, производство товарных нефтепродуктов (1978) [ссылка] на С. 106 указано, что ацетон не образует азеотропных смесей с водой. — прим. ред.
Источник
Азеотропная смесь бутанол вода
1. Азеотропная перегонка
Азеотропные смеси. В главе I мы уже рассмотрели некоторые свойства растворов, близких к идеальным. В настоящей главе нам необходимо будет познакомиться с растворами, по своим свойствам далеко отстоящими от идеальных, и в первую очередь с так называемыми нераздельнокипящими, или азеотропными, смесями (азеотропами).
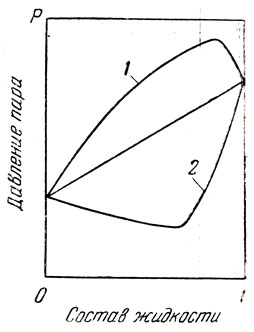
Растворы двух смешивающихся жидкостей могут, в зависимости от природы последних, по своим свойствам в той или иной степени отличаться от идеального раствора. При этом, как было показано на рис. 5, кривая зависимости давления пара от состава содержания в паре нижекипящего компонента) отклоняется от аддитивной прямой. Отклонение свойств двойной смеси от идеального раствора может быть настолько большим, что кривая давления пара будет проходить через максимум (положительное отклонение) или через минимум (отрицательное отклонение) (рис. 70).
Смесь двух жидкостей такого состава, при котором давление пара имеет максимальное значение, обладает самой низкой температурой кипения из всех возможных смесей этих жидкостей. Наоборот, смесь с минимальным давлением пара обладает самой высокой температурой кипения. Согласно второму закону Коновалова — Гиббса «в экстреммах * давлений пара или точек кипения смесей состав жидкой и парообразной фаз совпадают». Следовательно, смеси жидкостей этого состава при перегонке дают дестиллат того же состава, почему они и названы нераздельнокипящими, или азеотропными, смесями. При перегонке смеси двух веществ, способных образовать азеотропную смесь с минимумом температуры кипения, вначале отгоняется азеотропная смесь, а затем тот из компонентов смеси, который имелся в избытке по сравнению с составом азеотропной смеси. Если вещества образуют азеотропную смесь с максимумом температуры кипения, то при перегонке вначале отгоняется один из компонентов, который имеется в избытке по отношению к составу азеотропа, и лишь затем последний.
* ( Точках максимума и минимума на кривой зависимости свойств смеси от ее состава.)
Рис. 70. Зависимость давления пара от состава смеси двух веществ, образующих азеотроп: 1 — положительное отклонение от закона Рауля; 2 — отрицательное отклонение от закона Рауля
Азеотропная смесь с минимальной температурой кипения в дальнейшем для краткости иногда будет называться «минимальный азеотроп», а азеотропная смесь с максимальной температурой кипения — «максимальный азеотроп».
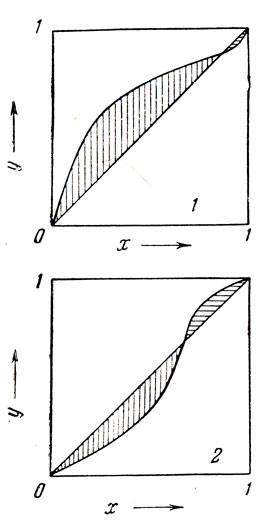
Процесс перегонки азеотропов удобно рассматривать с помощью диаграммы равновесия (рис. 71). Кривая равновесия двойных азеотропных смесей пересекает диагональ в точке, отвечающей составу азеотропной смеси. В этой точке, как гласит второй закон Коновалова-Гиббса у=х (свойство диагонали диаграммы равновесия). При перегонке азеотроп ведет себя как один из компонентов смеси. Поэтому из всей диаграммы равновесия можно вырезать одну из заштрихованных частей, как это показано на рис. 71, и рассматривать эту часть как диаграмму равновесия смеси одного из компонентов и азеотропа.
В растворе двух компонентов, которые могут образовать минимальный азеотроп, «нижекипящим компонентом» всегда является именно азеотроп, независимо от того, какую из заштрихованных частей рассматривать. Максимальный же азеотроп всегда является «вышекипящим компонентом».
В настоящее время известно свыше 3000 минимальных азеотропов и около 300 максимальных. Составы некоторых двойных азеотропных смесей приведены в приложении II. О составе и температуре кипения азеотропов см. также 12, 14, 23, 24, 25 .
Причиной отклонения свойств реальных растворов от свойств идеального раствора является взаимодействие молекул, которое может быть вызвано как физическими силами, так и химическими, например водородной связью. Чем дальше отстоят температуры кипения жидкостей друг от друга, тем большие силы необходимы для того, чтобы образовалась азеотропная смесь, и, наоборот, чем меньше разница температур кипения, тем скорее при прочих равных условиях можно ожидать появления азеотропной смеси. Так, например, этиловый спирт с водой (Δt=22°) образуют азеотропную смесь, между тем как метиловый спирт с водой (Δt=35°) уже не дают азеотропной смеси, хотя природа сил в обоих приведенных примерах одинакова.
Рис. 71. Диаграмма равновесия смеси двух веществ, образующих азеотроп: 1 — минимальный азеотроп; 2 — максимальный азеотроп
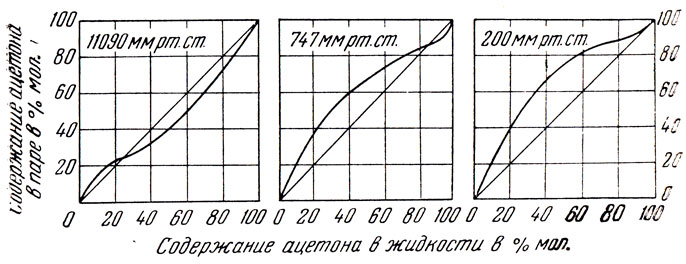
Большое влияние на температуру кипения и состав азеотропной смеси оказывает давление. Это видно, в частности, на примере смеси ацетон — метиловый спирт 76 . На рис. 72 приведены кривые равновесия этой смеси при трех различных давлениях. Как известно, при атмосферном давлении ацетон и метиловый спирт образуют азеотропную смесь, содержащую 12% вес. метилового спирта, с темп. кип. 56,7°. Однако при 200 мм рт. ст. раствор этих двух веществ не образует азеотропной смеси. Как и в обычных условиях, нижекипящим компонентом является ацетон; при 11090 мм рт. ст. азеотропная смесь содержит 75% метилового спирта, но нижекипящим компонентом является при этом уже метиловый спирт; при 15000 мм рт. ст. ацетон и метиловый спирт вновь утрачивают способность давать азеотропную смесь и нижекипящим компонентом является метиловый спирт. Бущмакин и Воейкова 77 показали, что смесь бензол — четыреххлористый углерод, применяемая для определения числа теоретических тарелок колонок, при давлениях ниже 280 мм может превращаться в азеотроп.
Рис. 72. Кривые равновесия смеси ацетона с метиловым спиртом при разных давлениях
Таким образом, смеси, которые обычно считают азеотропными, например смесь ацетона и метилового спирта, при давлении, отличающемся от атмосферного, могут разделяться перегонкой; в то же время смеси, которые обычно относят к неспособным давать азеотроп, как, например, упомянутая выше смесь бензола и четыреххлористого углерода, при давлении, отличающемся от атмосферного, приобретают эту способность.
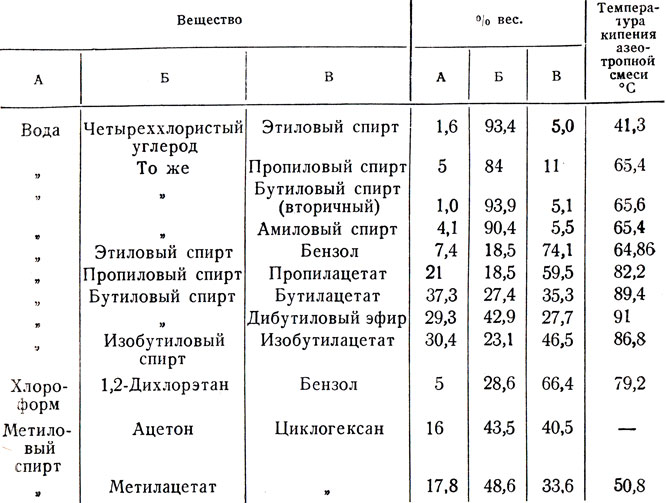
Число компонентов азеотропной смеси может быть и больше двух. В табл. 10 приведены некоторые азеотропные смеси, состоящие из трех компонентов.
Процесс азеотропной перегонки. Если раньше считалось, что образование азеотропной смеси служит только помехой при разделении ее компонентов, то в настоящее время это явление часто используется для выделения чистых веществ. Основным залогом успеха в последнем случае является правильный подбор добавляемого вещества («добавки»). Добавка для азеотропной перегонки может образовывать с компонентами смеси минимальный или максимальный азеотроп. В первом случае желательно подобрать такое вещество, которое давало бы азеотроп с компонентом или компонентами, находящимися в смеси в меньшем количестве; при этом отделение минимального азеотропа потребует меньше времени. Напротив, если добавка приводит к образованию максимального азеотропа, то желательно, чтобы в состав последнего входил компонент смеси, содержащийся в избытке.
Желательно, чтобы добавка при азеотропной перегонке, приводящая к образованию минимального азеотропа, давала азеотроп с одним компонентом смеси, если же все компоненты смеси образуют азеотроп с добавкой, то один из них должен кипеть значительно ниже других. При разделении азеотропной смеси добавка должна давать с одним из компонентов азеотроп, кипящий значительно ниже исходной азеотропной смеси. Иногда целесообразно в качестве добавки взять вещество (или даже два вещества), образующие тройную азеотропную смесь, кипящую намного ниже двойных минимальных азеотропов, если они присутствуют в смеси или образуются при введении добавки.
Общеизвестно, например, что уксусную кислоту, которая не дает азеотропной смеси с водой, очень трудно отделить от последней ректификацией. Добавка этил- или бутилацетата, образующих с водой азеотропную смесь, позволяет полностью удалить из смеси воду и получить чистую кислоту. Ацетон дает, как уже указывалось раньше, азеотропную смесь с метиловым спиртом. Ректификация ацетона с добавкой дихлорэтилена или другого галоидоалкила, дающего азеотроп с метиловым спиртом, который кипит ниже азеотропа ацетона с тем же метиловым спиртом, позволяет получить чистый ацетон. Азеотропная перегонка ацетона, не содержащего метилового спирта, с сероуглеродом позволяет очистить его от примеси ацетальдегида.
Таблица 10. Тройные азеотропные смеси с минимальной температурой кипения
Как указывается в литературе 7 , очистка ацетона азеотропной перегонкой более удобна, чем очистка по бисульфитному методу или с помощью иодистого натрия. Добавление метилового спирта, уксусной кислоты или метилэтилкетона к узким гептан-толуольным фракциям нашло применение в заводских способах выделения толуола из его смеси с парафиновыми и нафтеновыми углеводородами. При этом толуол остается в остатке. Абсолютирование спирта ректификацией с добавкой бензола также нашло промышленное применение. При этом отгоняется тройная азеотропная смесь, кипящая при 64,8°, т. е. ниже двойных азеотропных смесей спирт — бензол (темп. кип. 68,2°) и спирт — вода (темп. кип. 78°). Азеотропной перегонкой пользуются также для высушивания разнообразных веществ, удаления воды из реакционной смеси и очистки разнообразных соединений вплоть до элементоорганических, например хлорсиланов.
Необходимым требованием к добавке, образующей азеотропную смесь с выделяемым веществом, является легкость последующего отделения от него. Для этой цели весьма удобно подбирать добавки, отличающиеся по растворимости от выделяемого вещества. Так, например, при перегонке смеси углеводородов с добавкой спирта последний легко отделить от углеводородов растворением в воде. Если добавка рассчитана на образование азеотропных смесей с минимальной температурой кипения (минимальных азеотропов), то желательно, чтобы температура кипения добавки была ниже температуры вещества, выделяемого азеотропной перегонкой; если же, напротив, добавка дает максимальный азеотроп, то температура кипения ее должна быть выше температуры кипения выделяемого вещества. В этих случаях разность между температурами кипения азеотропной смеси и вещества, не входящего в ее состав, будет значительно больше. Наконец, следует еще раз отметить, что изменение давления при перегонке может иногда привести к азеотропной перегонке в более благоприятных условиях или даже к азеотропной перегонке веществ, не образующих азеотропной смеси при атмосферном давлении.
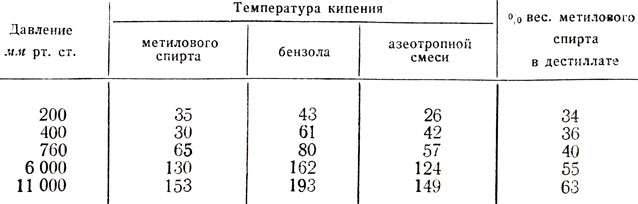
Таблица 11. влияние давления на температуру кипения азеотропной смеси метиловый спирт — бензол и на состав дестиллата
Перегонка смеси бензола и метилового спирта при давлении, меньшем, чем атмосферное, как это видно из табл. 11, увеличивает содержание бензола в дестиллате. Если же задачей азеотропной перегонки этой смеси является выделение метилового спирта, то может оказаться целесообразней перегонку проводить при повышенном давлении.
Источник