Азид натрия
| Азид натрия | |
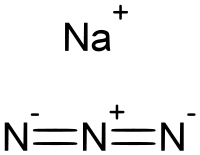 | |
| Общие | |
|---|---|
| Систематическое наименование | азид натрия |
| Традиционные названия | тринитрид натрия |
| Эмпирическая формула | NaN3 |
| Физические свойства | |
| Молярная масса | 65.0099 г/моль |
| Плотность | 1.846 г/см³ |
| Термические свойства | |
| Температура плавления | 275 [1] °C |
| Химические свойства | |
| Растворимость в воде | 41.7 [2] г/100 мл |
| Растворимость в этаноле | 0.316 [2] г/100 мл |
| Структура | |
| Кристаллическая структура | гексагональная, hR12 [3] |
| Классификация | |
| Рег. номер CAS | 26628-22-8 |
| Рег. номер EINECS | 247-852-1 |
| Регистрационный номер EC | 011-004-00-7 |
| RTECS | VY8050000 |
| Безопасность | |
| ЛД50 | 27 [3] мг/кг |
Азид натрия — неорганическое вещество с формулой NaN3. Эта бесцветная соль азотистоводородной кислоты является газообразующим компонентом во многих системах подушек безопасности. Как самый доступный азид используется для получения других азидов. Имеет высокую растворимость в воде.
Содержание
Структура
Азид натрия — ионное твёрдое вещество, существующее в двух полиморфных формах: ромбовидной и гексагональной [3] [4] .
Получение
Обыкновенно азид натрия получают из аммиака в два этапа. Сначала получают амид натрия:
Полученный продукт взаимодействует с монооксидом азота:
Другой способ заключается во взаимодействии нитрата натрия с амидом натрия [5]
Применение
Подушки безопасности
При ударе и вызванной им детонации происходит следующая реакция:
То же происходит при нагревании соли до 250—300 °C. Образующийся при этом натрий сам по себе также опасен и потому в автомобильных подушках безопасности нейтрализуется такими веществами, как нитрат калия или соединения кремния. В последнем случае образуется силикат натрия [6] . Сообщений о вреде подобных систем не зарегистрировано [7] .
Органический синтез
Азид натрия используется для синтеза органических азидов (например, метилазида, циануртриазида), как источник азотистоводородной кислоты для синтеза Шмидта.
Неорганический синтез
Азид натрия используется как прекурсор для получения других азидных соединений, таких как азид свинца и азид серебра, которые используются как взрывчатые вещества. Используется для получения особо чистого азота, чистого металлического натрия. Часто используется как безопасно хранимый источник азотистоводородной кислоты для синтезов.
Биология и медицина
Азид используется в медицине как пробный реагент, мутаген и консервант [8] .
Свойства
Уже при комнатной температуре реагирует с галогенами, нитритами щелочных металлов. При взаимодействии с сильными кислотами выделяет азотистоводородную кислоту:
Водные растворы содержат незначительные количества кислоты:

Азид разлагается при действии на него раствором азотистой кислоты: [9]
Растворы азида натрия следует считать опасными и если в них нет необходимости — нейтрализовать действием окислителей. Следует избегать воздействия на растворы азида натрия кислот, так как это ведет к выделению летучей, токсичной и взрывоопасной азотистоводородной кислоты. Описаны случаи взрывов при сливании раствора азида в канализацию, за счет образования азида железа и других металлов. Описан случай взрыва системы, состоявшей из водного раствора азида натрия и слоя дихлорметана (возможно из-за образования диазидометана).
Токсичность
Азид натрия весьма токсичен, симптоматика схожа с той, что имеет место при отравлении цианидом. Большие дозы могут привести к летальному исходу [10] .
В августе 2009 года сотрудникам одной лаборатории Гарвардского университета потребовалась госпитализация после того, как они выпили кофе из автомата рядом с рабочим помещением. Они испытывали пониженное давление и звон в ушах; один сотрудник упал в обморок. По данным лабораторных исследований, причиной стал азид, попавший в кофе [11] [12] .
Источник
Азида натрия с водой
Азид натрия — очень токсичное химическое вещество. В сообщениях о 28 случаях заболеваний, обусловленных экспозицией к азиду натрия, отмечается, что 20 пациентов выжили, 8 человек умерли. Азид натрия проглатывали по небрежности или намеренно, многие несчастные случаи происходили с персоналом лабораторий.
Эпидемическая вспышка гипотензии отмечена в группе больных, диализирующий раствор которых был из-за небрежности загрязнен в процессе проведения гемодиализа. Эти пациенты выжили. Эффективных антидотов нет. Лечение в случаях отравления азидом натрия симптоматическое и поддерживающее.
а) Взрывоопасность азида. В больницах происходили взрывы азида натрия, обусловленные применением автоматических счетчиков кровяных телец. После завершения анализа крови отходы (содержащие азид) сбрасывались в водопровод. Азид реагирует с металлами водопроводной системы, образуя скопление азида свинца и/или азида меди. Происходят мощные взрывы, когда водопроводчики пытаются проникнуть в блокированные загрязненные азидами дренажные системы с помощью гибкого металлического зонда (змеи) или перерезая либо распиливая загрязненные азидами водопроводные трубы.
б) Структура и классификация. Азиды: азид натрия — NaN3, азид калия — KN3 и азид свинца — Pb (N3)2 — это водорастворимые кристаллы, которые при растворении в воде образуют азотистоводородную кислоту (HN3) или азоимид. Азоимид (азотисто-водородная кислота) кипит при температуре 37 °С (нормальная температура тела), выделяя бесцветный и едкий газ, оказывающий токсическое действие при вдыхании.
Азид натрия — нейтральная устойчивая натриевая соль азотистоводородной кислоты (азоимида). С тяжелыми металлами азотистоводородная кислота образует взрывчатые соли.
б) Применение азида натрия. В 50-х годах изучали вероятность применения азида натрия в качестве антигипертензивного средства. Способность азида натрия быстро разлагаться с образованием азота (N2) обусловливает возможность его использования в нескольких отраслях промышленности. В настоящее время его в основном применяют в производстве автомобильных предохранительных подушек в качестве пороха и источника детонации.
В числе дополнительных сфер применения следует упомянуть производство детонаторов из азида свинца для взрывных боеприпасов, хранение сывороток и некоторых реактивов в лабораториях патологии, создание давления в аварийном желобе в самолетах, в сельском хозяйстве в качестве гербицида, фунгицида и ментицида (но быстрое разложение ограничивает его пригодность), в нефтехимической промышленности для определения степени загрязненности нефти серой.
В больницах и лабораториях азиды используют в автоматических счетчиках кровяных телец в качестве компонента разбавляющей жидкости, в химических реакциях, требующих присутствия доноров азота и для отравления митохондрий в физиологических экспериментах. Его можно обнаружить в 4 % концентрации в трис-буферном растворе, применяемом для скрининга антигена гепатита. Таким образом, доступ к этим химическим веществам могут иметь сотрудники лабораторий, фармацевтической промышленности и служб здравоохранения, а также специалисты, занятые в производстве боеприпасов, автомобильной и нефтехимической промышленности и в сельском хозяйстве.
в) Терапевтические дозы. Гипертензивных больных лечили азидом натрия в дозах от 0,65 до 3,9 мг перорально ежедневно в течение сроков от 1 нед до 2 лет, неблагоприятные эффекты были незначительными. Когда азид натрия в дозе 1,3 мг в сутки в течение 10 дней давали здоровым людям, это не влияло на кровяное давление. Некоторые испытуемые отмечали ощущение стука в голове.
г) Токсичная доза азида натрия. Случайно человек проглотил азид натрия в дозе от 5 до 150 мг. Пациент выжил. Совершенное из-за небрежности загрязнение диализирующего раствора азидом натрия привело к появлению симптомов интоксикации у 9 пациентов, к которым был подключен диализатор; по оценкам, им внутривенно ввели это вещество в дозе от 17 до 80 мкг/кг, что сопоставимо с гипотензивными дозами после лерорального приема приблизительно 300 мкг/кг и 10-20 мкг/кг.
д) Летальная доза азида натрия. К летальному исходу привело проглатывание доз 700— 800 мг (13-15 мг/кг), 1-2 г (20-40 мг/кг), 10-20 г (200-400 мг/кг), 15-20 г (300-400 мг/кг) и 55 г (1000 мг/кг).
е) Механизм действия азида натрия. Азиды скапливаются в митохондриях, где вызывают разобщение окислительного фосфорилирования и ингибируют перенос энергии. Они обусловливают сильное ингибирование цитохромоксидазы и каталазы и повышают скорость выделения неорганического фосфата из АТФ. Это вызывает аккумуляцию молочной кислоты, релаксацию гладкой мускулатуры сосудов, повышение тонуса гладких мышц желудочно-кишечного тракта и мочевыводящих путей и перемежающееся воздействие на центральную нервную систему. Может последовать некардиогенный отек легких.
Точный механизм действия не определен. Хотя нет надежных данных, на основании которых можно было бы получить специфический антидот, исследования in vitro продемонстрировали образование цианида в присутствии азида натрия. Частные сообщения и наблюдавшееся in vitro образование цианида позволяют сделать вывод, что при лечении интоксикаций, вызванных азидом натрия, целесообразно применять методы лечения цианидной интоксикации, а также контролировать уровень цианида в крови.
ж) Клиника отравления азидом натрия. Экспозиция к азиду может вызвать кашель, конъюнктивит, угнетение центральной нервной системы (припадки, коллапс, мышечная вялость, гипорефлексия, кома, фиксированный зрачок, неясность зрения, головная боль, головокружение), желудочно-кишечную стимуляцию (тошнота, рвота, диарея), релаксацию гладких мышц кровеносных сосудов (гипотензия и рефлекторная тахикардия) и резкий запах. Позднее могут последовать молочный ацидоз и через несколько дней — смерть. Без информации об экспозиции к азиду диагноз затруднен.
В отсутствие анамнеза может быть полезна информация о роде деятельности пациента и его контакте с азидами. Установлению диагноза могут помочь признаки перемежающегося возбуждения ЦНС и атонии в сочетании с признаками прогрессирующей клеточной аноксии (клиническая гипоксия, метаболический ацидоз с анионным интервалом, апноэ, гипотензия) и слабая токсичность (головная боль, тошнота) у врачей-реаниматоров. У тех, кто выжил после приема более низких доз и перенес гипотензию, головную боль и тошноту, в течение нескольких часов может наступить полное выздоровление.
з) Лабораторные данные отравления азидом натрия:
— Аналитические данные. Применяют жидкостную хроматографию высокого разрешения, чувствительность метода — несколько нанограммов азида натрия. Предел обнаружения — 10 нг/мл.
— Аутопсия. При вскрытии обнаруживали различную степень отека легких, мозга и стенок миокарда с очагами миокардиального некроза.
— Аномалии. Образующаяся из азида натрия и азида калия азотисто-водородная кислота кипит при 37 °С и легко проникает через легкие, слизистые оболочки и кожу. Азотистоводородная кислота, которая выдыхается больным и присутствует в отсосанном желудочном содержимом, может вызвать незначительное ухудшение состояния персонала отделения интенсивной терапии.
Отмечались повышение уровня белых кровяных телец (лейкоцитов), лактата в плазме и глюкозы крови. Метаболический ацидоз с большим анионным дефицитом, вероятно, обусловлен накоплением лактата. На электрокардиограмме могут выявляться различные аномалии от брадикардии до синусовой тахикардии с неспецифическими изменениями зубца Т. Наблюдались повышение в сегменте STT желудочковой тахикардии, завершающееся широким комплексным ритмом, желудочковая фибрилляция и асистолия.
Рентгенограммы грудной клетки, коагуляционные параметры, концентрации цианида, содержание токсинов в моче, функция печени и функция почек обычно бывают в пределах нормы. Для измерения центрального венозного давления, давления в легочных артериях и внутрикапиллярного легочного давления может быть использован катетер Свана-Ганца.
— Вспомогательные исследования. Добавление нескольких капель феррихлорида к профильтрованному желудочному аспирату вызывает образование красноватого осадка, что обусловлено образованием азида железа Fe(N3)3.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник