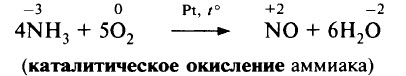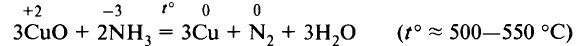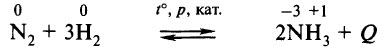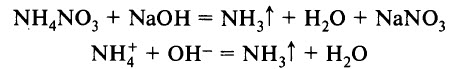- Соли аммония: получение и химические свойства
- Соли аммония
- Способы получения солей аммония
- Химические свойства солей аммония
- Аммиак: получение и свойства
- Аммиак
- Строение молекулы и физические свойства
- Способы получения аммиака
- Химические свойства аммиака
- Азотная кислота соли аммония аммиачная вода
- СТРОЕНИЕ МОЛЕКУЛЫ АММИАКА, ЕГО ФИЗИЧЕСКИЕ СВОЙСТВА
- ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА
- ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АММИАКА
- СОЛИ АММОНИЯ
Соли аммония: получение и химические свойства
Соли аммония
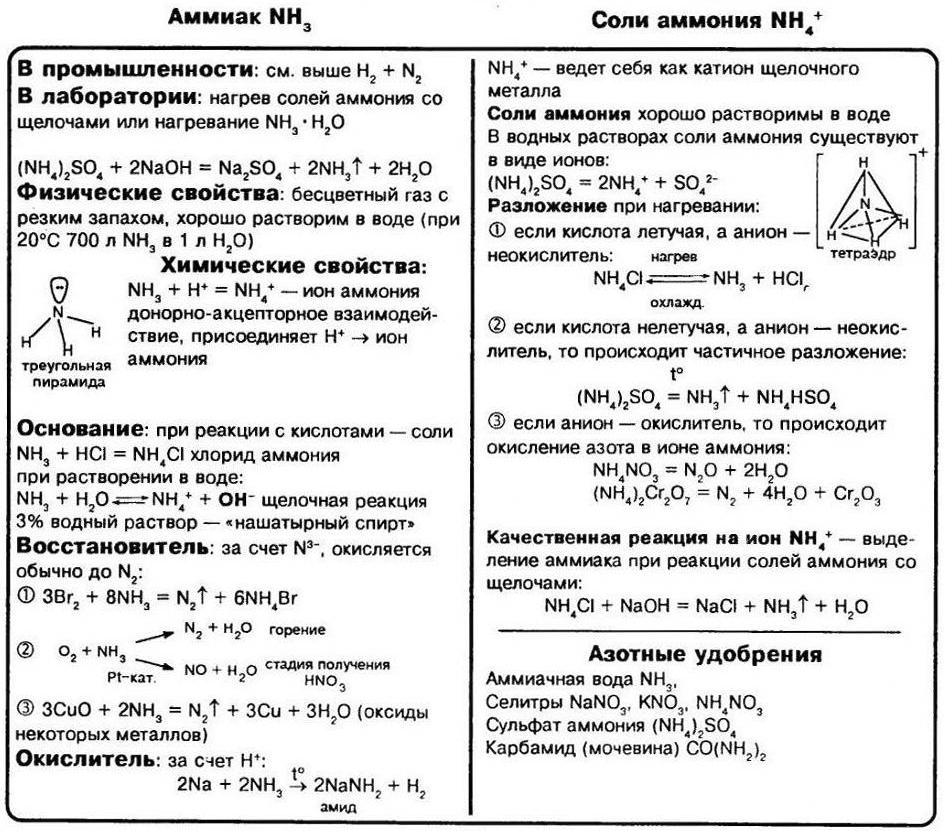
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Источник
Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Источник
Азотная кислота соли аммония аммиачная вода
Ключевые слова конспекта: аммиак, строение молекулы, свойства, соли аммония, запах аммиака, гипс, азотная кислота, мочевина.
СТРОЕНИЕ МОЛЕКУЛЫ АММИАКА,
ЕГО ФИЗИЧЕСКИЕ СВОЙСТВА
Водородным соединением азота является аммиак NH3. Аммиак – вещество молекулярного строения. Его электронная и графическая формулы изображены на рисунке.
В молекуле NH3 тип химической связи – ковалентный полярный. Электронная плотность смещена к атому азота, на атоме азота – частичный отрицательный заряд δ – , на атомах водорода – частичный положительный заряд δ + .
В молекуле аммиака одинарные связи, так как на атоме азота в молекуле NH3 имеется неподелённая электронная пара. Выступая в качестве донора электронной пары, атом азота может участвовать в образовании по донорно–акцепторному механизму четвёртой ковалентной связи с другими атомами или ионами, обладающими электроноакцепторными свойствами. Именно поэтому аммиак реагирует с кислотами. Молекула аммиака способна присоединять протон (или ион гидроксония). При этом возникает четвёртая ковалентная связь с атомом водорода по донорно–акцепторному механизму. В результате образуется ион аммония:
При обычных условиях аммиак – бесцветный газ с резким характерным раздражающим запахом. Aммиaк легче воздуха.
Аммиак кипит при температуре –33,3 °С, его температура плавления –77,7 °С. Аммиaк легко сжижается при охлаждении и повышении давления. Он обладает чрезвычайно высокой растворимостью в воде: в одном объёме воды растворяется около 1200 объёмов аммиака при 0 °С, а при +20 °С – 700 объёмов. Разбавленные растворы аммиака (3–10%) называются нашатырным спиртом, концентрированные растворы (18,5–25%) – аммиачной водой.
При работе с аммиаком надо помнить, что даже незначительное содержание его приводит к раздражению слизистой оболочки носа, горла и т. д.
ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА
Рассмотрим химические свойства аммиака с позиций окислительно-восстановительных и кислотно-основных взаимодействий.
В молекуле аммиака азот находится в низшей степени окисления (–3), поэтому за счёт азота аммиак обладает только восстановительными свойствами.
Если пропустить ток аммиака по трубке, вставленной в другую широкую трубку, по которой проходит кислород, то аммиак можно зажечь; он горит бледным зеленоватым пламенем. При горении аммиака образуется свободный азот:
В присутствии катализатора (сплав Pt и Rh) NH3 окисляется кислородом с образованием NO:
Этот процесс является одной из стадий промышленного получения азотной кислоты.
Аммиаком можно восстановить некоторые неактивные металлы или металлы средней активности из их оксидов:
В кислотно-основных взаимодействиях аммиак проявляет основные свойства. Он взаимодействует с кислотами с образованием солей аммония:
При растворении аммиака в воде устанавливается следующая совокупность равновесных состояний:
Поэтому водные растворы аммиака имеют щелочную реакцию.
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АММИАКА
Промышленным способом получения аммиака является его синтез из азота и водорода:
Сырьём является азот, полученный перегонкой жидкого воздуха, и водород, чаще всего получаемый разложением природного газа. Оптимальные условия проведения реакции: t° ≈ 500 °С, р ≈ 1000 атм, катализатор – губчатое железо с добавками (промоторами) К2O, Al2O3. В таких условиях выход аммиака составляет около 50%.
Лабораторным способом получения аммиака является взаимодействие солей аммония со щелочами при нагревании:
Эта реакция также является качественной реакцией на ион аммония. Её признак – появление запаха аммиака.
Образовавшийся аммиак хорошо растворяется в воде. Для получения аммиака в лаборатории лучше брать сульфат аммония и гидроксид кальция, тогда образующийся сульфат кальция связывает воду, образуется гипс – CaSO4 • 2H2O. Иногда вместо щёлочи используется натронная известь – смесь СаО и NaOH. Реакцию ведут при нагревании:
(NH4)2SO4 + Са(ОН)2 = CaSO4 + 2NH3↑ + 2H2O
Аммиак применяется для получения азотной кислоты HNO3, мочевины (H2N–СО–NH2) – ценного удобрения, для получения соды (Na2CO3) по аммиачному методу, для аминирования органических веществ. Жидкий аммиак и его водные растворы используются как жидкие удобрения. Аммиак применяется как хладагент в холодильниках (NH3 легко сжижается, а затем испаряется с поглощением большого количества теплоты). В медицине используется 10%-й раствор – нашатырный спирт.
СОЛИ АММОНИЯ
Соли аммония, как и другие соли, являются ионными соединениями, образованными катионами аммония NH4 + и анионами кислотных остатков. По многим свойствам соли аммония похожи на соли натрия и калия. При обычных условиях это твёрдые кристаллические вещества, бесцветные, если анион кислотного остатка не обусловливает какую–либо окраску.
Соли аммония разлагаются при нагревании. Состав продуктов реакции термического разложения зависит от природы кислотного остатка (аниона):
а) если соль аммония образована летучей кислотой и её анион не является сильным окислителем, то такая соль полностью разлагается с образованием соответствующих газов:
б) если в состав соли аммония входит анион, обладающий окислительной способностью, то при нагревании происходит окислительно–восстановительная реакция. Так, при нагревании нитрата или нитрита аммония происходит конпропорционирование (в результате степени окисления азота «сходятся»):
А нагревание дихромата аммония приводит к образованию оксида хрома(III), эту реакцию часто используют для имитации «вулканчика»:
Соли аммонию реагируют со щелочами с образованием аммиака:
Данную реакцию можно рассматривать как качественную на наличие ионов аммония. При нагревании аммиак улетучивается за счёт уменьшения его растворимости. Это легко определяется по характерному запаху аммиака и по окрашиванию влажной лакмусовой бумаги в синий цвет.
Конспект урока «Аммиак. Соли аммония».
Источник