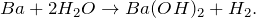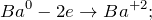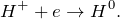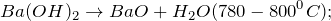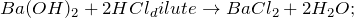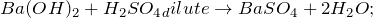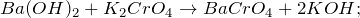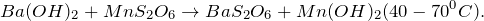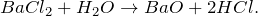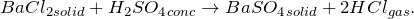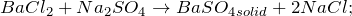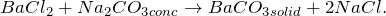- Барий: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Реакция бария с водой
- Реакция взаимодействия бария с водой.
- Уравнение реакции взаимодействия бария с водой:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- Ba + H2O = ? уравнение реакции
- BaCl2 + H2O = ? уравнение реакции
- Гидроксид бария (Ba (OH) 2): свойства, риски и применение
- Содержание:
- Свойства гидроксида бария
- Реакционная способность и опасности
- Зрительный контакт
- Контакт с кожей
- Вдыхание
- Проглатывание
- Приложения
- 1- Промышленность
- 2- Лаборатория
- 3- Катализатор реакции Виттига-Хорнера
- 4- Другое использование
- Ссылки
Барий: способы получения и химические свойства
Барий Ba — щелочноземельный металл. Серебристо-белый, ковкий, пластичный. На воздухе покрывается темной оксидно-нитридной пленкой. Реакционноспособный. Сильный восстановитель;
Относительная молекулярная масса Mr = 137,327; относительная плотность для твердого и жидкого состояния d = 3,6; tпл = 727º C; tкип = 1860º C.
Способ получения
1. В результате взаимодействия оксида бария и кремния при 1200º С образуются силикат бария и барий:
3BaO + Si = BaSiO3 + 2Ba
2. Оксид бария взаимодействует с алюминием при 1100 — 1200º С образуя барий и алюминат бария:
4BaO + 2Al = 3Ba + Ba(AlO2)2
3. В результате разложения гидрида бария при температуре выше 675º С образуется барий и водород:
Качественная реакция
Барий окрашивает пламя газовой горелки в желто — зеленый цвет.
Химические свойства
1. Барий вступает в реакцию с простыми веществами :
1.1. Барий взаимодействует с азотом при 200 — 460º С образуя нитрид бария:
1.2. Барий сгорает в кислороде (воздухе) при температуре выше 800º С, то на выходе будет образовываться оксид бария:
2Ba + O2 = 2BaO
1.3. Барий активно реагирует при температуре 100 — 150º С с хлором, бромом, йодом и фтором . При этом образуются соответствующие соли :
1.4. С водородом барий реагирует при температуре 150 — 300º C с образованием гидрида бария:
1.6. Барий взаимодействует с серой при 150º С и образует сульфид бария:
Ba + S = BaS
1.7. Барий взаимодействует с углеродом (графитом) при 500º С и образует карбид бария:
Ba + 2C = BaC2
2. Барий активно взаимодействует со сложными веществами:
2.1. Барий при комнатной температуре реагирует с водой . Взаимодействие бария с водой приводит к образованию гидроксида бария и газа водорода:
2.2. Барий взаимодействует с кислотами:
2.2.1. Барий реагирует с разбавленной соляной кислотой, при этом образуются хлорид бария и водород :
Ba + 2HCl = BaCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой барий образует нитрат бария, оксид азота (I) и воду:
если азотную кислоту еще больше разбавить, то образуются нитрат бария, нитрат аммония и вода:
2.2.3. Барий вступает во взаимодействие с сероводородной кислотой при температуре выше 350 с образованием сульфида бария и водорода:
Ba + H2S = BaS + H2
2.3. Барий вступает в реакцию с газом аммиаком при 600 — 650º С. В результате данной реакции образуется нитрид бария и гидрид бария:
если аммиак будет жидким, то в результате реакции в присутствии катализатора платины образуется амид бария и водород:
2.4. Барий взаимодействует с оксидами :
Барий реагирует с углекислым газом при комнатной температуре с образованием карбоната бария и углерода:
2Ba + 3CO2 = 2BaCO3 + C
Источник
Реакция бария с водой
Реакция взаимодействия бария с водой.
Уравнение реакции взаимодействия бария с водой:
Реакция бария с водой протекает при обычных условиях.
В результате реакции бария с водой образуются гидроксид бария и водород .
Примечание: © Фото https://www.pexels.com, https://pixabay.com

Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 484)
- Экономика Второй индустриализации России (102 475)
- Программа искусственного интеллекта ЭЛИС (27 490)
- Метан, получение, свойства, химические реакции (23 729)
- Этилен (этен), получение, свойства, химические реакции (22 797)
- Природный газ, свойства, химический состав, добыча и применение (21 165)
- Крахмал, свойства, получение и применение (20 570)
- Целлюлоза, свойства, получение и применение (19 416)
- Пропилен (пропен), получение, свойства, химические реакции (19 094)
- Прямоугольный треугольник, свойства, признаки и формулы (18 725)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
Ba + H2O = ? уравнение реакции
Здесь есть кто-нибудь, кто хорошо разбирается в химии? Мне нужна помощь: взаимодействует ли барий с водой (Ba + H2O = ?) и, что при этом получается. Укажите основные физические и химические свойства полученного соединения. Заранее, большое спасибо!
В результате взаимодействия бария с водой (Ba + H2O = ?) происходит образование гидроксида бария и выделение газа водорода. Молекулярное уравнение реакции имеет вид:
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы барий и водород изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Гидроксид бария (едкий барит) представляет собой кристаллы белого цвета, которые плавятся без разложения, но при дальнейшем нагревании разлагаются. Хорошо растворяется в воде, образует сильнощелочной раствор. Проявляет основные свойства, реагирует с кислотами. Вступает в реакции обмена.
Помимо вышеуказанной реакции гидроксид бария получают путем растворения оксида бария в воде (1) или при горячей воды на сульфид бария (2):
Источник
BaCl2 + H2O = ? уравнение реакции
Происходит ли химическая реакция между хлоридом бария и водой (BaCl2 + H2O = ?)? Укажите основные физические и химические свойства, способы применения вышеупомянутой соли. В каких отраслях народного хозяйства она нашла применение?
В результате растворения хлорида бария в воде (BaCl2 + H2O = ?) происходит образование оксида бария и хлороводорода. Реакцию проводят при нагревании в температурном диапазоне 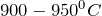
Хлорид бария – средняя соль, образованная сильным основанием – гидроксидом бария и сильной кислотой – соляной, а, значит в водном растворе не подвержена гидролизу.
Хлорид бария образуется в виде кристаллов белого цвета при взаимодействии металлического бария с хлором, а также в ходе растворения оксида / гидроксида / сульфида бария в соляной кислоте.
Эта соль хорошо растворяется в азотной кислоте, но нерастворима в концентрированной хлороводородной кислоте. Разлагается концентрированной серной кислотой:
Вступает в реакции обмена.
Хлорид бария нашел применение в качестве сырья при производстве пигментов, компонента керамических изделий; используется в кожевенном деле для утяжеления и осветления кожи.
Источник
Гидроксид бария (Ba (OH) 2): свойства, риски и применение
Содержание:
В гидроксид бария представляет собой химическое соединение формулы Ba (OH)2(ЧАС2ИЛИ)Икс. Это сильное основание, которое может быть в безводной, моногидратной или октогидратной форме. Моногидратная форма, также называемая баритовой водой, является наиболее распространенной и коммерчески используемой. Структура безводных и моногидратных соединений представлена на рисунке 1.
Гидроксид бария можно получить растворением оксида бария (BaO) в воде: BaO + 9H2О → Ва (ОН)28H2О. Он кристаллизуется в виде октагидрата, который становится моногидратом при нагревании на воздухе. При 100 ° C под вакуумом моногидрат будет производить BaO и воду.
Моногидрат имеет слоистую структуру (рис. 2). Ба центры 2+ они принимают октаэдрическую геометрию. Каждый центр Ба 2+ связан двумя водными лигандами и шестью гидроксидными лигандами, которые имеют двойные и тройные мостиковые связи с центрами Ва соответственно. 2+ соседи.
В октагидрате центры Ba 2+ Индивидуумы снова имеют восемь координат, но не имеют общих лигандов (гидроксид бария, S.F.).
Свойства гидроксида бария
Гидроксид бария представляет собой белые или прозрачные октаэдрические кристаллы. Без запаха и с едким вкусом (Национальный центр биотехнологической информации, 2017). Его внешний вид показан на рисунке 3 (IndiaMART InterMESH Ltd., S.F.).
Безводная форма имеет молекулярную массу 171,34 г / моль, плотность 2,18 г / мл, температуру плавления 407 ° C и точку кипения 780 ° C (Royal Society of Chemistry, 2015). .
Моногидратная форма имеет молекулярную массу 189,355 г / моль, плотность 3,743 г / мл и температуру плавления 300 ° C (Royal Society of Chemistry, 2015).
Форма октогидрата имеет молекулярную массу 315,46 г / моль, плотность 2,18 г / мл и температуру плавления 78 ° C (Royal Society of Chemistry, 2015).
Соединение плохо растворяется в воде и не растворяется в ацетоне. Это сильное основание с pKa 0,15 и 0,64 для первого и второго OH. – соответственно.
Гидроксид бария реагирует аналогично гидроксиду натрия (NaOH), но менее растворим в воде. Экзотермически нейтрализует кислоты с образованием солей и воды. Он может реагировать с алюминием и цинком с образованием оксидов или гидроксидов металлов и образования газообразного водорода.
Он может инициировать реакции полимеризации в полимеризуемых органических соединениях, особенно в эпоксидах.
Он может выделять легковоспламеняющиеся и / или токсичные газы с солями аммония, нитридами, галогенированными органическими соединениями, различными металлами, пероксидами и гидропероксидами. Смеси с хлорированными камедями взрываются при нагревании или измельчении (МОНОГИДРАТ ГИДРОКСИДА БАРИЯ, 2016).
Гидроксид бария разлагается до оксида бария при нагревании до 800 ° C. Взаимодействие с диоксидом углерода дает карбонат бария. Его сильно щелочной водный раствор подвергается реакции нейтрализации кислотами. Таким образом, он образует сульфат бария и фосфат бария с серной и фосфорной кислотами соответственно.
Реакция с сероводородом дает сульфид бария. Осаждение многих нерастворимых или менее растворимых солей бария может быть результатом реакции двойного замещения, когда водный раствор гидроксида бария смешивают со многими растворами солей других металлов.
Смешивание твердого гидратированного гидроксида бария с твердым хлоридом аммония в химическом стакане вызывает эндотермическую реакцию с образованием жидкости с выделением аммиака. Температура резко падает примерно до -20ºC (Королевское химическое общество, 2017).
Ba (OH) 2 реагирует с диоксидом углерода с образованием карбоната бария. Это выражается следующей химической реакцией:
Ba (OH) 2 + CO2 → BaCO3 + H2O.
Реакционная способность и опасности
Гидроксид бария классифицируется как стабильное негорючее соединение, которое быстро и экзотермически реагирует с кислотами и несовместимо с диоксидом углерода и влагой. Компаунд токсичен и, как сильное основание, вызывает коррозию.
Вдыхание, проглатывание или контакт материала с кожей может привести к серьезным травмам или смерти. Контакт с расплавленным веществом может вызвать серьезные ожоги кожи и глаз.
Следует избегать контакта с кожей. Эффекты контакта или вдыхания могут быть отсроченными. Огонь может выделять раздражающие, едкие и / или токсичные газы. Сточные воды системы пожаротушения могут быть едкими и / или токсичными и вызывать загрязнение.
Зрительный контакт
Если соединение попадает в глаза, следует проверить контактные линзы и снять их. Глаза следует немедленно промыть большим количеством воды в течение не менее 15 минут, холодной водой.
Контакт с кожей
В случае попадания на кожу пораженный участок следует немедленно промыть не менее 15 минут большим количеством воды или слабой кислотой, например уксусом, одновременно снимая загрязненную одежду и обувь. Покройте раздраженную кожу смягчающим средством.
Перед повторным использованием выстирайте одежду и обувь. При сильном контакте промойте дезинфицирующим мылом и покройте загрязненную кожу антибактериальным кремом.
Вдыхание
В случае вдыхания пострадавшего следует переместить в прохладное место. Если не дышит, делают искусственное дыхание. Если дыхание затруднено, дайте кислород.
Проглатывание
Если соединение проглочено, не следует вызывать рвоту. Ослабьте тесную одежду, такую как воротник рубашки, пояс или галстук.
Во всех случаях следует немедленно обратиться за медицинской помощью (Паспорт безопасности вещества Моногидрат гидроксида бария, 2013 г.).
Приложения
1- Промышленность
В промышленности гидроксид бария используется в качестве предшественника других соединений бария. Моногидрат используется для обезвоживания и удаления сульфата из различных продуктов. В этом приложении используется очень низкая растворимость сульфата бария. Это промышленное применение также применимо для лабораторных целей.
Гидроксид бария используется в качестве добавки в термопласты (например, фенольные смолы), царапины и стабилизаторы ПВХ для улучшения пластических свойств. Этот материал используется в качестве присадки общего назначения к смазочным материалам и консистентным смазкам.
Другие промышленные применения гидроксида бария включают производство сахара, производство мыла, омыление жиров, плавление силикатов и химический синтез других соединений бария и органических соединений (BARIUM HYDROXIDE, S.F.).
2- Лаборатория
Гидроксид бария используется в аналитической химии для титрования слабых кислот, особенно органических кислот.Его прозрачный водный раствор гарантированно не содержит карбонатов, в отличие от гидроксида натрия и гидроксида калия, поскольку карбонат бария не растворяется в воде.
Это позволяет использовать такие индикаторы, как фенолфталеин или тимолфталеин (со щелочными изменениями цвета), без риска ошибок титрования, вызванных присутствием карбонат-ионов, которые являются гораздо менее основными (Mendham, Denney, Barnes, & Thomas, 2000).
Гидроксид бария иногда используется в органическом синтезе в качестве сильного основания, например, для гидролиза сложных эфиров и нитрилов:
Гидроксид бария также используется при декарбоксилировании аминокислот, при этом выделяется карбонат бария.
Он также используется при приготовлении циклопентанона, диацетонового спирта и гамма-лактона D-Gulonic.
3- Катализатор реакции Виттига-Хорнера
Реакция Виттига-Хорнера, также известная как реакция Хорнера-Уодсворта-Эммонса (или реакция HWE), представляет собой химическую реакцию, используемую в органической химии для стабилизации карбанионов фосфонатов альдегидами (или кетонами) с образованием преимущественно Е-алкенов (транс ).
Сонкохимическая реакция Виттига-Хорнера катализируется активированным гидроксидом бария и проводится в условиях границы раздела твердое тело-жидкость.
Сонкохимический процесс протекает при комнатной температуре и с меньшим весом катализатора и меньшим временем реакции, чем термический процесс. В этих условиях достигаются выходы, аналогичные выходам термического процесса.
В работе (J. V. Sinisterra, 1987) анализируется влияние на производительность времени обработки ультразвуком, веса катализатора и растворителя. Для прохождения реакции необходимо добавить небольшое количество воды.
Проанализирована природа активного центра катализатора, действующего в процессе. Предложен механизм ETC для сонохимического процесса.
4- Другое использование
Гидроксид бария имеет и другие применения. Он используется для ряда целей, таких как:
- Производство щелочи.
- Строительное стекло.
- Вулканизация синтетического каучука.
- Ингибиторы коррозии.
- Как буровые растворы, пестициды и смазки.
- Для исправления котла.
- Для очистки растительных и животных масел.
- Для фресковой живописи.
- В умягчении воды.
- Как ингредиент гомеопатических средств.
- Чтобы убрать пролитую кислоту.
- Он также используется в сахарной промышленности для приготовления свекловичного сахара.
- Строительные материалы.
- Электрическая и электронная продукция.
- Напольные покрытия.
Ссылки
- МОНОГИДРАТ ГИДРОКСИДА БАРИЯ. (2016). Получено из химикатов: cameochemicals.noaa.gov.
- Гидроксид бария. (С.Ф.). Получено с сайта chemistrylearner: chemistrylearner.com.
- ГИДРОКСИД БАРИЯ. (С.Ф.). Получено с сайта chemicalland21: chemicalland21.com.
- IndiaMART InterMESH Ltd. (С.Ф.). Гидроксид бария. Получено с indiamart: dir.indiamart.com.
- В. Синистерра, А. Ф. (1987). Ba (OH) 2 как катализатор в органических реакциях. 17. Межфазная реакция Виттига-Хорнера твердое тело-жидкость в сонохимических условиях.Журнал органической химии 52 (17), 3875-3879. researchgate.net.
- Паспорт безопасности материала Моногидрат гидроксида бария. (2013, 21 мая). Получено с сайта sciencelab: sciencelab.com/msds.
- Мендхэм, Дж., Денни, Р. К., Барнс, Дж. Д. и Томас, М. Дж. (2000). Количественный химический анализ Фогеля (6-е изд.). Нью-Йорк: Прентис-Холл.
- Национальный центр биотехнологической информации. (2017, 28 марта). База данных PubChem Compound; CID = 16211219. Получено с PubChem: pubchem.ncbi.nlm.nih.gov.
- Королевское химическое общество. (2015). Гидроксид бария. Получено с сайта chemspider: chemspider.com.
- Королевское химическое общество. (2015). Гидрат гидроксида бария (1: 2: 1). Получено с сайта chemspider: chemspider.com.
- Королевское химическое общество. (2015). Дигидроксибария гидрат (1: 1). Получено с сайта chemspider: chemspider.com.
- Королевское химическое общество. (2017). Эндотермические твердые-твердые реакции. Получено с: learn-chemistry: rsc.org.
Как удалить блох с моей собаки? 4 подсказки
Источник