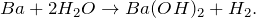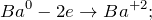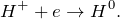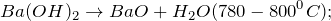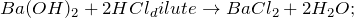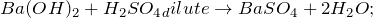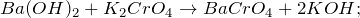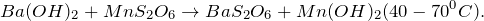- Гидрид бария: способы получения и химические свойства
- Способ получения
- Химические свойства
- Реакция бария с водой
- Реакция взаимодействия бария с водой.
- Уравнение реакции взаимодействия бария с водой:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- Барий вода гидроксид бария водород уравнение реакции
- Как написать хороший ответ?
- Ba + H2O = ? уравнение реакции
Гидрид бария: способы получения и химические свойства
Гидрид бария BaH2 — неорганическое бинарное соединение щелочноземельного металла бария и водорода. Белый, плавится без разложения в атмосфере H2, при дальнейшем нагревании разлагается. Сильный восстановитель.
Относительная молекулярная масса Mr = 42,09 относительная плотность для тв. и ж. состояния d = 1,9; tпл ≈ 1000º C.
Способ получения
1. Гидрид бария получают реакцией взаимодействия бария и водорода при 150 — 300º C:
Химические свойства
1. Гидрид бария реагирует с простыми веществами :
1.1. При взаимодействии с кислородом при температуре 150 — 200º C гидрид бария образует оксид бария и воду:
1.2. При температуре 400 — 450º C г идрид бария взаимодействует с азотом , образуя нитрид бария и водород:
2. Гидрид бария взаимодействует со сложными веществами :
2.1. При взаимодействии с водой гидрид бария образует гидроксид бария и газ водород:
2.2. Гидрид бария вступает в реакцию с кислотами :
2.2.1. С разбавленной хлороводородной кислотой гидрид бария реагирует с образованием хлорида бария и газа водорода:
2.3. Гидрид бария вступает во взаимодействие с солями :
2.3.1. В результате реакции между гидридом бария и хлоратом калия при 350 — 400º С образуется хлорид калия, оксид бария и вода:
3BaH2 + 2KClO3 = 2KCl + 3BaO + 3H2O
3. Гидрид бария разлагается при температуре выше 675º C, с образованием бария и водорода:
Источник
Реакция бария с водой
Реакция взаимодействия бария с водой.
Уравнение реакции взаимодействия бария с водой:
Реакция бария с водой протекает при обычных условиях.
В результате реакции бария с водой образуются гидроксид бария и водород .
Примечание: © Фото https://www.pexels.com, https://pixabay.com

Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 485)
- Экономика Второй индустриализации России (102 475)
- Программа искусственного интеллекта ЭЛИС (27 492)
- Метан, получение, свойства, химические реакции (23 734)
- Этилен (этен), получение, свойства, химические реакции (22 818)
- Природный газ, свойства, химический состав, добыча и применение (21 167)
- Крахмал, свойства, получение и применение (20 574)
- Целлюлоза, свойства, получение и применение (19 422)
- Пропилен (пропен), получение, свойства, химические реакции (19 105)
- Прямоугольный треугольник, свойства, признаки и формулы (18 729)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
Барий вода гидроксид бария водород уравнение реакции
Вопрос по химии:
Напишите уравнения реакций по следующим схемам:
Барий + вода = гидроксид бария + водород
Азот + кислород = оксид азота (III)
Гидроксид железа (III) = оксид железа (III) + вода
Нитрат алюминия + фосфат натрия = фосфат алюминия + нитрат натрия
Серная кислота + гидроксид натрия = сульфат натрия + вода
Ответы и объяснения 2
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Источник
Ba + H2O = ? уравнение реакции
Здесь есть кто-нибудь, кто хорошо разбирается в химии? Мне нужна помощь: взаимодействует ли барий с водой (Ba + H2O = ?) и, что при этом получается. Укажите основные физические и химические свойства полученного соединения. Заранее, большое спасибо!
В результате взаимодействия бария с водой (Ba + H2O = ?) происходит образование гидроксида бария и выделение газа водорода. Молекулярное уравнение реакции имеет вид:
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы барий и водород изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Гидроксид бария (едкий барит) представляет собой кристаллы белого цвета, которые плавятся без разложения, но при дальнейшем нагревании разлагаются. Хорошо растворяется в воде, образует сильнощелочной раствор. Проявляет основные свойства, реагирует с кислотами. Вступает в реакции обмена.
Помимо вышеуказанной реакции гидроксид бария получают путем растворения оксида бария в воде (1) или при горячей воды на сульфид бария (2):
Источник