- § 15. Ароматические углеводороды. Бензол
- Строение бензола
- Физические свойства бензола
- Химические свойства бензола
- Химические свойства аренов
- Химические свойства аренов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Хлорирование аренов
- 2. Реакции замещения
- 2.1. Галогенирование
- 2.2. Нитрование
- 2.3. Алкилирование ароматических углеводородов
- 2.4. Сульфирование ароматических углеводородов
- 3. Окисление аренов
- 3.1. Полное окисление – горение
- 3.2. О кисление гомологов бензола
- 4. Ориентирующее действие заместителей в бензольном кольце
- 5. Особенности свойств стирола
§ 15. Ароматические углеводороды. Бензол

Что вы знаете о бензоле?
Название «ароматические соединения» возникло давно, на ранних этапах развития органической химии. К ним относили соединения, получающиеся из природных смол, эфирных масел, бальзамов, обладающих приятным запахом. Впоследствии оказалось, что существует ещё много веществ, которые по строению и химическим свойствам схожи с ароматическими соединениями, но не имеют приятного запаха. Однако исторически сложившееся название так и осталось.
Большинство ароматических углеводородов опасны для жизни человека, они токсичны, и работа с ними требует строгого соблюдения мер безопасности. Так, бензол является ядовитым веществом, действует на почки, при длительном контакте изменяет формулу крови, может нарушать структуру хромосом. Бензол — типичный и простейший представитель ароматических углеводородов.
Строение бензола
Молекулярная формула бензола С6Н6. Очевидно, что это ненасыщенный углеводород — не хватает восьми атомов водорода до полного насыщения — С6Н14. Для ненасыщенных углеводородов характерно обесцвечивание раствора перманганата калия и бромной воды. Проверим это на опыте с бензолом.

Проблема. Почему бензол не обесцвечивает бромную воду и раствор КМnO4? Какие можно сделать предположения о строении бензола?
Опыт позволяет предположить, что бензол не образует прямую или разветвлённую цепь, в которой находятся двойные или тройные связи. Это же самое доказывает и реакция гидрирования бензола. Экспериментально также установлено, что молекула бензола (1 моль) присоединяет только три молекулы водорода (3 моль), в результате чего получается циклическое соединение — циклогексан:
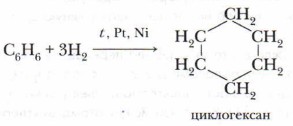
Из этого следует, что бензол — углеводород циклического строения.
Значительно позже русским учёным Н.Д. Зелинским была проведена обратная реакция — каталитическое дегидрирование циклогексана. В результате этой реакции был получен бензол:
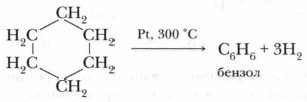
Немецкий химик Ф.А. Кекуле в 1865 г. высказал предположение о циклическом строении бензола с чередованием простых (одинарных) и двойных (кратных) связей и предложил выразить это структурной формулой следующим образом (1, 2):
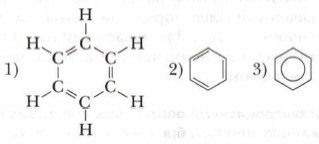
В современной химии наряду с традиционными формулами Кекуле часто пользуются структурной формулой бензола, в которой акцент сделан на бензольное кольцо (3).

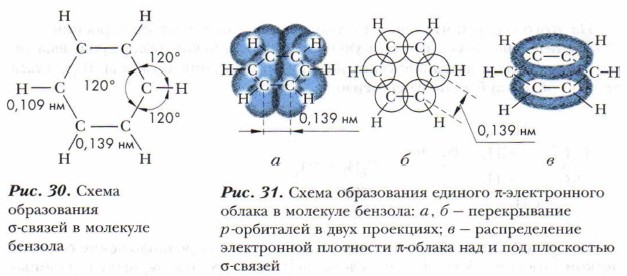
Все атомы углерода в молекуле бензола находятся в sh 2 -гибридном состоянии. Каждый атом углерода образует три σ-связи: с двумя соседними атомами углерода и одним атомом водорода. Эти связи лежат в одной плоскости, и углы между ними равны 120° (рис. 30). Таким образом, шесть атомов углерода образуют правильный шестиугольник. Кроме того, каждый атом углерода имеет одну негибридную 2p-орбиталь, на которой находится один электрон.
Негибридная р-электронная орбиталь каждого атома углерода перекрывается рядом находящимися негибридными р-электронными облаками слева и справа, образуется единое π-электронное облако, состоящее из шести электронов. Электронная плотность в нём распределена равномерно (рис. 31). Все связи между атомами углерода одинаковые. Перекрывание происходит над и под плоскостью σ-связей. С подобным явлением вы уже знакомились при изучении диеновых углеводородов, содержащих сопряжённые двойные связи (см. § 13).
Исследования показали, что в бензоле нет простых и двойных связей, под влиянием π-электронного облака ядра атомов углерода сближаются, и расстояние между центрами соседних атомов углерода сокращается и становится одинаковым — 0,139 нм. Вспомним, что длина одинарной связи С—С равна 0,154 нм, а двойной связи С=С — 0,134 нм.
В настоящее время используют следующие современные структурные формулы молекулы бензола:
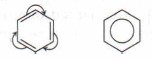
Чаще всего пользуются формулой в виде правильного шестиугольника с окружностью в цикле.
Электронное строение бензола объясняет загадки молекул бензола:
- благодаря сопряжению электронная плотность в бензольном кольце выравнивается, расстояния между атомами углерода одинаковые;
- благодаря сопряжению молекула бензола становится более устойчивой, связь между атомами углерода в бензольном кольце значительно прочнее;
- бензол стоек к действию окислителей, реакции присоединения затруднены.
Плоскость, в которой расположены атомы углерода, называется бензольным ядром или бензольным кольцом.
Бензольное ядро — это прочная система. Связь в бензольном ядре часто называют ароматической. Делокализованная π-связь (см. рис. 31, б, в) — главный признак принадлежности веществ к группе ароматических соединений. По международной номенклатуре ароматические углеводороды называются аренами.
Ароматические углеводороды, или арены, — это органические соединения, в молекулах которых имеется одно или несколько бензольных колец.
Общая формула углеводородов ряда бензола, имеющих одно бензольное кольцо, CnH2n-6.
Известны также небензоидные ароматические соединения, например гетероциклические.
Физические свойства бензола
Бензол — это легкокипящая (температура кипения 80,1 °С) бесцветная жидкость, не растворяется в воде. Имеет специфический запах. При охлаждении легко застывает и превращается в белую кристаллическую массу с температурой плавления 5,5 °С.
Химические свойства бензола
1. Реакция горения
Как все углеводороды, бензол сгорает с образованием углекислого газа и воды:
Бензол горит коптящим пламенем.
Задание. Вычислите массовую долю (%) углерода в бензоле.
2. Реакции замещения
Наличие π-электронного облака в бензольном кольце, а также его пространственная доступность создают предпосылки для протекания реакций замещения. Для аренов характерны реакции электрофильного замещения в бензольном кольце. Важнейшими из таких реакций являются: галогенирование и нитрование.
А. Галогенирование
Бензол при обычных условиях не обесцвечивает бромную воду, но при нагревании в присутствии железных стружек вступает в реакцию, при этом образуется тяжёлая жидкость бромбензол — СбН5Вr:
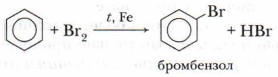
Б. Нитрование
При действии на бензол нитрующей смеси (концентрированные серная и азотная кислоты) и при нагревании происходит реакция замещения, нитрогруппа азотной кислоты — NO2 замещает атом водорода в молекуле бензола:

При этом образуется желтоватая тяжёлая жидкость, нерастворимая в воде, с запахом горького миндаля — нитробензол C6H5NO2 которая используется в качестве растворителя, а также для получения анилина.
3. Реакции присоединения
Проблема. Бензол с большим трудом вступает в реакции присоединения. Почему это происходит?
Реакции присоединения аренов связаны с разрушением устойчивой системы бензольного кольца. Они энергетически невыгодны и протекают только при нагревании или при облучении.
А. Галогенирование
Реакция присоединения хлора к бензолу идёт при УФ-облучении и температуре кипения бензола. При этом образуется гексахлорциклогексан:
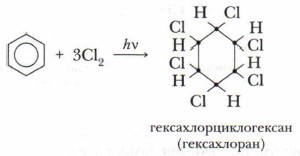
Гексахлорциклогексан — ядохимикат, который до недавнего времени использовался для защиты растений от насекомых, но он опасен для жизни человека, а потому заменён на более безопасные и легко разлагаемые пестициды.
Б. Гидрирование
Эта реакция идёт в присутствии катализаторов (Pt, Ni) и при нагревании:
Источник
Химические свойства аренов
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2 + : |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода |

5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Источник