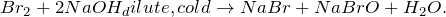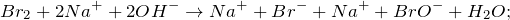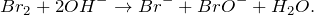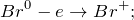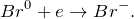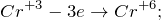Br2 + NaOH = ? уравнение реакции
Составьте химическое уравнение по схеме Br2 + NaOH = ? Охарактеризуйте химическое соединение бром: укажите основные физические и химические свойства, а также способы получения.
В результате взаимодействия брома с холодным разбавленным раствором гидроксида натрия (Br2 + NaOH = ?) происходит образование средних солей – бромида и гипобромита натрия, а также воды. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что простые вещества и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Данная реакция относится к окислительно-восстановительным, поскольку химический элемент бром изменяет свою степень окисления – одновременно повышает и понижает её (диспропорционирование). Схемы электронного баланса выглядят следующим образом:
Бром – галоген. Представляет собой тяжелую жидкость темно-красного цвета либо красно-коричневый газ. В жидком состоянии плохо растворяет воду. При насыщении охлажденной воды образуется твердый клатрат. При обычных условиях умеренно растворяется в воде и в небольшой степени подвергается дисмутации («бромная вода»); в присутствии бромидов и хлоридов щелочных металлов растворимость повышается, в присутствии сульфатов — понижается. Неограниченно смешивается с сероуглеродом, тетрахлоридом углерода. Реагирует со щелочами. Сильный окислитель. Образует соединения с другими галогенами.
Источник
Бромид натрия: способы получения и химические свойства
Бромид натрия — NaBr соль щелочного металла натрия и бромоводородной кислоты. Белое кристаллическое вещество. Плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 102,89; относительная плотность для тв. и ж. состояния d = 3,211; tпл = 755º C
Способ получения
1. Бромид натрия можно получить путем взаимодействия концентрированного и холодного гидроксида натрия и брома, образуются гипобромит натрия, бромид натрия и вода:
2NaOH + Br2 = NaBrO + NaBr + H2O,
при взаимодействии брома с концентрированным и горячим гидроксидом натрия образуется бромат натрия, бромид натрия и вода:
6NaOH + 3Br2 = NaBrO3 + 5NaBr + 3H2O
2. При температуре 150–200º C, в результате взаимодействия натрия и брома, образуется бромид натрия:
2Na + Br2 = 2NaBr
3. Холодный йодид натрия реагирует с бромом . При этом образуются бромид натрия и осадок йод:
2NaI + Br2 = 2NaBr + I2↓
Качественная реакция
Качественная реакция на бромид натрия — взаимодействие с нитратом серебра, в результате реакции происходит образование осадка бледно — желтого цвета:
1. При взаимодействии с нитратом серебра , бромид натрия образует нитрат натрия и осадок бромид серебра:
NaBr + AgNO3 = NaNO3 + AgBr↓
Химические свойства
1. Бромид натрия вступает в реакцию с простыми веществами :
1.1. Горячий бромид натрия взаимодействует с хлором. В результате реакции происходит образование хлорида натрия и газа брома:
2NaBr + Cl2 = 2NaCl + Br2↑
2. Бромид натрия способен вступать в реакцию со сложными веществами :
2.1. Бромид натрия реагирует с кислотами :
2.1.1. Твердый бромид натрия реагирует с холодной серной кислотой с концен трацией 10–50% . Взаимодействие данных веществ приводит к образованию сульфата натрия и бромоводородной кислоты:
Если концентрацию горячей серной кислоты поднять выше 50 %, то в результате реакции образуется гидросульфат натрия, бром, оксид серы (IV) и вода:
Источник
Бромид натрия: способы получения и химические свойства
Бромид натрия — NaBr соль щелочного металла натрия и бромоводородной кислоты. Белое кристаллическое вещество. Плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 102,89; относительная плотность для тв. и ж. состояния d = 3,211; tпл = 755º C
Способ получения
1. Бромид натрия можно получить путем взаимодействия концентрированного и холодного гидроксида натрия и брома, образуются гипобромит натрия, бромид натрия и вода:
2NaOH + Br2 = NaBrO + NaBr + H2O,
при взаимодействии брома с концентрированным и горячим гидроксидом натрия образуется бромат натрия, бромид натрия и вода:
6NaOH + 3Br2 = NaBrO3 + 5NaBr + 3H2O
2. При температуре 150–200º C, в результате взаимодействия натрия и брома, образуется бромид натрия:
2Na + Br2 = 2NaBr
3. Холодный йодид натрия реагирует с бромом . При этом образуются бромид натрия и осадок йод:
2NaI + Br2 = 2NaBr + I2↓
Качественная реакция
Качественная реакция на бромид натрия — взаимодействие с нитратом серебра, в результате реакции происходит образование осадка бледно — желтого цвета:
1. При взаимодействии с нитратом серебра , бромид натрия образует нитрат натрия и осадок бромид серебра:
NaBr + AgNO3 = NaNO3 + AgBr↓
Химические свойства
1. Бромид натрия вступает в реакцию с простыми веществами :
1.1. Горячий бромид натрия взаимодействует с хлором. В результате реакции происходит образование хлорида натрия и газа брома:
2NaBr + Cl2 = 2NaCl + Br2↑
2. Бромид натрия способен вступать в реакцию со сложными веществами :
2.1. Бромид натрия реагирует с кислотами :
2.1.1. Твердый бромид натрия реагирует с холодной серной кислотой с концен трацией 10–50% . Взаимодействие данных веществ приводит к образованию сульфата натрия и бромоводородной кислоты:
Если концентрацию горячей серной кислоты поднять выше 50 %, то в результате реакции образуется гидросульфат натрия, бром, оксид серы (IV) и вода:
Источник
NaCrO2 + Br2 + NaOH = ? уравнение реакции
Составьте химическое уравнение по схеме NaCrO2 + Br2 + NaOH = ? Относится ли данная реакция к ОВР? Дайте определение окислительно-восстановительным реакциям. В случае положительного ответа на поставленный вопрос укажите окислитель и восстановитель.
В результате взаимодействия хромита натрия с бромом в щелочной среде, создаваемой гидроксидом натрия (NaCrO2 + Br2 + NaOH = ?) происходит образование средних солей – хромата и бромида натрия, а также воды. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что вода и простые вещества на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы хром и бром изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Окисление – это отдача электронов веществом, т.е. повышение степени окисление элемента. Вещества, отдающие свои электроны в процессе реакции, называются восстановителями (в данном случае это хромит натрия).
Восстановление – это смещение электронов к веществу или понижение степени окисления элемента. Вещества, принимающее электроны, называется окислителем (в данном случае это бром).
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |