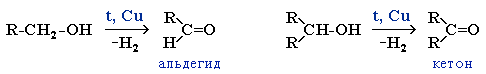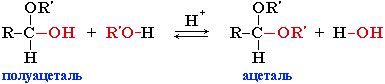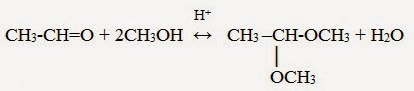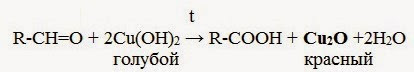- Физические и химические свойства альдегидов и кетонов
- Физические свойства
- Химические свойства альдегидов и кетонов
- Химические свойства альдегидов и кетонов
- 1.1. Гидрирование
- 1.2. Присоединение воды
- 1.3. Присоединение спиртов
- 1.4. Присоединение циановодородной (синильной) кислоты
- 2. Окисление альдегидов и кетонов
- 2.1. Окисление гидроксидом меди (II)
- 2.2. Окисление аммиачным раствором оксида серебра
- 2.3. Жесткое окисление
- 2.4. Горение карбонильных соединений
- 3. Замещение водорода у атома углерода, соседнего с карбонильной группой
- 4. Конденсация с фенолами
- 5. Полимеризация альдегидов
Физические и химические свойства альдегидов и кетонов
Физические свойства
В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) — газ, альдегиды С2–C5 и кетоны С3–С4 — жидкости, высшие — твердые вещества.
Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Для карбонильных соединений характерны реакции различных типов:
· присоединение по карбонильной группе;
· восстановление и окисление.
Большинство реакций альдегидов и кетонов протекает по механизму нуклеофильного присоединения (AN) по связи С=О.
Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
Это объясняется, главным образом, двумя факторами:
· углеводородные радикалы у группы С=О увеличивают пространственные препятствия присоединению к карбонильному атому углерода новых атомов или атомных групп;
· углеводородные радикалы за счет +I-эффекта уменьшают положительный заряд на карбонильном атоме углерода, что затрудняет присоединение нуклеофильного реагента.
1. Присоединение водорода (восстановление):
2. Присоединение циановодородной кислоты (синильной):
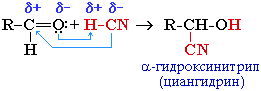
Эта реакция используется для удлинения углеродной цепи, а также для получения α-гидроксикислот R-CH(COOH)OH по схеме:
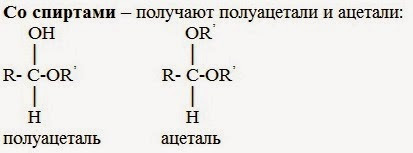
3. Со спиртами – получают полуацетали и ацетали:
Полуацетали — соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
Ацетали — соединения, в которых атом углерода связан с двумя алкоксильными
5. Присоединение реактива Гриньяра (используется для получения первичных спиртов, кроме метанола):
Здесь R – алкильный или арильный радикал; Х – это галоген.
6. Взаимодействие с аммиаком
II . Реакции окисления
1. Реакция серебряного зеркала – качественная реакция на альдегидную группу:
III . Реакции замещения
здесь , ClCH2-CH=O — хлоруксусный альдегид
IV . Реакции полимеризации
V . Реакции поликонденсации
Источник
Химические свойства альдегидов и кетонов
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
| Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. |
Структурная формула альдегидов:
| Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами . |
Структурная формула кетонов:
Химические свойства альдегидов и кетонов
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
1.1. Гидрирование
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
1.3. Присоединение спиртов
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.
| Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. |
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении альдегиды превращаются в карбоновые кислоты. Альдегид → карбоновая кислота
|