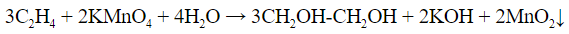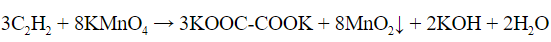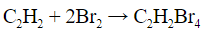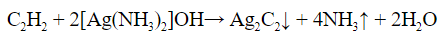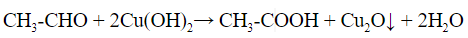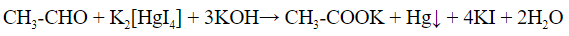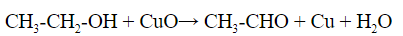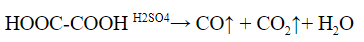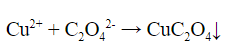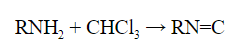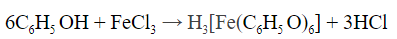- Качественные реакции в органической химии
- Качественные реакции на алканы
- Качественные реакции на алкены
- Качественные реакции на алкины
- Качественные реакции на альдегиды
- Качественные реакции на спирты
- Качественные реакции на карбоновые кислоты
- Качественные реакции на амины
- Качественные реакции на анилин
- Качественные реакции на фенол
- Качественные реакции на алкилхлориды
- Качественные реакции на углеводы
- Качественные реакции на белки
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Качественные реакции органической химии
- 4.1.5. Качественные реакции органических соединений.
Качественные реакции в органической химии
Качественные реакции в органической химии используются для быстрого распознавания класса соединения. Для таких реакций характерно проявление внешних эффектов — изменение цвета раствора, выпадение осадка или выделение газа.
Качественные реакции на алканы
- При горении алканов пламя становится голубым.
- Реакция окисления алканов перманганатом калия на холоде не идет – раствор не меняет цвет.
Качественные реакции на алкены
- Реакция Вагнера – обесцвечивание раствора перманганата калия, сопровождается выпадением темно-коричневого осадка диоксида марганца:
- Обесцвечивание бромной воды:
Качественные реакции на алкины
- Реакция Вагнера – раствор перманганата калия обесцвечивается и выпадает осадок черного цвета (диоксид магния):
- Обесцвечивание бромной воды:
- С реактивом Толленса (гидроксид диамин серебра) только алкины с крайними тройными связями образуют осадок ацетиленида серебра. Алкины с другим расположением тройной связи в реакцию не вступают:
Качественные реакции на альдегиды
- Реакция серебряного зеркала с реактивом Толленса при нагревании — серебро покрывает зеркальным слоем стенки пробирки. При некачественном проведении эксперимента выпадает черный осадок мелкодисперсного серебра:
- Со свежеприготовленным гидроксидом меди при нагревании альдегиды образуют красно-оранжевый осадок оксида меди (I):
- С реактивом Несслера (щелочной раствор тетраиодомеркурата (II) калия) образуется осадок металлической ртути черного цвета:
- При взаимодействии бесцветных альдегидов с раствором бесцветной фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
Качественные реакции на спирты
Спирты делят на одно- и многоатомные (по количеству ОН-групп) и определяют с помощью разных качественных реакций.
1. Для одноатомных спиртов
1.1 С оксидом меди (II) — над раскаленным оксидом пропускают пары спирта, образуется альдегид, который выявляют пробой с фуксинсернистой кислотой – раствор окрашивается в характерный бледно-фиолетовый цвет:
1.2 Йодоформная проба – с йодом и гидроксидом натрия образуется йодоформ, осадок желтого цвета:
1.3. Проба Лукаса для выявления вторичных и третичных спиртов – первичные в реакцию не вступают. При взаимодействии одноатомных спиртов с концентрированным раствором соляной кислоты и хлорида цинка раствор расслаивается и образуется мутный маслянистый слой алкилхлорида:
2. Для многоатомных спиртов на примере глицерина
Голубой осадок гидроксида меди (II) при нормальных условиях растворяется в глицерине с образованием комплексного соединения меди ярко-синего цвета:
Качественные реакции на карбоновые кислоты
1. Фиолетовый раствор лакмуса карбоновые кислоты окрашивают в красный цвет.
2. Разложение под действием серной кислоты на угарный газ и воду. Выделяющийся угарный газ можно поджечь – он горит синим пламенем.
Для муравьиной кислоты:
Аналогично разлагается и многоосновная щавелевая кислота:
3. Реакция щавелевой кислоты с солями меди (II) – выпадает зелено-голубой кристаллический осадок оксалата меди:
Качественные реакции на амины
- Фиолетовый раствор лакмуса амины окрашивают в синий цвет.
- Образование дыма в результате взаимодействия летучих аминов с газообразным хлороводородом.
- Первичные амины с хлороформом в щелочной среде образуют соединения – изонитрилы с характерным неприятным запахом:
Качественные реакции на анилин
- При действии хлорной извести водный раствор анилина приобретает интенсивный фиолетовый цвет.
- При бромировании образуется белый осадок 2,4,6-триброманилина:
Качественные реакции на фенол
- При взаимодействии с хлоридом железа (III) раствор приобретает фиолетовый цвет:
- С бромной водой образует твердый белый осадок 2,4,6-трибромфенола:
- При поликонденсации фенолов с альдегидами в кислой или щелочной среде образуются смолообразные полимеры и вода.
Качественные реакции на алкилхлориды
Проба Бейльштейна – качественная реакция определения хлора в органических соединениях.
Образец алкилхлорида на прокаленной медной проволоке помещают в пламя горелки, которое становится сине-зеленым.
Качественные реакции на углеводы
Углевод содержат альдегидные и гидрокси- группы — характерными будут реакции на спирты и альдегиды.
1. Крахмалсодержащие растворы под действием йода становятся синими.
- при нагревании раствор обесцвечивается;
- охлажденный – восстанавливает синий цвет.
2. Проба Селиванова определяет наличие фруктозы. В присутствии резорцина и соляной кислоты углевод приобретает красно-вишневый цвет.
Качественные реакции на белки
Цветные реакции позволяют выявить наличие белков в растворах.
- Ксанторотеиновая или Мульдера реакция выявляет в белке наличие аминокислот ароматического ряда (триптофана, тирозина и фенилаланина). Раствор обрабатывается концентрированной азотной кислотой – он окрашивается в желтый цвет; после добавления щелочи цвет изменяется на оранжевый.
- Реакция Фоля указывает на наличие аминокислот, содержащих слабосвязанную серу (цистина и цистеина). При кипячении белка со щелочью сера в виде сульфида свинца дает осадок бурого или черного цвета.
- Горение белка сопровождается запахом паленой шерсти. Качественные реакции в органической химии помогают с минимальными затратами определить, к какому классу соединений относится вещество.
Источник
Химия, Биология, подготовка к ГИА и ЕГЭ
Качественные реакции органической химии
В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны.
Это означает, что качественные реакции — это реакции с ощутимым эффектом -цвет, запах, изменение состояния вещества. «Селективность» — означает, что желательно, чтобы такая реакция на данный класс веществ или на данное вещество была уникальна. Высокая чувствительность — даже очень небольшое количество вещества должно проявляться в такой реакции.
С уникальностью в органической химии немного проблематично, но тем не менее, есть достаточно много реакций для определения того или иного вещества .
Итак, классы органических соединений и соответствующие им качественные реакции:
| Класс органических соединений | Качественные реакции |
| Алканы | У алканов нет качественных реакций. Их определяют методом исключения |
| Алкены | 1. Обесцвечивание бромной воды: 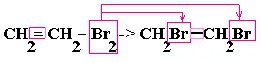 2. Изменение окраски раствора 2. Изменение окраски раствора 3СH2=CH2 + 2 KMnO4 + 4H2O → 3C2H4(OH)2 + 2 MnO2 + 2KOH |
| Циклоалканы | Обесцвечивание бромной воды: 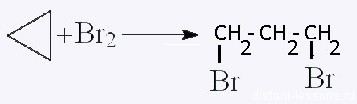 |
| Алкины | 1. Обесцвечивание бромной воды, 2. Образование ацетиленидов серебра и меди:  3. Изменение окраски перманганата калия: (KMnO4 → MnO2) C2H2 → HOOC-COOH |
| Алкадиены | Т.к. алкадиены содержат 2 двойные связи, то они так же как и алкены, обесцвечивают бромную воду |
| Арены | 1. Взаимодействие с бромом (в присутствии катализатора) 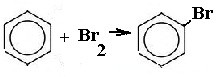
|
| Спирты | Реакция с оксидом меди — в осадок выпадает медь: 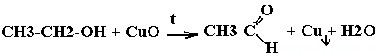 |
| Многоатомные спирты | С гидрокисдом меди (II) — Cu(OH)2 образуется комплекс синего цвета |
| Альдегиды | Реакция «серебряного зеркала» и реакция «медного зеркала»: 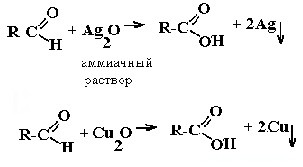 |
| Кислоты органические | Дают окрашенные соли тяжелых металлов — см. таблицу растворимости |
| Амины | Качественных реакций нет (только анилин — имеет характерный запах) |
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам.
Источник
4.1.5. Качественные реакции органических соединений.
| Соединение, функциональная группа | Реагент | Что наблюдается, уравнение реакции |
| Фенол | Бромная вода | |
| Светло-желтая окраска разбавленного раствора соли трехвалентного железа сменяется на фиолетовую | ||
| Анилин | Бромная вода | |
| Многоатомные спирты | Свежеосажденный Cu(OH)2 (II) | |
| Лакмус | Окрашивание лакмуса в красный цвет | |
| Карбонаты, например, K2CO3 | Любая сильная неорганическая кислота или кислота средней силы H2SO4 (разб.) HCl HI HBr HNO3 (разб.) H3PO4 |