KMnO4 + HBr = ? уравнение реакции
Закончите уравнение реакции KMnO4 + HBr = ? Укажите основные физические и химические свойства продукта реакции, являющегося простым веществом. Приведите способы получения этого соединения.
В результате взаимодействия перманганата калия с бромоводородом (KMnO4 + HBr = ?) происходит образование бромидов калия и марганца (II), воды и выделение свободного брома. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что простые вещества и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
В обычных условиях бром – красно-коричневая жидкость, малорастворимая в воде. При охлаждении водного раствора брома выделяются кристаллогидраты кларатного типа 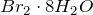
Подобно хлору бром находится в природе преимущественно в виде солей калия, натрия и магния. Бромиды металлов содержатся в морской воде, в некоторых озерах и подземных рассолах.
Бром – галоген. В жидком состоянии плохо растворяет воду. При обычных условиях умеренно растворяется в воде и в небольшой степени подвергается дисмутации («бромная вода»); в присутствии бромидов и хлоридов щелочных металлов растворимость повышается, в присутствии сульфатов — понижается. Неограниченно смешивается с сероуглеродом, тетрахлоридом углерода. Реагирует со щелочами. Сильный окислитель. Образует соединения с другими галогенами.
Источник
Бромоводород перманганат калия вода
Для выполнения задания используйте следующий перечень веществ: перманганат калия, бромоводород, гидрокарбонат калия, сульфат натрия, нитрат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: перманганат калия, бромоводород, гидрокарбонат калия, сульфат натрия, нитрат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Для начала запишем молекулярные формулы данных веществ:
Условия реакций ионного обмена (РИО):
1) Растворимость реагирующих веществ:
Кислота + Основание. Растворим хотя бы 1 из реагентов
Кислота + Соль. Обязательно растворима должна быть кислота
Основание + Соль. Растворимы оба реагента
Соль + Соль. Должны быть обе растворимы
2) В ходе реакции должны образоваться осадок, газ или вода.
Перманганат калия, гидрокарбонат калия и нитрат калия — соли, не взаимодействующие между собой, так как имеют одинаковый катион калия. Не взаимодействуют с сульфатом натрия, так как образуются растворимые соединения. Остается рассмотреть лишь их взаимодействие с бромоводородом.
При реакции перманганата (нитрата) калия с бромоводородом образуются растворимые бромид калия и марганцовая (азотная) кислота, т. е. такая реакция не пойдет. Остается единственный правильный вариант: взаимодействие гидрокарбоната калия с бромоводородом.
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |








