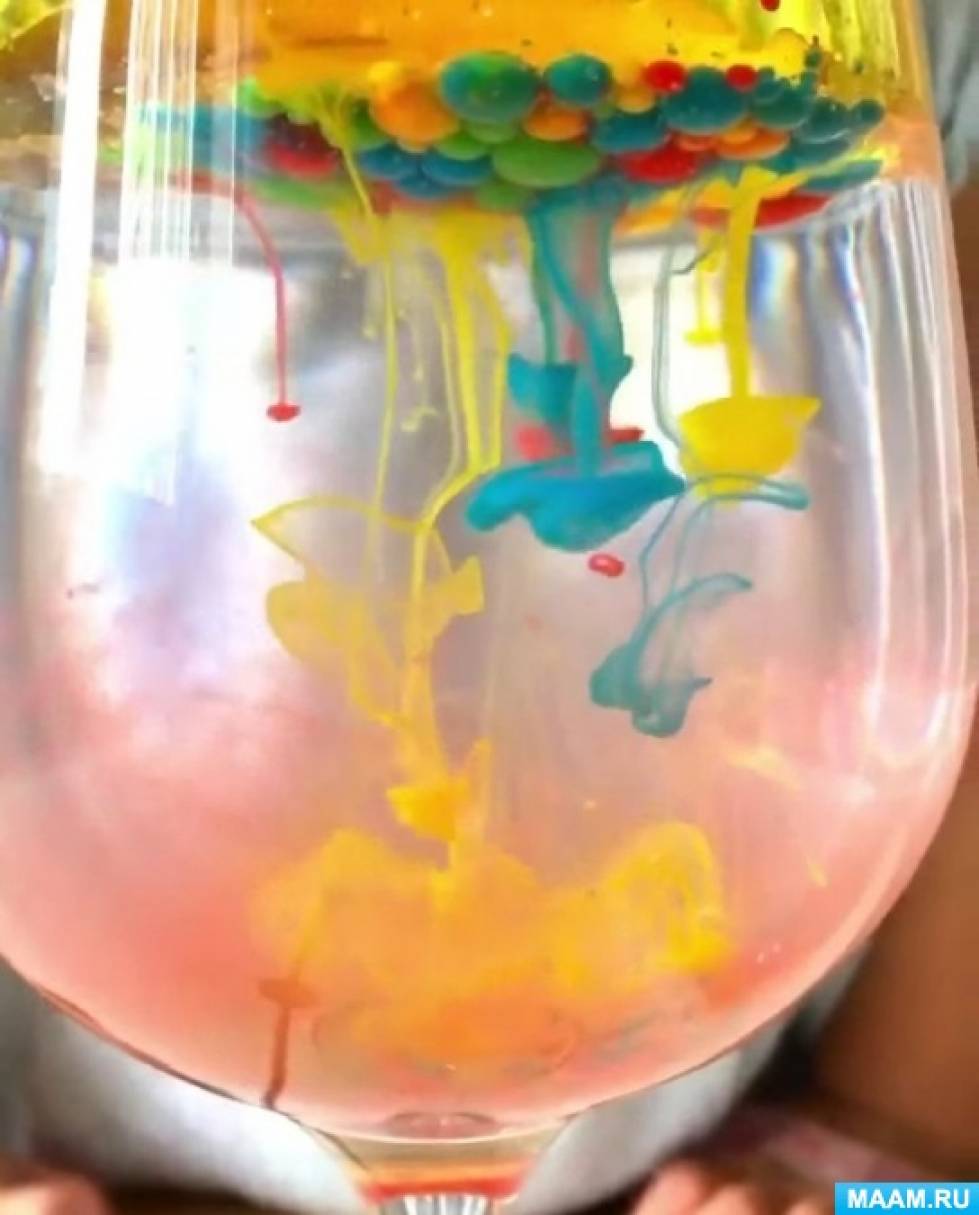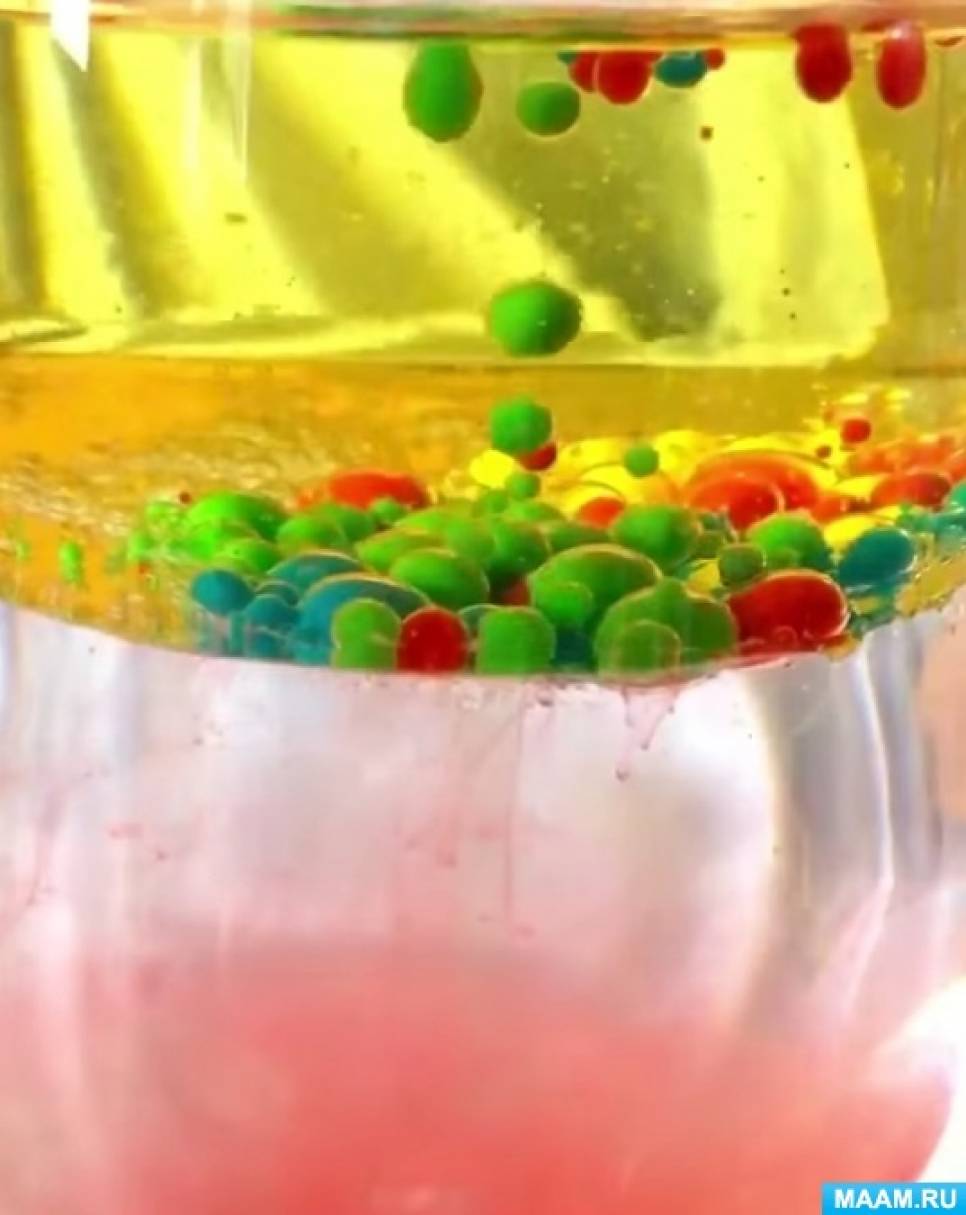Занимательный опыт с водой и растительным маслом
Дементьева Евгения
Занимательный опыт с водой и растительным маслом
ВОЛШЕБНАЯ ЖИДКОСТЬ.
Это отличный опыт, который непременно, порадует ваших детей. Умение видеть чудо в обыденных предметах отличает гения от других людей. Формируется творческое начало в раннем детстве, когда малыш пытливо изучает окружающий мир. Научные эксперименты, в том числе опыты с водой, — легкий способ заинтересовать ребенка естественными науками.
Чем хороша вода для опытов:
Вода — это идеальное вещество для знакомства с физическими свойствами предметов.
Преимуществами привычной нам субстанции являются:
— доступность и дешевизна;
— способность пребывать в трех состояниях:
— твердом, парообразном и жидком;
— способность легко растворять различные вещества;
— прозрачность воды обеспечивает наглядность опыта:
— малыш сможет сам объяснить результат исследования;
— безопасность и нетоксичность веществ, необходимых для экспериментов:
— ребенок может потрогать руками все, что его заинтересует;
— не нужно дополнительных инструментов и оборудования, специальных навыков и знаний;
— можно проводить исследования как дома, так и в детском саду.
Цель: совершенствование представления детей о разнообразных свойствах воды, познакомить со свойствами масла,
развивать наблюдательность, способность сравнивать, сопоставлять, делать выводы, развивать любознательность детей, поддерживать проявления самостоятельности в познании окружающего мира.
Всё что необходимо:
— краски смешанные с водой;
ОБЪЯСНЕНИЕ.
1. Вода и растительное масло не смешиваются друг с другом.

2. Вода плотнее и тяжелее, чем масло.
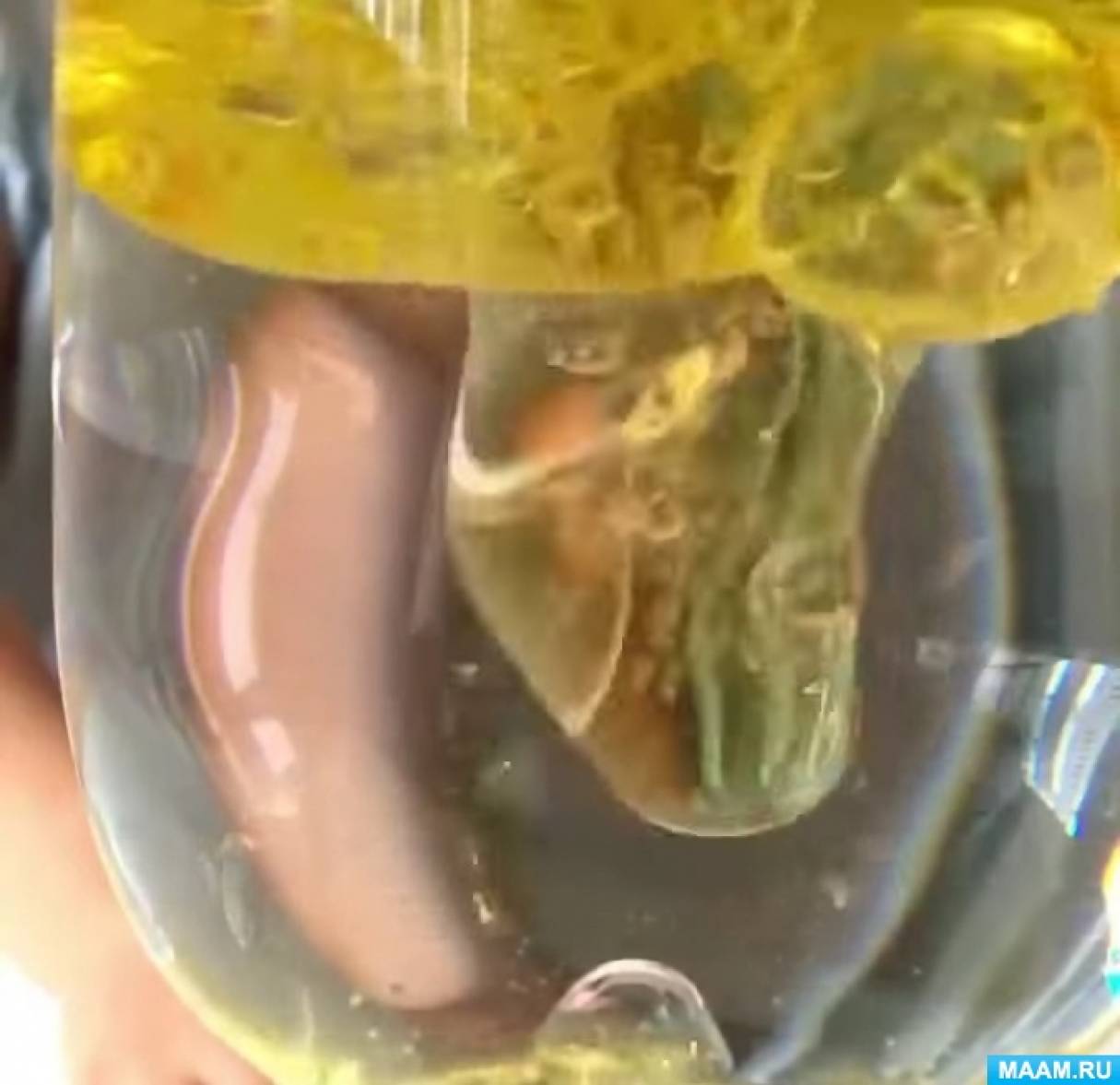
3. Краска, так как смешана с водой, попадая в масло, превращается в шарик.


4. Шарик с краской проходит через масло и, попадает в свою водную среду и смешивается с ней.


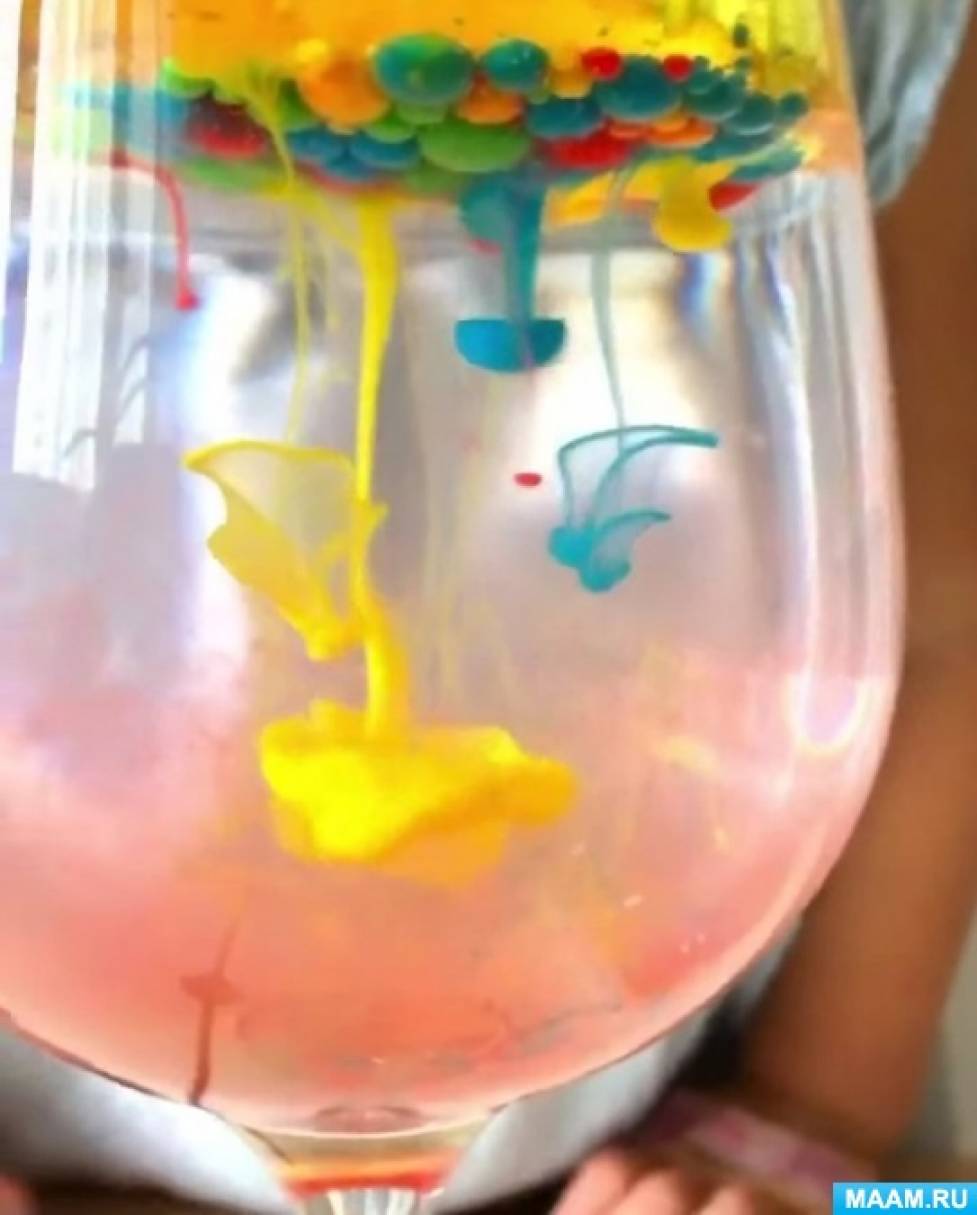



Опыт работы в дистанционном формате «Занимательный детский сад» ДИСТАНЦИОННЫЙ «ЗАНИМАТЕЛЬНЫЙ ДЕТСКИЙ САД» в ГУСЬ-ХРУСТАЛЬНОМ В период самоизоляции педагогам ДОУ в целях обеспечения психолого-педагогической.

Информационный проект «Занимательный материал для дошкольников по математике (1 часть)» Информационный проект «Занимательный материал для дошкольников по математике» (1 часть) Проект направлен на формирование у детей интереса.
Конспект занятия «Занимательный счет» в подготовительной группе Цель: развитие математических способностей воспитанников, логического мышления. Материалы: наборы цифр, карточки с цифрами от 1 до 20, счетные.
Источник
Масло и вода все-таки смешиваются
О том, что вода и масло не смешиваются, знает каждый школьник. Необходима встряска, чтобы преодолеть силы, удерживающие масло вместе. Теперь, возможно, придется переписать учебники. Если сначала удалить всякие газы, растворенные в воде, то масло будет смешиваться с водой без посторонней помощи, утверждает химик Рик Пэшли из Австралийского Национального университета в Канберре.
И хотя многим ученым поверить в это нелегко, Пэшли предоставил самые весомые доказательства. Почему так происходит – непонятно. Химики с нетерпением ждут результатов повторения эксперимента — это поможет разрешить одну из самых сложных загадок химии. Речь идет о так называемой гидрофобной силе дальнего действия, которая заставляет капли масла притягивать друг друга даже на больших расстояниях. Эта сила препятствует рассеиванию нефти в воде, и приводит к тому, что создать водяную эмульсию масла можно только можно только путем встряски и добавления стабилизирующих веществ — как, например, в соусах. И хотя измерить эту силу химикам удавалось бесчисленное множество раз, никто не мог объяснить, как она действует.
Пэшли изучал, как ведут себя капли маслоподобных гидрофобных веществ при разрывании на части, особое внимание обращая на микроскопические полости, появляющиеся на их поверхности. Вода, которая контактировала с воздухом, содержит некоторое количество растворенного газа, и Пэшли предположил, что полости как раз и содержат пузырьки газа, которые «отнимаются» у воды, возможно, все той же гидрофобной силой дальнего действия. Чтобы проверить это предположение, Пэшли удалил из смеси воды и масла весь газ, многократно подвергнув ее замораживанию и оттаиванию с одновременным выкачиванием испаряющегося газа. Полученный результат превзошел все ожидания. «Моему взору предстала спонтанно образовавшаяся эмульсия», рассказал исследователь. Это позволяет считать, что растворенный в воде газ оказывается сопричастен действию гидрофобной силы.
Еще более интересно, что эмульсия не разлагалась, даже если в воду после ее образования вновь закачивался газ. Пэшли предположил, что газ может взаимодействовать с гидрофобной силой наиболее эффективно, только когда капли масла находятся очень близко друг к другу, как бывает в начале процесса образования эмульсии. Когда же смесь уже создана, гидроксильные группы воды, возможно, прикрепляются к поверхности капель масла, делая их одинаково заряженными и мешая им сблизиться друг с другом. Создание подобных эмульсий может иметь большое значение для медицины и химической промышленности.
Источник
Х и м и я
Коллоидная химия
Взаимодействие «воды» и «масла».
Бытовые примеры
Силы межатомного притяжения. Ковалентная связь.
Полярные и неполярные ковалентные связи.
Неполярные ковалентные связи
Полярные ковалентные связи.
Молекулы дифильных веществ
Межмолекулярные силы. Силы Вандер Ваальса.
Ориентационные силы. Вода — полярный растворитель.
Дисперсионные силы. Масла – неполярные растворители.
Расслоение воды и масла.
Гидрофобность и гидрофильность.
Дифильность.
Поверхностно-активные вещества.
Взаимодействие жидкости и твёрдых поверхностей. Смачивание.
Бытовые примеры
В обычной бытовой жизни каждый из нас мог быть свидетелем некоторой «антипатии» между водой и маслянистыми жидкостями.
Например, каждый знает, как трудно отмыть жирные руки водой. Без использования мыла это сделать почти невозможно.
Известный факт: если в одной ёмкости смешать воду и масло, то через некоторое время произойдёт их расслоение. Вода, как более тяжёлая жидкость, соберётся в нижней части сосуда, а над ней появится плёнка масла.
Покрытые жиром перья птиц так хорошо отталкивают воду, что даже если птица полностью погрузиться в неё, то вынырнув, ей достаточно будет встряхнуться, чтобы вновь оказаться сухой.
Капли росы на листьях растений – ещё один пример взаимного отталкивания воды и жирной поверхности.
Листья растений покрыты тонкой плёнкой выделяемого ими воска. А воск – жироподобное вещество. Также как и масло, воск не смачивается водой.
Все растворители в химии делят на:
- неорганические (вода, растворы неорганических кислот и их солей) и
- органические (имеющие жирную природу).
А растворяемые вещества делят на:
Таким образом, мы имеем дело с системным отличием в свойствах двух больших классов соединений, как растворителей, так и растворимых веществ.
Разберёмся, с чем объясняются эти отличия.
Силы межатомного притяжения. Ковалентная связь.
Забегая вперёд, сразу скажем, что причина антипатии воды и масла кроется в принципиально разных силах, действующих между образующими их молекулами.
Но прежде, чем рассматривать межмолекулярные силы, необходимо рассмотреть силы межатомного притяжения. Именно они приводят к возникновению молекул и ответственны за различия межмолекулярных сил.
Сделаем это на примере водорода.
Водород – простейший атом. Он состоит из ядра (протона) и одного электрона, совершающего вращательное движение вокруг ядра.
Как известно, устойчивая молекула может возникнуть только при условии, что её потенциальная энергия меньше, чем суммарная потенциальная энергия образующих её атомов.
Английскому физику Ф. Лондону и работавшему в Англии немецкому физику В. Гейтлеру удалось получить уравнение, позволяющее найти зависимость потенциальной энергии Е системы, состоящей из двух атомов водорода, от растояния r между ядрами этих атомов. (Позднее их расчёты были подтверждены экспериментально.)
При этом оказалось, что результаты расчёта зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов.
При совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы. В этом случае для сближения атомов требуется затрата энергии, так что такой процесс оказывается энергетически не выгодным и химическая связь между атомами не возникает.
При противоположно направленных спинах сближение атомов до некоторого расстояния r0 сопровождается уменьшением энергии системы. При r = r0 обладает наименьшей потенциальной энергией, т.е. находится в наиболее устойчивом состоянии. Дальнейшее сближение атомов вновь приводит к увеличению энергии.
Говоря другими словами, если попытаться сблизить атомы водорода на растояние, меньшее, чем r0, то между ними возникнет сила отталкивания, а если увеличивать расстояние между ними r > r0, то возникнет сила притяжения, пытающаяся вернуть систему в состояние r = r0.
Но это и означает, что в случае противоположно направленных спинов атомных электронов образуется молекула Н2 – устойчивая система из двух атомов водорода, находящихся на определённом расстоянии друг от друга.
Образование химической связи между атомами водорода является результатом взаимопроникновения («перекрывания») электронных облаков, происходящего при сближении взаимодействующих атомов.
Вследствии такого взаимопроникновения плотность отрицательного электрического заряда в межъядерном пространстве возрастает. Положительно заряженные ядра атомов притягиваются к области перекрывания электронных облаков, что приводит к образованию устойчивой молекулы.
Химическая связь в молекуле водорода осуществляется путём образования пары электронов с противоположно направленными спинами, принадлежащей обоим атомам.
Такая двухэлектронная двухцентровая связь называется ковалентной.
Полярные и неполярные ковалентные связи.
Неполярная ковалентная связь
В случае большинства химических веществ, связь между атомами внутри молекул обеспечивается именно ковалентными связями. Но характер этой связи может отличаться.
Если двухатомная молекула состоит из атомов одного элемента, как, например, молекулы Н2, N2, Cl2, и т.д., то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно ядер обоих атомов.
В подобном случае ковалентная связь называется неполярной.
Полярная ковалентная связь
Если же молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает ассиметрия в распределении заряда.
В таких случаях ковалентная связь назывется полярной.
Электроотрицательность химических элементов
Для оценки способности атома данного элемента оттягивать к себе общую электронную пару пользуются величиной относительной электроотрицательности.
Чем большее количество протонов содержит ядро атома элемента и чем меньше его радиус, тем выше будет его электротрицательность.
Понятно, что чем больше расстояние между ядром атома и его внешним электронным уровнем, тем меньше будет сила притяжения между ними и меньше будет поляризующий эффект.
Причём, если рассмотреть последовательность расположения элементов в периодической системе, то выяснится, что большее влияние на величину электроотрицательности будет оказывать, как раз увеличение радиуса элемента, а не массивность его ядра.
Наиболее электроотрицательные атомы окажутся в верхнем правом углу таблицы Менделеева, а наименее электроотрицательные – в нижнем левом углу.
В направлении, заданном этой диагональю (от Фтора F к Францию Fr) электроотрицательность элементов будет закономерно убывать.
Вот значения относительной элетроотрицательности некоторых элементов:
Относительная электроотрицательность атомов
Источник