Что делает мыло с водой
Что такое мыло? Как, за счёт чего оно работает?
Наверное, многие задавались таким вопросом, особенно в юном возрасте, когда интересно, как устроена Вселенная.
К сожалению, немногие утрудили себя найти ответ.
Вот же оно, мыло, мылит, чистит… Более важных дел что ли нет.
Тем, кому некогда отвлекаться на такие мелочи, эта статья посвещается.
Мыло – это соль жирных кислот. Понятно? Не всем?
Химию последний раз в школе проходили, и было это давным давно?
Ну что ж, остановлюсь на этом подробнее. Жирные кислоты это… Органические кислоты, получаемые при распаде жиров. Потому так и названы. Кислоты слабые, не сравнить с серной или соляной , которые использовали на лабораторных в школе, бояться этого слова не нужно, как и бояться пролить их на ладонь. Но тем не менее – кислоты. Причём многие из них настолько «тяжёлые», то есть имеют настолько большую углеводородную цепь, что вообще… Твёрдые. Почти. Как сало. Или воск. Вот такие они, эти кислоты.
Соединяясь с глицерином , они и образуют то, что мы называем жиром. То есть жир, любой, это соединение глицерина и жирных кислот. А различаются жиры между собой лишь составом оных кислот.
Чем углеводородные цепочки в них длиннее, тем жиры «твёрже». Чем короче – тем «мягче».
А растительное масло вообще продукт кислот, в углеводородной цепи которых есть двойная связь.
Кстати, на этом основано производство маргарина – разрывая связь и присоединяя к молекулам вместо неё водород, химики из жидкого растительного масла получают твёрдую субстанцию, очень похожую на масло, пахнущую, как масло…
Но маслом не являющуюся.
Но о маргарине – потом. Сейчас о мыле. Что это, как его получают на заводе и как можно получить его самому, для себя, в домашних условиях?
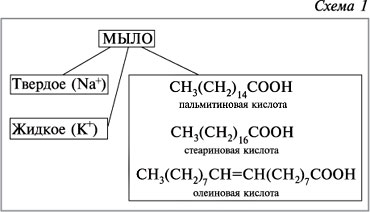
Итак, мыло – соли жирных кислот и щелочных металлов. Образованные металлом нарием – твёрдое мыло, калием – жидкое. В воде ионы калия и натрия «откалываются» от исходной молекулы, переходят в раствор, оставляя ион кислотного остатка с самим собой.
Тот бы рад раствориться вслед за ионом металла… Но к сожалению, его углеводородная цепь уж слишком большая и тяжёлая.
Не может раствориться «жирная» часть молекулы, так и плавая в воде среди нерастворённых собратьев.
Эту, «жирную» часть молекулы называют гидрофобной, она стремится оттолкнуть от себя воду. Ионизированную часть, которая была связана со щелочным металлом, называют гидрофильной – ибо она как раз к воде тянется, стремясь раствориться во что бы то ни стало. И поскольку этих частичек много, миллионы, миллиарды, они своей массой «обтекают» частички воды, образуя на её поверхности как бы плёнку. То есть, гидрофильные части молекул массово «ломятся» внутрь капельки (или толщи) воды, ориентированы внутрь неё, а гидрофобные части не дают им раствориться и задерживаются на поверхности, превращая эу поверхность в сплошной ковёр из самих себя, который… Отталкивает другие частички воды. Получается, что вода, даже на долю секунды вырывающаяся из основного объёма, превращается в тонкую плёнку, покрытую слоем «жирных» остатков, а потому не смешивающуюся с остальной водой.
Это и есть та самая пена, которой мы моем руки. Научно говоря, руки мы моем эмульсией, состоящей из тонкого слоя воды, от которой во все стороны, словно иголки ежа, торчат гидрофобные остатки жирных кислот.
Схематическое изображение плёнки, образованной стеаратом натрия. «Головка» — гидрофильная часть молекулы, «хвостик» — гидрофобный «жирный» остаток.
Вот эти-то остатки и делают своё «чёрное» дело. Ведь поверхность плёнки просто огромна! Она растекается по рукам, «пролезает» в мельчайшие поры и трещинки кожи, в которых обволакивает частички прилипшей к ней грязи. После чего гидрофобные частички своей массой налипают на грязь, и… Становятся с нею единым целым. Нет, ну а что, грязь гидрофобна, они гидрофобны, почему бы им, родственным душам, не тянуться друг к другу?
И они тянутся. Притягиваются. После чего «жирные» остатки начинают вытягивать частички грязи с поверности рук наружу, то есть в толщу воды. Да, они маленькие, а частички грязи в сравнении с ними большие… Но их не просто много, а ОЧЕНЬ много! И мало-помалу, секунда за секундой, эти «хвостики» жирных остатков всё больше и больше вытягивают загрязнитель, моментально обволакивая оторвавшиеся от кожи участки, начиная тянуть ещё сильнее. Как ту репку в сказке. Минута – и наши руки девственно чисты, все гидрофобные частички грязи «растворились» в мыльной пене.
Дальше мы опускаем руки под кран, и мыльная пена, вобравшая в себя загрязнитель, благополучно уходит в канализацию. Что и требовалось.
Подобным эффектом, образованием эммульсии и пены, обладают многие вещества.
Они называются поверхностно активными.
Почему же именно привычное нам мыло получило такое широкое распространение?
Всё дело в стоимости и простоте получения. Исходным сырьём для производства всю историю служили отходы мясного производства.
То есть жировые ткани животных, которые более никак не возможно использовать для пользы человечества, идущие на выброс. Плюс – простота самого процесса, который можно провести даже дома, в эмалерованной кастрюльке.
О том, как именно это сделать, мы поговорим в следующей статье.
Купить Лабораторную посуду и реактивы оптом и в розницу в Москве Вы можете в нашем интернет магазине.
Мы имеем достаточно широкий ассортимент данного вида товара по доступным ценам.
Так же у нас вы можете купить и химические реактивы для лаборатории .
Офис и склад находятся в городе Королёв на одной территории, что существенно ускоряет процесс обработки и отправки заказа.
Источник
Из чего состоит мыло и как оно работает? Мыловарение и химия!
Естественно, что каждый мыловар, изготовляющий мыло своими руками, должен знать из чего же состоит и как работает его домашнее мыло! Давайте перенесемся из клуба мыловаров в клуб школьной химии и все узнаем!
Так из чего же сделано мыло и магазинное и то, которое сделано своими руками?
Простыми словами, не расписывая химических реакций, мыло это высшие карбоновые соли жирных кислот, мы ограничимся натриевыми или калиевыми. Что такое соль, не в гастрономическом, а в химическом понимании? Многие соли — это продукт реакции щелочи и кислоты. И те и другие окружают нас повсеместно. Кислоты можно найти и в заправке для салата, и в аккумуляторе автомобиля. Щелочи, традиционно использующиеся в очистителях труб, также не новинка.
Жирные кислоты — это то, о чем мы привыкли слышать в отношении масел и жиров, которые потребляем. Все эти субстанции встречаются в природе в неизменном виде, тем не менее мыла в природе не найдешь, но его можно получить очень несложным способом, через процесс омыления. Омыление происходит тогда, когда жирные кислоты встречаются со щелочами.
Когда масла и жиры смешиваются с щелочью, последняя расщепляет масла и жиры на две составляющие: жирные кислоты и глицерин, после чего натриевая или калиевая части щелочи «объединяются» с жирными кислотами и образуют натриевую/калиевую соль жирных кислот, то есть мыло.
Кстати, как видно, побочным продуктом этой реакции является глицерин, который издревле извлекался в процессе мыловарения для дальнейшего использования в других областях человеческой деятельности, поскольку представлял собой весьма ценный и дорогой продукт.
Парадокс: при традиционном способе мыловарения, изъятие глицерина невозможно, поэтому весь он остается в мыле, делая последнее нежным для кожи. И глицерина в натуральном мыле на самом деле больше, чем в том, что мы привыкли называть глицериновым мылом
Как работает мыло?
Мыло это моющее средство, которое в сочетании с водой используется для очищения кожи или материалов. Молекулы мыла охотно «объединяются» с неполярными молекулами (жир) и полярными (вода). И хотя жир и масло, наряду с частицами пыли и грязи, легко присоединяются к коже или материалам, например, тканям, загрязняя их, в обычном нашем понимании, мыло выступает как рычаг, способный оторвать их от поверхности. На загрязненной поверхности мыло удерживает частицы в подвешенном состоянии так, что потом они легко смываются водой. Таким образом, благодаря своим обволакивающим качествам частицы мыла приводят к образованию эмульсии различных загрязняющих веществ, тем самым препятствуя их повторному осаждению на поверхности и удерживая нерастворимые частицы в состоянии суспензии, которые могут быть легко удалены.
Более научное объяснение: молекула моющего средства, в нашем случае, мыла, выглядит примерно как змейка с гидрофобным хвостом (растворимым в жире) и гидрофильной головой (растворимой в воде). Обладая таким строением молекул, мыло оказывается превосходным эмульгатором и диспергентом для систем жир-вода. Погружаясь хвостами в каплю жира и обращаясь головой к воде, молекулы моющего средства делают жир «растворимым», образуя системы-капли, именуемые мицеллами. Жир в мицеллах жестко связан и уже не обладает обычными свойствами, определяемыми нами на ощупь (ощущение жирного скольжения). Именно на образовании мицелл основан яркий эффект исчезновения масляной пленки с поверхности воды при добавлении минимального количества мыла или моющего средства. Обладая способностью к образованию мицелл, растворы моющих средств, кроме того, снижая поверхностное натяжение раствора, делают воду «более жидкой» (смачивающей), заставляя ее проникать во всевозможные труднодоступные места — между волокнами тканей, в микрополости и т.п. Кстати, нагревание воды приводит к похожему эффекту, так как одним из последствий нагревания является снижение ее поверхностного натяжения. Поэтому вы можете помыть посуду горячей водой и без моющих средств, но это вряд ли понравится Вашей коже.
В результате теплового молекулярного движения мицеллы не могут иметь значительного размера: большие капли просто разрываются на части, а освободившаяся при разрыве поверхность дочерних капель тут же заполняется новыми молекулами моющего средства. Если количество мыла в растворе достаточно, то его хватает до тех пор, пока мицеллы не примут характерного при данной температуре размера. Укрупнение и слияние мицелл при любой температуре произойти не может: поверхность их выстлана гидрофильными частями молекул мыла, имеющими отрицательный (чаще) заряд. Одноименно заряженные поверхности соседних мицелл, поэтому отталкиваются.
Первым признаком достаточности мыла или моющего средства служит пена.
Ее наличие на поверхности воды говорит о том, что в растворе существуют не связанные в мицеллы молекулы моющего средства, так как связанные не обладают способностью образовывать пену.
Источник
Почему мыло моет?
Вряд ли человечество когда-нибудь смогло бы похвастаться чистоплотностью, если бы от неряшливости и грязи ему не помогало избавиться самое обыкновенное мыло. Точнее, маленькие волшебные пузырьки.
Почему мыло мылится?
Секрет мыла и других моющих средств, относящихся к поверхностно-активным веществам, заключается в том, что они уменьшают поверхностное натяжение воды, усиливая тем самым ее моющие свойства. Любая мыльная пена состоит из бесчисленного количества мыльных пузырьков, оболочка которых сделана из воды. Частички грязи, пыли и сажи прилипают к пузырькам, а саму пену под струёй воды смыть намного проще.
Схожий процесс наблюдается, когда руду хотят отделить от пустой породы. Сначала её помещают в мыльную пену – в воде руда просто тонет. Пузырьки, из которых пена и состоит, поднимают кусочки руды к поверхности, в результате чего образуется корка. Иными словами, мыльные пузыри не только дают повод лишний раз рассмешить ребенка, но и помогают людям избавиться от грязи, а заодно сотворить еще кучу полезных дел. Думаю, в этом случае не мешало бы человека поблагодарить за то, что он заставил работать на себя даже мыльные пузыри.
Почему мыло моет?
Для ответа на вопрос «почему мыло моет?» попробуем разобраться в строении самого объекта исследования, а именно – стеарата натрия, из которого мыло и состоит. И здесь мы сделаем одно удивительное открытие: молекулы синтетических моющих средств имеют длинный неполярный углеводородный радикал и небольшую полярную часть.
Молекулы поверхностно-активных веществ на пограничной поверхности располагаются так, что гидрофильные группы направлены в воду, а гидрофобные выталкиваются из нее. В итоге вся поверхность воды покрывается этаким забором из молекул поверхностно-активных веществ.
Подобная водная поверхность имеет меньшее поверхностное натяжение, что помогает быстрому и полному смачиванию загрязненных поверхностей. За счет снижения степени натяжения поверхности воды увеличивается ее смачивающая способность. Покрытая молекулами поверхностно-активных веществ частица отделяется от поверхности ткани и в виде эмульсии или суспензии уходит в раствор.
Сегодня отечественная и зарубежная промышленности выпускает большое количество разнообразных СМС-детергентов, иначе говоря, моющих средств. Правильность использования этих средств зависит от вашего понимания самого процесса стирки, равно как и самого принципа, который заключается в том, что разные моющие средства образуют разную среду.
Так, мыльные частицы обладают обволакивающими свойствами, приводящие к образованию эмульсий различных загрязняющих веществ и препятствуют их повторному осаждению на поверхности. Они же способствуют удерживанию нерастворимых частиц в состоянии суспензии, благодаря чему те впоследствии могут быть легко удалены водой.
Источник
Химическая правда о мыле
Все мы пользуемся мылом. А знаете ли что это такое, и как оно работает. Вот мы и решили «пролить» немного химии на ваши головы. Не пугайтесь, ничего сложного. Зато много полезного и познавательного.
Что такое «вымыть руки»? Если бы всё, что нас окружает, растворялось в воде (как, например, поваренная соль), то вымыть руки было бы очень легко – опустить их в воду и подождать чуть-чуть. К сожалению, большая часть веществ, к которым мы прикасаемся, нерастворимы в воде, и поэтому, если они прилипают к рукам или одежде, то одна вода не позволяет нам избавиться от этой грязи и пятен. Однако можно заставить любое вещество хотя бы через короткое время (несколько секунд) раствориться в воде, образовав эмульсию или суспензию – взвесь мельчайших частичек жидкого (или твёрдого) вещества в воде. Этого времени часто бывает достаточно для того, чтобы поток чистой воды смыл эмульгированную грязь, сделав руки чистыми. Мыло и служит прекрасным эмульгатором – химическим соединением, облегчающим получение водных эмульсий частичек самых различных веществ.
Как родилось мыло и как его делают сейчас? При раскопках Древнего Вавилона были найдены глиняные ёмкости, наполненные веществом, похожим на мыло. Надписи на этих сосудах гласили, что содержимое сделано при кипячении жира с пеплом. Поэтому считают, что варить мыло умели ещё в 2800-х гг. до н.э. Записи на папирусах, оставленные древними египтянами за 1500 лет до н.э., тоже сохранили рецепты мыловарения из смеси животных и растительных масел и пепла. Древние греки не знали мыла, а когда мылись, то сначала тёрли себя глиной, песком, пемзой и пеплом, потом наносили на тело растительное масло и соскребали его вместе с грязью. Одежду свою они мыли безо всякого мыла в проточной воде.
Английское слово soap (мыло) произошло от названия горы Sapo в Италии, на вершине которой, согласно легенде, приносили животных в жертву, убивая и сжигая их. Дождь смывал вниз в реку Тибр, протекающую неподалёку, смесь расплавленного жира и древесного пепла. Поэтому глина вдоль Тибра хорошо мылилась, что быстро оценили женщины, стиравшие бельё на его берегах.
До Второй мировой войны мыло варили кипячением в воде жирных масел со щелочами. Жиры – это соединения глицерина и органических кислот, известных как жирные кислоты. Во время кипячения жиров со щелочами образуются глицерин и соли жирных кислот, т.е. мыл. Использование мыла после Второй мировой войны пошло на убыль, его постепенно вытесняли синтетические моющие средства. Главная причина спада потребления мыла состояла в том, что в жёсткой воде образовывались нерастворимые соли жирных кислот, выпадающие в осадок и отвечающие за появление кольцевого пятна в ванне и серый оттенок белья. Синтетические моющие средства (детергенты) имеют такой состав, что этой реакции не происходит.
Что такое мыло? Мыло – это натриевая или калиевая соль одной из жирных кислот. Натриевые мыл более густые и, как правило, твёрдые; калиевые мыл более мягкие или жидкие. Молекула мыла представляет собой длинную цепочку (хвост), состоящую из десятка и более звеньев –CH2–, соединённых друг с другом, к одному концу которой (голове) прикреплена карбоксильная группа (–CO2). Простейшим мылом, например, является стеарат натрия, который можно представить формулой NaC17H35COO (жуть, правда?), где 17 атомов углерода с присоединёнными к ним атомами водорода вытянуты в извилистую цепочку. Асимметрия молекулы мыла – её важнейшее свойство. Голова молекулы в растворе заряжена отрицательно и поэтому притягивается к положительным полюсам диполей молекул воды или, как говорят, испытывает сродство к воде. Другой конец молекулы мыла электрически нейтрален и поэтому инертен по отношению к воде.
Вот так выглядит мыльная молекула стеарата натрия (а) и положение ионов этих молекул на поверхности плёнки воды (б):
Как мыло понижает поверхностное натяжение? Когда мыльная молекула стеарата натрия попадает в воду, то она диссоциирует на положительно заряженный ион Na+ и отрицательное основание жирной кислоты. Отрицательные ионы мыльных молекул выстраиваются так, чтобы с водой соприкасались лишь их головы, которые испытывают к ней сродство. Таким образом, на поверхности воды образуется двумерный «частокол» мыльных молекул, головы которых погружены в воду, а хвосты торчат наружу. Измерения показывают, что молекулы мыла на поверхности воды понижают её поверхностное натяжение почти в 2,5 раза. Происходит это из-за того, что, находясь на поверхности воды «головой вниз», они, во-первых, не стремятся внутрь и, во-вторых, отталкиваются друг от друга, а не притягиваются, как молекулы воды. Таким образом, увеличивать поверхность воды, если в ней растворено мыло, легче. А это значит, что жидкость может проникать в щели между нитями ткани. Другими словами, мыло делает воду «более мокрой», и «намыленные» капли воды легче пролезают в промежутки между нитями ткани.
Как работает мыло? Мыльный раствор обволакивает частицы грязи, приводя к образованию эмульсий различных загрязняющих веществ, и удерживает нерастворимые частицы в состоянии суспензии в мыльной пене и воде, которые могут быть потом удалены c очищаемой поверхности проточной водой. Для моющего действия важно то, что углеводородная часть (хвост) отрицательного иона мыльной молекулы нерастворима в воде, но растворима в жирах и маслах. Поэтому водорастворимая отрицательно заряженная голова остаётся в воде, тогда как хвост погружается в жир. Анионы молекул со всех сторон окружают капельки жира и вытаскивают их в воду, в результате чего образуется взвесь капелек жира в воде. Так как каждая из мельчайших капелек несёт на себе отрицательный заряд, то они отталкиваются друг от друга, а не сливаются в более крупные капли. Этим объясняется диспергирующий и эмульгирующий эффект мыльных растворов.
Почему горячая вода моет лучше? При нагревании средняя кинетическая энергия молекул воды растёт, а это значит, что каждой из них требуется меньше дополнительной энергии, чтобы выйти на поверхность. Поэтому коэффициент поверхностного натяжения воды уменьшается при нагревании, и она может проникать в самые мелкие поры и дырочки. Вот почему надо мыть руки горячей водой. Мыло и детергенты ещё больше понижают поверхностное натяжение горячей воды.
Почему мыло плохо стирает в морской воде? Морская вода характеризуется высоким содержанием двухвалентных катионов – Ca2+ и Mg2+. Эти катионы связываются с отрицательно заряженными головками мыльных молекул, мешая им образовать мицеллы вокруг частичек грязи и жира. Поэтому поверхностное натяжение мыльного раствора в морской воде увеличивается, что снижает качество стирки. То же происходит, когда в водопроводной воде высока концентрация двухвалентных ионов, например, железа. Такую воду называют «жёсткой», и мыло в ней стирает плохо.
Почему полоскать надо в холодной воде? Цель полоскания – убрать остатки мыла из выстиранной ткани. При стирке мы нагреваем воду, чтобы понизить поверхностное натяжение воды, поэтому мыльный раствор залезает в самые тонкие промежутки между волокнами ткани. Чтобы он вылез оттуда, необходимо повысить поверхностное натяжение, и тогда каждой из сплющенных капелек опять станет выгодно стать шарообразной, и они выскочат из тонких промежутков между нитями. Поэтому полоскать ткань после стирки следует в холодной воде, когда её поверхностное натяжение велико.
Надо ли использовать антибактериальное мыло? Мыльные молекулы обволакивают бактерии, как и частички прилипшей к коже грязи. Поэтому в мыльном растворе скоро оказывается большинство бактерий. Учёные доказали, что обычное мыло ничуть не хуже борется с бактериями, чем разрекламированное повсюду антибактериальное. В отличие от обычного антибактериальное мыло содержит химические препараты (антибиотики), убивающие бактерий. Однако именно это и является недостатком антибактериального мыла. Дело в том, что антибиотик не в состоянии убить абсолютно все бактерии, а оставшиеся в живых «супербактерии» обладают необычайно высокой стойкостью по отношению к данному антибиотику. Они начинают размножаться, и скоро на нашей коже появляется столько же бактерий, сколько было до мытья, но все эти бактерии являются «детками» супербактерий, поэтому многие их них переняли от своих родителей нечувствительность к действию этого антибиотика. В результате антибактериальное мыло скоро становится бесполезным, а супербактерии с кожи распространяются по всему организму, и бороться с ними нужно уже с помощью другого, более мощного антибиотика. В общем, «хотели, как лучше, а получилось…».
Что такое отбеливатель? В моющих средствах для стирки белья, помимо собственно детергента (мыла), используют ещё и отбеливатель. Отбеливатели не удаляют грязь, а лишь обесцвечивают её. Одни из них окисляют и тем самым разрушают некоторые виды загрязнителей и красящих веществ. Классическим окислителем для этих целей служит хлор. В современных стиральных порошках используют более избирательные отбеливатели на основе брома. Другие отбеливатели, называемые усилителями белизны, делают выстиранное белье буквально «белее белого». Для этого в стиральные порошки добавляют флюоресцирующий «бесцветный краситель», который обеспечивает не только полное отражение видимого света, но и частичное превращение ультрафиолетового света в белый или голубоватый. В результате ткань становится «ослепительно белой».
Источник