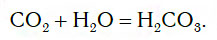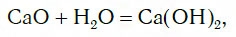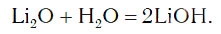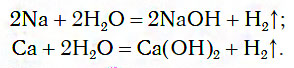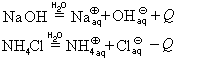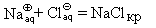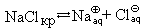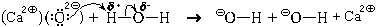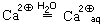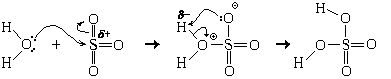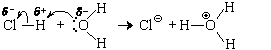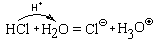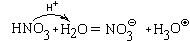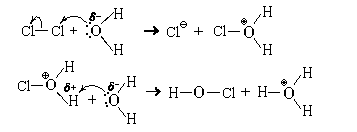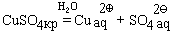Вода: строение и свойства
Вода — строение молекулы, химические и физические свойства. Взаимодействие с простыми веществами (металлами и неметаллами), и со сложными веществами.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Источник
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.
При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):
Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
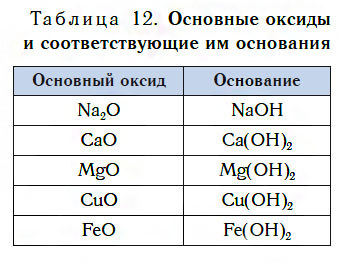
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Что химически не взаимодействует с водой
11.1. Физическое растворение
При попадании какого-либо вещества в воду оно может:
а) раствориться в воде, то есть перемешаться с ней на атомно-молекулярном уровне;
б) вступить с водой в химическую реакцию;
в) не раствориться и не прореагировать.
От чего же зависит результат взаимодействия вещества с водой? Естественно, от характеристик вещества и от характеристик воды.
Начнем с растворения и рассмотрим, какие характеристики воды и взаимодействующих с ней веществ имеют наибольшее значение в этих процессах.
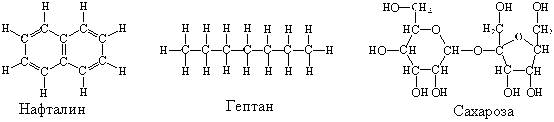
Поместим в две пробирки по небольшой порции нафталина С10Н8. Нальем в одну из пробирок воду, а в другую – гептан С7Н16 (можно вместо чистого гептана использовать бензин). Нафталин в гептане растворится, а в воде – нет. Проверим, действительно ли нафталин растворился в гептане или прореагировал с ним. Для этого поместим несколько капель раствора на стекло и подождем, пока гептан испарится – на стекле образуются бесцветные пластинчатые кристаллики. В том, что это нафталин, можно убедиться по характерному запаху.
Одно из отличий гептана от воды в том, что его молекулы неполярны, а молекулы воды полярны. Кроме того, между молекулами воды есть водородные связи, а между молекулами гептана их нет.
Для растворения нафталина в гептане требуется разорвать слабые межмолекулярные связи между молекулами нафталина и слабые межмолекулярные связи между молекулами гептана. При растворении образуются столь же слабые межмолекулярные связи между молекулами нафталина и гептана. Тепловой эффект такого процесса практически равен нулю.
За счет чего же нафталин растворяется в гептане? Только за счет энтропийного фактора (растет беспорядок в системе нафталин – гептан).
Для растворения нафталина в воде необходимо, кроме слабых связей между его молекулами, разорвать водородные связи между молекулами воды. При этом водородные связи между молекулами нафталина и воды не образуются. Процесс получается эндотермическим и настолько энергетически невыгодным, что энтропийный фактор здесь помочь не в силах.
А если вместо нафталина взять другое вещество, молекулы которого способны образовывать водородные связи с молекулами воды, то будет ли такое вещество растворяться в воде?
Если нет других препятствий, то будет. Например, вы знаете, что сахар (сахароза С12Н22О11) прекрасно растворим в воде. Посмотрев на структурную формулу сахарозы, вы увидите, что в ее молекуле есть группы –О–Н, способные образовывать водородные связи с молекулами воды.
Убедитесь экспериментально, что сахароза малорастворима в гептане, и попробуйте самостоятельно объяснить, почему так различаются свойства нафталина и сахарозы.
Растворение нафталина в гептане и сахарозы в воде называют физическим растворением.
| Физическое растворение – растворение, при котором происходит разрыв и образование только межмолекулярных связей (включая водородные). |
Физически растворяться могут только молекулярные вещества.
| Растворитель – вещество, которое до образования раствора находилось в том же агрегатном состоянии, что и образовавшийся раствор. |
Другие компоненты раствора называются растворенными веществами.
Выявленные нами закономерности относятся и к случаям растворения в воде (да и в большинстве других растворителей) жидких и газообразных веществ. Если все вещества, образующие раствор, до растворения находились в одном агрегатном состоянии, то растворителем обычно называют то вещество, которого в растворе больше. Исключение из этого правила – вода: ее обычно называют растворителем, даже если ее меньше, чем растворенного вещества.
Причиной физического растворения вещества в воде может быть не только образование водородных связей между молекулами растворяемого вещества и воды, но и образование других видов межмолекулярных связей. Так бывает прежде всего в случае растворения в воде газообразных веществ (например, углекислого газа или хлора), в которых молекулы вообще не связаны друг с другом, а также некоторых жидкостей с очень слабыми межмолекулярными связями (например, брома). Выигрыш в энергии достигается здесь за счет ориентации диполей (молекул воды) вокруг полярных молекул или полярных связей в растворяемом веществе, а в случае хлора или брома –вызван склонностью к присоединению электронов атомов хлора и брома, сохраняющейся и в молекулах этих простых веществ (подробнее –в § 11.4).
Во всех этих случаях вещества значительно хуже растворяются в воде, чем при образовании водородных связей.
Если из раствора удалить растворитель (например так, как вы это делали в случае раствора нафталина в гептане), то растворенное вещество выделится в химически неизменном виде.


2.Подскажите знак теплового эффекта растворения в воде этилового спирта (этанола).
3.Почему аммиак хорошо растворим в воде, а кислород – плохо?
4.Какое вещество лучше растворимо в воде – аммиак или фосфин (PH3)?
5.Объясните причину лучшей растворимости в воде озона, чем кислорода.
6.Определите массовую долю глюкозы (виноградного сахара, С6Н12О6) в водном растворе, если для его приготовления использовали 120 мл воды и 30 г глюкозы (плотность воды примите равной 1 г/мл). Какова концентрация глюкозы в этом растворе, если плотность раствора равна 1,15 г/мл?
7.Сколько сахара (сахарозы) можно выделить из 250 г сиропа с массовой долей воды, равной 35 %?.

2. Приготовление растворов.
В первом параграфе мы рассмотрели случаи растворения веществ, при которых химические связи оставались неизменными. Но так бывает далеко не всегда.
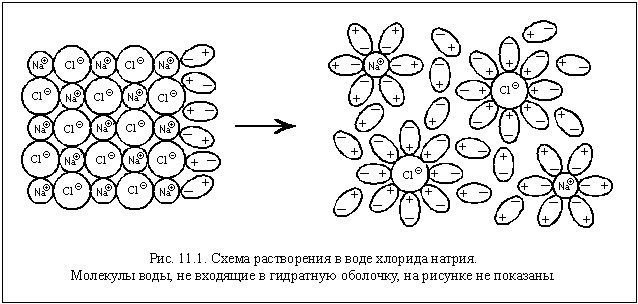
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество немолекулярное. Кристалл NaCl состоит из ионов Na 

| Гидратная оболочка – окружение иона, состоящее из одного или нескольких слоев определенным образом ориентированных молекул воды. |
В виде уравнения реакции это можно записать так:
NaClкр + (n + m)H2O = [Na(H2O)n] 
или сокращенно 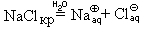
Можно записать и «молекулярное» уравнение этого процесса:(такое название сохранилось с тех пор, когда предполагалось, что все вещества состоят из молекул)
Гидратация – процесс образования гидратной оболочки.
Гидратированные ионы слабее притягиваются друг к другу, и энергии теплового движения оказывается достаточно для того, чтобы эти ионы не слипались в кристалл.
Практически наличие ионов в растворе легко подтвердить, изучив электропроводность хлорида натрия, воды и получившегося раствора. Вы уже знаете, что кристаллы хлорида натрия электрический ток не проводят, потому что в них хоть и есть заряженные частицы – ионы, но они » закреплены» в кристалле и не могут двигаться. Вода проводит электрический ток очень плохо, потому что в ней хоть и образуются за счет автопротолиза ионы оксония и гидроксид-ионы, но их очень мало. Раствор хлорида натрия, наоборот, хорошо проводит электрический ток, потому что в нем много ионов, и они могут свободно двигаться, в том числе под действием электрического напряжения.
Для разрыва ионных связей в кристалле и водородных связей в воде необходимо затратить энергию. При гидратации ионов энергия выделяется. Если затраты энергии на разрыв связей превышают энергию, выделяющуюся при гидратации ионов, то растворение эндотермическое, а если наоборот, то – экзотермическое.
Хлорид натрия растворяется в воде с практически нулевым тепловым эффектом, следовательно, растворение этой соли происходит только за счет увеличения энтропии. Но обычно растворение сопровождается заметным выделением теплоты (Na2CO3, CaCl2, NaOH и др.) или ее поглощением (KNO3, NH4Cl и др.), например:
При выпаривании воды из растворов, получившихся при химическом растворении, из них вновь выделяются растворенные вещества в химически неизменном виде.
| Химическое растворение – растворение, при котором происходит разрыв химических связей. |
И при физическом, и при химическом растворении образуется раствор того вещества, которое мы растворяли, например, раствор сахара в воде или раствор хлорида натрия в воде. Иными словами, растворенное вещество может быть выделено из раствора при удалении воды.


2.Что является растворителем, а что растворенным веществом (или веществами) в следующих растворах: а) мыльная вода, б) столовый уксус, в) водка г) соляная кислота, д ) горючее для мотоцикла, е) аптечная «перекись водорода» , ж) газированная вода, и) » зеленка» , к) одеколон?
В случае затруднения проконсультируйтесь с родителями.
3.Перечислите способы, с помощью которых можно удалить растворитель из жидкого раствора.
4.Как вы понимаете выражение » в химически неизменном виде» в последнем абзаце первого параграфа этой главы? Какие изменения могут произойти с веществом в результате его растворения и последующего выделения из раствора?
5.Известно, что жиры нерастворимы в воде, но хорошо растворяются в бензине. Исходя из этого, что можно сказать о строении молекул жиров?
6.Запишите уравнения химического растворения в воде следующих ионных веществ:
а) нитрата серебра, б) гидроксида кальция, в) йодида цезия, г) карбоната калия, д) нитрита натрия, е) сульфата аммония.
7.Запишите уравнения кристаллизации веществ из растворов, перечисленных в задании 6, при удалении воды.
8.Чем отличаются растворы, полученные при физическом растворении веществ, от растворов, полученных при химическом растворении? Что общего у этих растворов?
9.Определите массу соли, которую надо растворить в 300 мл воды, чтобы получить раствор с массовой долей этой соли, равной 0,1. Плотность воды равна 1 г/мл, а плотность раствора – 1,05 г/мл. Какова концентрация соли в полученном растворе, если ее формульная масса равна 101 Дн?
10.Сколько нужно взять воды и нитрата бария, чтобы приготовить 0,5 л 0,1 М раствора этого вещества (плотность раствора 1,02 г/мл)? 
Любая порция помещенного в воду хлорида натрия (или другого подобного вещества) всегда растворялась бы полностью, если бы кроме процесса растворения
не протекал бы обратный процесс – процесс кристаллизации исходного вещества из раствора:
В момент помещения кристалла в воду скорость процесса кристаллизации равна нулю, но, по мере увеличения концентрации ионов в растворе, она увеличивается и в какой-то момент становится равной скорости растворения. Наступает состояние равновесия:
образовавшийся при этом раствор называется насыщенным.
| Насыщенный раствор – раствор, находящийся в равновесии с растворяемым веществом. |
| Растворимость вещества (в данном растворителе) – характеристика состава насыщенного раствора этого вещества. |
В качестве такой характеристики может быть использована массовая доля растворенного вещества, его концентрация или другая физическая величина, характеризующая состав раствора.
По растворимости в данном растворителе все вещества делятся на растворимые, малорастворимые и практически нерастворимые. Обычно практически нерастворимые вещества называют просто нерастворимыми. За условную границу между растворимыми и малорастворимыми веществами принята растворимость, равная 1 г в 100 г Н2О (w 1 %), а за условную границу между малорастворимыми и нерастворимыми веществами – растворимость, равная 0,1 г в 100 г Н2О (w 0,1%).
Растворимость вещества зависит от температуры. Так как растворимость – характеристика равновесия, то ее изменение с изменением температуры происходит в полном соответствии с принципом Ле Шателье, то есть при экзотермическом растворении вещества его растворимость с увеличением температуры уменьшается, а при эндотермическом – увеличивается.
Растворы, в которых при тех же условиях растворенного вещества меньше, чем в насыщенных, называются ненасыщенными.


2.Определите массовую долю нитрата калия в насыщенном при 20 °С водном растворе этой соли, если при приготовлении такого раствора к 200 г воды прибавили 100 г нитрата калия, и при этом после окончания приготовления раствора 36,8 г нитрата калия не растворилось.
3.Можно ли при 20 °С приготовить водный раствор хромата калия K2CrO4 с массовой долей растворенного вещества, равной 45 %, если при этой температуре в 100 г воды растворяется не более 63,9 г этой соли.
4.Массовая доля бромида калия в насыщенном водном растворе при 0 °С равна 34,5 %, а при 80 °С – 48,8 %. Определите массу бромида калия, выделившегося при охлаждении до 0 °С 250 г насыщенного при 80°С водного раствора этой соли.
5.Массовая доля гидроксида кальция в насыщенном водном растворе при 20 °С равна 0,12 %. Сколько литров насыщенного при этой температуре раствора гидроксида кальция (известковой воды) можно получить, имея в своем распоряжении 100 г гидроксида кальция? Плотность раствора примите равной 1 г/мл.
6.При 25 °C массовая доля сульфата бария в насыщенном водном растворе составляет 2,33·10 –2 %. Определите минимальный объем воды, необходимой для полного растворения 1 г этой соли.

Многие вещества при соприкосновении с водой вступают с ней в химические реакции. В результате такого взаимодействия при избытке воды, как и при растворении, получается раствор. Но если из этого раствора удалить воду, исходного вещества мы не получим.
Какие продукты образуются при химической реакции вещества с водой? Это зависит от типа химической связи в веществе; если связи ковалентные, то от степени полярности этих связей. Кроме этого, влияние оказывают и другие факторы, с некоторыми из которых мы познакомимся.
а) Соединения с ионной связью
Большинство ионных соединений либо химически растворяются в воде, либо не растворяются. Особняком стоят ионные гидриды и оксиды, то есть соединения, содержащие те же элементы, что и сама вода, и некоторые другие вещества. Поведение ионных оксидов при контакте с водой рассмотрим на примере оксида кальция.
Оксид кальция, будучи ионным веществом, мог бы химически растворяться в воде. При этом в раствор переходили бы ионы кальция и оксид-ионы. Но двухзарядный анион – не самое устойчивое валентное состояние атома кислорода (хотя бы потому, что энергия сродства ко второму электрону всегда отрицательна, да и радиус оксид-иона сравнительно мал). Поэтому атомы кислорода стремятся понизить свой формальный заряд. В присутствии воды это оказывается возможным. Оказавшиеся на поверхности кристалла оксид-ионы взаимодействуют с молекулами воды. Эту реакцию можно представить в виде схемы, показывающей ее механизм (схемы механизма).
Для лучшего понимания происходящего условно разделим этот процесс на этапы:
1. Молекула воды поворачивается к оксидному иону атомом водорода (противоположно заряжены).
2. Оксид-ион делится с атомом водорода неподеленной парой электронов; между ними образуется ковалентная связь (образуется по донорно-акцепторному механизму).
3. У атома водорода на единственной валентной орбитали (1s) оказывается четыре электрона (два «старых» и два «новых»), что противоречит принципу Паули. Поэтому атом водорода отдает пару электронов связи («старых» электронов) атому кислорода, входящему в состав молекулы воды, тем более что эта пара электронов и так была в значительной степени смещена к атому кислорода. Связь между атомом водорода и атомом кислорода разрывается.
4. За счет образования связи по донорно-акцепторному механизму формальный заряд на бывшем оксидном ионе становится равным –1 е; на атоме кислорода, входившем прежде в состав молекулы воды, появляется заряд, также равный –1 е. Таким образом образуются два гидроксидных иона.
5. Не связанные теперь ионной связью с оксид-ионами ионы кальция переходят в раствор и гидратируются:
Положительный заряд ионов кальция как бы «размывается» по всему гидратированному иону.
6. Образовавшиеся гидроксид-ионы тоже гидратируются:
Отрицательный заряд гидроксид-иона при этом тоже «размывается».
Суммарное ионное уравнение реакции оксида кальция с водой
CaOкр + H2O 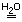
aq + 2OH

В растворе появляются ионы кальция и гидроксид-ионы в соотношении 1:2. То же самое получилось бы при растворении в воде гидроксида кальция. И действительно, выпарив воду и высушив остаток, мы можем получить из этого раствора кристаллический гидроксид кальция (но отнюдь не оксид!). Поэтому часто уравнение этой реакции записывают так:
и называют » молекулярным » уравнением этой реакции. И в тех, и в других уравнениях буквенные индексы иногда не приводят, что часто сильно затрудняет понимание происходящих процессов, а то и просто вводит в заблуждение. Вместе с тем, отсутствие буквенных индексов в уравнениях допустимо, например, при решении расчетных задач
Кроме оксида кальция, точно также взаимодействуют с водой следующие оксиды: Li2O, Na2O, K2O, Rb2O, Cs2O, SrO, BaO – то есть оксиды тех металлов, которые и сами реагируют с водой. Все эти оксиды относятся к основным оксидам. Остальные ионные оксиды с водой не реагируют.
Совершенно аналогично реагируют с водой и ионные гидриды, например, гидрид натрия NaH. Ион натрия только гидратируется, а гидрид-ион реагирует с молекулой воды:
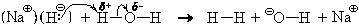
В результате в растворе остается гидроксид натрия.
Ионное уравнение этой реакции
NaHкр + H2O = Na 

,
а » молекулярное» уравнение – NaHкр + H2O = NaOHр + H2 .
б) Вещества с металлической связью
В качестве примера рассмотрим взаимодействие с водой натрия.
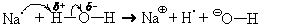
На схемах кривая полустрелка означает передачу или перемещение о д н о г о э л е к т р о н а
Атом натрия склонен к отдаче своего единственного валентного электрона. Оказавшись в воде, он легко отдает его атому водорода молекулы воды (на нем есть значительный + ) и превращается в катион натрия (Na 

Судьба получившихся частиц различна: ион натрия взаимодействует с другими молекулами воды и, естественно, гидратируется
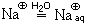
так же, как и ион натрия, гидратируется гидроксид-ион 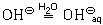
Из-за неполярности своих молекул водород в воде практически нерастворим и выделяется из раствора в виде газа. Ионное уравнение этой реакции
2Naкр + 2H2O = 2Na 

2Naкр + 2H2O = 2NaOHр + H2
Так же, как натрий, при комнатной температуре с водой бурно реагируют Li, К, Rb, Cs, Ca, Sr, Ba. При нагревании с ней реагирует и Mg, а также некоторые другие металлы.
в) Вещества с ковалентными связями
Из веществ с ковалентными связями с водой могут реагировать только те вещества
а) связи в которых сильно полярны, что придает этим веществам некоторое сходство с ионными соединениями, или
б) в состав которых входят атомы, обладающие очень высокой склонностью к присоединению электронов.
Таким образом, не реагируют с водой и в ней нерастворимы (или очень мало растворимы):
а) алмаз, графит, кремний, красный фосфор и другие простые немолекулярные вещества;
б) диоксид кремния, карбид кремния и другие сложные немолекулярные вещества;
в) метан, гептан и другие молекулярные вещества с малополярными связями;
г) водород, сера, белый фосфор и другие простые молекулярные вещества, атомы которых не очень склонны присоединять электроны, а также азот, молекулы которого очень прочны.
Наибольшее значение имеет взаимодействие с водой молекулярных оксидов, гидридов и гидроксидов, а из простых веществ – галогенов.
Как реагируют с водой молекулярные оксиды, мы рассмотрим на примере триоксида серы:
Молекула воды за счет одной из неподеленных пар электронов атома кислорода атакует положительно заряженный атом серы ( +) и присоединяется к нему связью O– S, на атоме кислорода при этом возникает формальный заряд B. Получив лишние электроны, атом серы перестает удерживать электронную пару одной из -связей, которая полностью переходит к соответствующему атому кислорода, на котором за счет этого возникает формальный заряд A. Затем неподеленная пара электронов этого атома кислорода акцептируется одним из атомов водорода, входившего в состав молекулы воды, который таким образом переходит от одного атома кислорода к другому. В итоге образуется молекула серной кислоты. Уравнение реакции:
Аналогично, но несколько более сложно с водой реагирует N2O5, P4O10 и некоторые другие молекулярные оксиды. Все они – кислотные оксиды.
N2O5 + H2O = 2HNO3;
P4O10 + 6H2O = 4H3PO4.
Во всех этих реакциях образуются кислоты, которые при наличии избытка воды с ней реагируют. Но, прежде чем рассмотреть механизм этих реакций, посмотрим, как реагирует с водой хлороводород – молекулярное вещество с сильно полярными ковалентными связями между атомами водорода и хлора:
Полярная молекула хлороводорода, попав в воду, ориентируется так, как это показано на схеме (разноименные заряды диполей притягиваются). Разреженная из-за поляризации электронная оболочка (1s-ЭО) атома водорода акцептирует неподеленную пару sp 3 -гибридных электронов атома кислорода, и водород присоединяется к молекуле воды, полностью отдав атому хлора пару электронов, которая связывала эти атомы в молекуле хлороводорода. В результате атом хлора превращается в хлорид-ион, а молекула воды – в ион оксония. Уравнение реакции:
HClг + H2O = H3O 

При низких температурах из такого раствора может быть выделен кристаллический хлорид оксония (H3O)Cl (tпл = –15 °С).
Взаимодействие HCl и H2O можно представить себе и по-другому:
то есть как результат передачи протона от молекулы хлороводорода к молекуле воды. Следовательно, это кислотно-основная реакция.
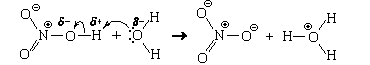
Аналогично происходит взаимодействие с водой азотной кислоты
что тоже можно представит как передачу протона:
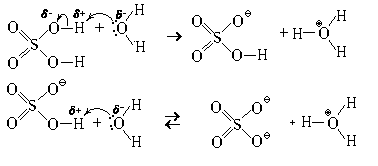
Кислоты, в молекулах которых несколько гидроксилов (OH-групп), реагируют с водой в несколько стадий (ступенчато). Пример – серная кислота.
Второй протон отщепляется значительно труднее, чем первый, поэтому вторая стадия этого процесса обратима. Сравнив величину и распределение зарядов в молекуле серной кислоты и в гидросульфат-ионе, попробуйте самостоятельно объяснить это явление.
При охлаждении из растворов серной кислоты могут быть выделены индивидуальные вещества: (H3O)HSO4 (tпл = 8,5 °С) и (H3O)2SO4 (tпл = – 40 °С).
Анионы, образующиеся из молекул кислот после отрыва одного или нескольких протонов, называются кислотными остатками.
Из молекулярных простых веществ с водой при обычных условиях реагируют только F2, Cl2, Br2 и, в крайне незначительной степени, I2. Фтор бурно реагирует с водой, полностью ее окисляя:
При этом протекают также и другие реакции.
Значительно важнее реакция хлора с водой. Обладая высокой склонностью к присоединению электронов (молярная энергия сродства к электрону атома хлора равна 349 кДж/моль), атомы хлора частично сохраняют ее и в молекуле (молярная энергия сродства к электрону молекулы хлора равна 230 кДж/моль). Поэтому, растворяясь, молекулы хлора гидратируются, притягивая к себе атомы кислорода молекул воды. У некоторых из этих атомов кислорода атомы хлора могут акцептировать неподеленную пару электронов. Дальнейшее показано на схеме механизма:
Суммарное уравнение этой реакции
Cl2 + 2H2O = HClO + H3O 

Но реакция обратима, поэтому устанавливается равновесие:
Cl2 + 2H2O 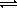


Получившийся раствор называют » хлорной водой» . За счет присутствия в нем хлорноватистой кислоты он обладает сильными окислительными свойствами и используется в качестве отбеливающего и дезинфицирующего средства.
Вспомнив, что Cl 

Cl2 + H2O 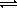
Аналогично с водой реагирует бром, только равновесие в этом случае сильно смещено влево. Йод же с водой практически не реагирует.
Чтобы представить себе, в какой степени хлор и бром физически растворяются в воде, а в какой – реагируют с ней, используем количественные характеристики растворимости и химического равновесия.
Мольная доля хлора в насыщенном при 20°С и атмосферном давлении водном растворе равна 0,0018, то есть на каждую 1000 молекул воды приходится примерно 2 молекулы хлора. Для сравнения, в насыщенном при тех же условиях растворе азота мольная доля азота равна 0,000012, то есть одна молекула азота приходится примерно на 100000 молекул воды. А для получения насыщенного при тех же условиях раствора хлороводорода на каждые 100 молекул воды нужно взять около 35 молекул хлороводорода. Отсюда можно сделать вывод, что хлор хоть и растворим в воде, но незначительно. Растворимость брома несколько больше – примерно 4 молекулы на 1000 молекул воды.
Константа равновесия обратимой химической реакции хлора с водой
Cl2 + 2H2O 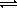

равна 1,36·10– 7 . Отсюда следует, что при комнатной температуре в среднем 35 молекул хлора из 100 подвергнуты этому превращению. В случае брома это число намного меньше: примерно 1 молекула из 1000.


2.Изобразите схему, иллюстрирующую механизм взаимодействия с водой кальция.
3.Почему металлы IА группы бурно реагируют с водой, а медь, железо, хром или свинец практически не реагируют?
4.Составьте ионные и » молекулярные» уравнения реакций с водой оксидов натрия, стронция и бария. Для реакции с водой оксида лития приведите схему, иллюстрирующую ее механизм.
5.Приведите уравнения реакций, позволяющих осуществить следующие превращения:
а) Li Li2O
LiOH; б) Ca
CaO
Ca(OH)2.
6.Составьте уравнения реакций, по которым можно получить а) хромовую кислоту (H2CrO4) из оксида хрома(VI), б) йодноватую кислоту (HIO3) из оксида йода(V), в) селеновую кислоту (H2SeO4) из оксида селена (VI).
7.Приведите уравнения реакций, позволяющих осуществить следующие превращения:
а) S SO2
SO3
H2SO4 ;
б) P P4O10
H3PO4.
8.Что происходит при » растворении» в воде бромоводорода? Ответ проиллюстрируйте уравнениями реакций.
9.Запишите уравнение обратимой реакции брома с водой и составьте схемы механизмов прямой и обратной реакций.
При химическом растворении ионных веществ происходит гидратация переходящих в раствор ионов. Гидратируются как катионы, так и анионы. Как правило, гидратированные катионы прочнее, чем анионы, а гидратированные простые катионы — прочнее, чем сложные. Это связано с тем, что у простых катионов есть свободные валентные орбитали, которые могут частично акцептировать неподеленные электронные пары атомов кислорода, входящих в молекулы воды.
При попытке выделить исходное вещество из раствора, удаляя воду, получить его часто не удается. Например, если мы растворим в воде бесцветный сульфат меди CuSO4, то получим раствор голубого цвета, который придают ему гидратированные ионы меди:
После упаривания раствора (удаления воды) и охлаждения из него выделятся кристаллы синего цвета, имеющие состав CuSO4· 5H2O (точка между формулами сульфата меди и воды означает, что на каждую формульную единицу сульфата меди приходится указанное в формуле число молекул воды). Исходный сульфат меди можно получить из этого соединения, нагрев его до 250 ° С. При этом происходит реакция:
CuSO4· 5H2O = CuSO4 + 5H2O .
Исследование строения кристаллов CuSO4· 5H2O показало, что в его формульной единице четыре молекулы воды связаны с атомом меди, а пятая – с сульфатными ионами. Таким образом, формула этого вещества – [Cu(H2O)4]SO4· H2O, а называется оно моногидрат сульфата тетрааквамеди(II), или просто » медный купорос» .
Четыре молекулы воды, связанные с атомом меди, – остаток гидратной оболочки иона Cu 2 aq, а пятая молекула воды – остаток гидратной оболочки сульфат-иона.
Аналогичное строение имеет соединение [Fe(H2O)6]SO4· H2O – моногидрат сульфата гексаакважелеза(II), или » железный купорос» .
Другие примеры:
[Ca(H2O)6]Cl – хлорид гексааквакальция;
[Mg(H2O)6]Cl2 – хлорид гексааквамагния.
Эти и подобные им вещества называются кристаллогидратами, а содержащаяся в них вода – кристаллизационной водой.
Часто структура кристаллогидрата бывает неизвестна, или ее невозможно выразить обычными формулами. В этих случаях для кристаллогидратов используются упомянутые выше » формулы с точками» и упрощенные названия, например:
CuSO4· 5H2O – пентагидрат сульфата меди;
Na2CO3· 10H2O – декагидрат карбоната натрия;
AlCl3· 6H2O – гексагидрат хлорида алюминия.
| Кристаллогидраты — вещества, включающие в себя обособленные частицы H2O, в которых атомы кислорода связаны с двумя атомами водорода ковалентными связями, а частицы Н2О в целом связаны с другими атомами либо химическими, либо межмолекулярными связями. |
При образовании кристаллогидратов из исходных веществ и воды в молекулах воды не происходит разрыва связей О—Н.
Если кристаллизационная вода удерживается в кристаллогидрате слабыми межмолекулярными связями, то она легко удаляется при нагревании:
Na2CO3· 10H2O = Na2CO3 + 10H2O (при 120 ° С);
K2SO3· 2H2O = K2SO3 + 2H2O (при 200 ° С);
CaCl2· 6H2O = CaCl2 + 6H2O (при 250 ° С).
Если же в кристаллогидрате связи между молекулами воды и другими частицами близки к химическим, то такой кристаллогидрат или дегидратируется (теряет воду) при более высокой температуре, например:
Al2(SO4)3· 18H2O = Al2(SO4)3 + 18H2O (при 420 ° С);
СoSO4· 7H2O = CoSO4 + 7H2O (при 410 ° С);
или при нагревании разлагается с образованием других химических веществ, например:
2
2
Таким образом, взаимодействие с водой безводных веществ, образующих кристаллогидраты, может быть как химическим растворением, так и химической реакцией.


2.Определите состав кристаллогидрата сульфата магния, если массовая доля воды в нем равна 51,2%. 3.Какова масса воды, выделившейся при прокаливании декагидрата сульфата натрия (Na2SO4· 10H2O) массой 644 г?
4.Сколько безводного хлорида кальция можно получить, прокаливая 329 г гексагидрата хлорида кальция?
5.Дигидрат сульфата кальция CaSO4· 2H2О при нагревании до 150° С теряет 3/4 своей воды. Составьте формулу образующегося кристаллогидрата (алебастра) и запишите уравнение превращения гипса в алебастр.
6.Определите массу медного купороса и воды, которые необходимо взять для приготовления 10 кг 5 %-го раствора сульфата меди.
7.Определите массовую долю сульфата железа(II) в растворе, полученном при смешении 100 г железного купороса (FeSO4· 7H2O) с 9900 г воды. 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Источник