§ 15. Ароматические углеводороды. Бензол

Что вы знаете о бензоле?
Название «ароматические соединения» возникло давно, на ранних этапах развития органической химии. К ним относили соединения, получающиеся из природных смол, эфирных масел, бальзамов, обладающих приятным запахом. Впоследствии оказалось, что существует ещё много веществ, которые по строению и химическим свойствам схожи с ароматическими соединениями, но не имеют приятного запаха. Однако исторически сложившееся название так и осталось.
Большинство ароматических углеводородов опасны для жизни человека, они токсичны, и работа с ними требует строгого соблюдения мер безопасности. Так, бензол является ядовитым веществом, действует на почки, при длительном контакте изменяет формулу крови, может нарушать структуру хромосом. Бензол — типичный и простейший представитель ароматических углеводородов.
Строение бензола
Молекулярная формула бензола С6Н6. Очевидно, что это ненасыщенный углеводород — не хватает восьми атомов водорода до полного насыщения — С6Н14. Для ненасыщенных углеводородов характерно обесцвечивание раствора перманганата калия и бромной воды. Проверим это на опыте с бензолом.

Проблема. Почему бензол не обесцвечивает бромную воду и раствор КМnO4? Какие можно сделать предположения о строении бензола?
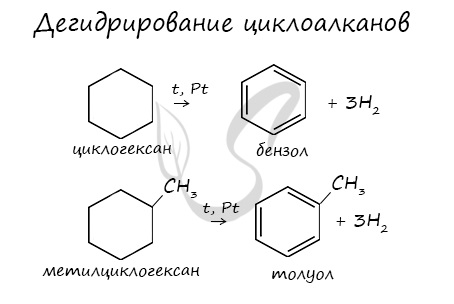
Опыт позволяет предположить, что бензол не образует прямую или разветвлённую цепь, в которой находятся двойные или тройные связи. Это же самое доказывает и реакция гидрирования бензола. Экспериментально также установлено, что молекула бензола (1 моль) присоединяет только три молекулы водорода (3 моль), в результате чего получается циклическое соединение — циклогексан:
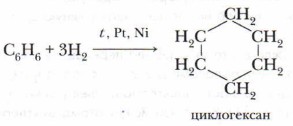
Из этого следует, что бензол — углеводород циклического строения.
Значительно позже русским учёным Н.Д. Зелинским была проведена обратная реакция — каталитическое дегидрирование циклогексана. В результате этой реакции был получен бензол:
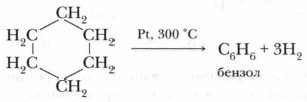
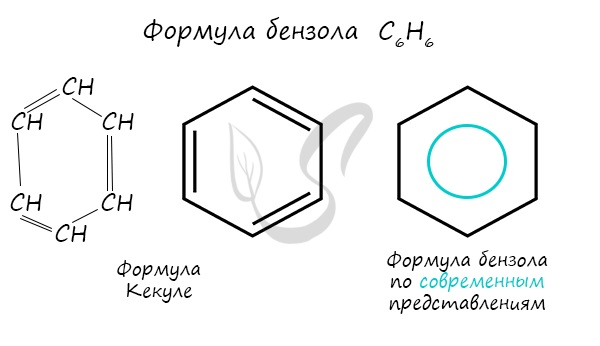
Немецкий химик Ф.А. Кекуле в 1865 г. высказал предположение о циклическом строении бензола с чередованием простых (одинарных) и двойных (кратных) связей и предложил выразить это структурной формулой следующим образом (1, 2):
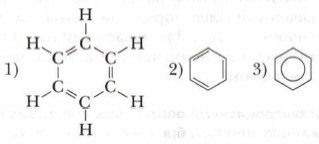
В современной химии наряду с традиционными формулами Кекуле часто пользуются структурной формулой бензола, в которой акцент сделан на бензольное кольцо (3).

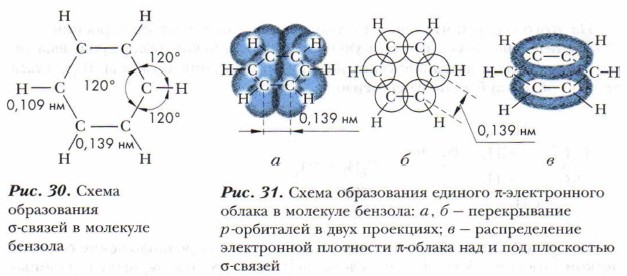
Все атомы углерода в молекуле бензола находятся в sh 2 -гибридном состоянии. Каждый атом углерода образует три σ-связи: с двумя соседними атомами углерода и одним атомом водорода. Эти связи лежат в одной плоскости, и углы между ними равны 120° (рис. 30). Таким образом, шесть атомов углерода образуют правильный шестиугольник. Кроме того, каждый атом углерода имеет одну негибридную 2p-орбиталь, на которой находится один электрон.
Негибридная р-электронная орбиталь каждого атома углерода перекрывается рядом находящимися негибридными р-электронными облаками слева и справа, образуется единое π-электронное облако, состоящее из шести электронов. Электронная плотность в нём распределена равномерно (рис. 31). Все связи между атомами углерода одинаковые. Перекрывание происходит над и под плоскостью σ-связей. С подобным явлением вы уже знакомились при изучении диеновых углеводородов, содержащих сопряжённые двойные связи (см. § 13).
Исследования показали, что в бензоле нет простых и двойных связей, под влиянием π-электронного облака ядра атомов углерода сближаются, и расстояние между центрами соседних атомов углерода сокращается и становится одинаковым — 0,139 нм. Вспомним, что длина одинарной связи С—С равна 0,154 нм, а двойной связи С=С — 0,134 нм.
В настоящее время используют следующие современные структурные формулы молекулы бензола:
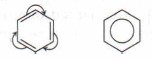
Чаще всего пользуются формулой в виде правильного шестиугольника с окружностью в цикле.
Электронное строение бензола объясняет загадки молекул бензола:
- благодаря сопряжению электронная плотность в бензольном кольце выравнивается, расстояния между атомами углерода одинаковые;
- благодаря сопряжению молекула бензола становится более устойчивой, связь между атомами углерода в бензольном кольце значительно прочнее;
- бензол стоек к действию окислителей, реакции присоединения затруднены.
Плоскость, в которой расположены атомы углерода, называется бензольным ядром или бензольным кольцом.
Бензольное ядро — это прочная система. Связь в бензольном ядре часто называют ароматической. Делокализованная π-связь (см. рис. 31, б, в) — главный признак принадлежности веществ к группе ароматических соединений. По международной номенклатуре ароматические углеводороды называются аренами.
Ароматические углеводороды, или арены, — это органические соединения, в молекулах которых имеется одно или несколько бензольных колец.
Общая формула углеводородов ряда бензола, имеющих одно бензольное кольцо, CnH2n-6.
Известны также небензоидные ароматические соединения, например гетероциклические.
Физические свойства бензола
Бензол — это легкокипящая (температура кипения 80,1 °С) бесцветная жидкость, не растворяется в воде. Имеет специфический запах. При охлаждении легко застывает и превращается в белую кристаллическую массу с температурой плавления 5,5 °С.
Химические свойства бензола
1. Реакция горения
Как все углеводороды, бензол сгорает с образованием углекислого газа и воды:
Бензол горит коптящим пламенем.
Задание. Вычислите массовую долю (%) углерода в бензоле.
2. Реакции замещения
Наличие π-электронного облака в бензольном кольце, а также его пространственная доступность создают предпосылки для протекания реакций замещения. Для аренов характерны реакции электрофильного замещения в бензольном кольце. Важнейшими из таких реакций являются: галогенирование и нитрование.
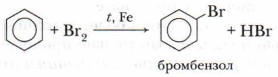
А. Галогенирование
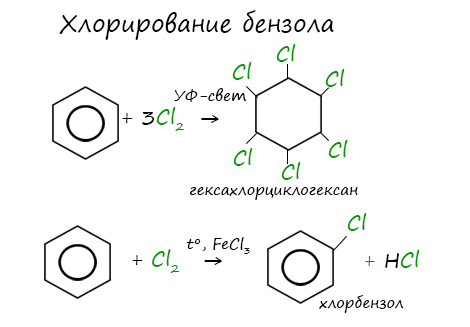
Бензол при обычных условиях не обесцвечивает бромную воду, но при нагревании в присутствии железных стружек вступает в реакцию, при этом образуется тяжёлая жидкость бромбензол — СбН5Вr:
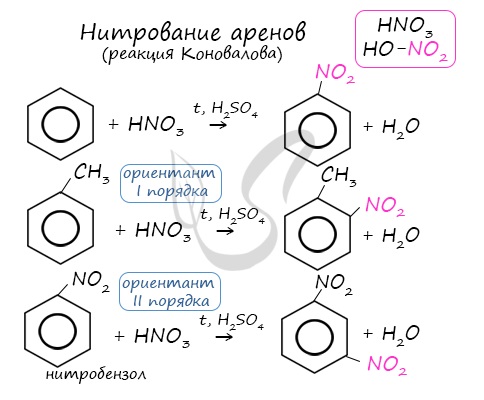
Б. Нитрование
При действии на бензол нитрующей смеси (концентрированные серная и азотная кислоты) и при нагревании происходит реакция замещения, нитрогруппа азотной кислоты — NO2 замещает атом водорода в молекуле бензола:

При этом образуется желтоватая тяжёлая жидкость, нерастворимая в воде, с запахом горького миндаля — нитробензол C6H5NO2 которая используется в качестве растворителя, а также для получения анилина.
3. Реакции присоединения
Проблема. Бензол с большим трудом вступает в реакции присоединения. Почему это происходит?
Реакции присоединения аренов связаны с разрушением устойчивой системы бензольного кольца. Они энергетически невыгодны и протекают только при нагревании или при облучении.
А. Галогенирование
Реакция присоединения хлора к бензолу идёт при УФ-облучении и температуре кипения бензола. При этом образуется гексахлорциклогексан:
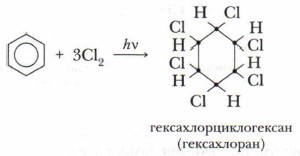
Гексахлорциклогексан — ядохимикат, который до недавнего времени использовался для защиты растений от насекомых, но он опасен для жизни человека, а потому заменён на более безопасные и легко разлагаемые пестициды.
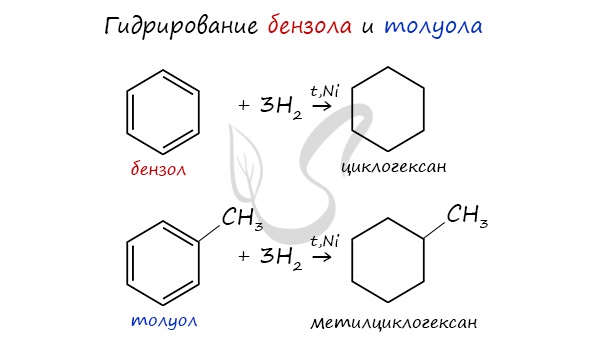
Б. Гидрирование
Эта реакция идёт в присутствии катализаторов (Pt, Ni) и при нагревании:
Источник
Бензол и его гомологи
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6. Общая формула их гомологического ряда — CnH2n-6.
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол — 120°.
Номенклатура и изомерия аренов
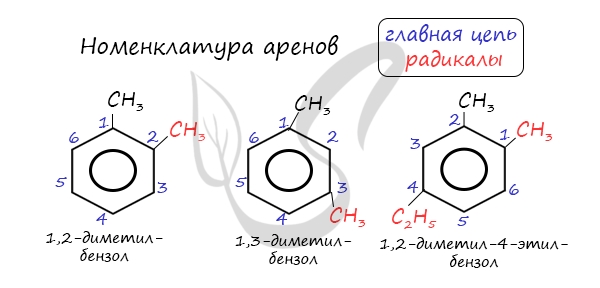
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
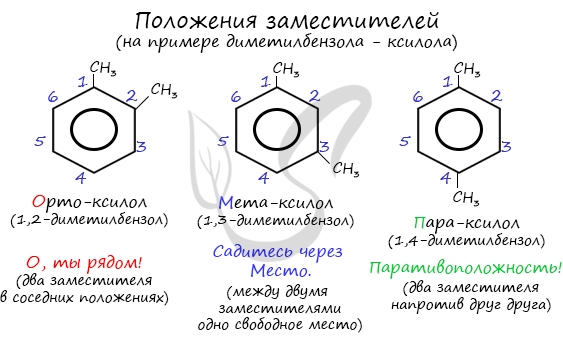
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
Получение аренов
Арены получают несколькими способами:
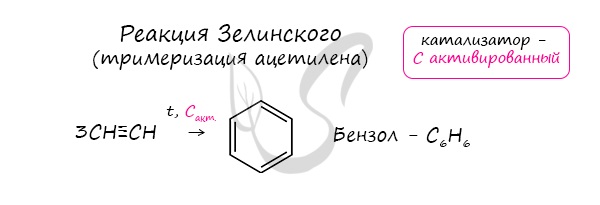
- Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.
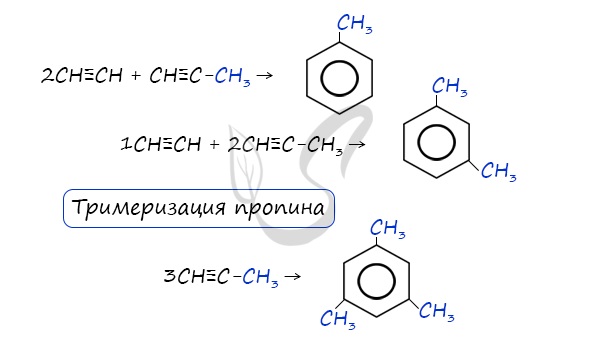
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
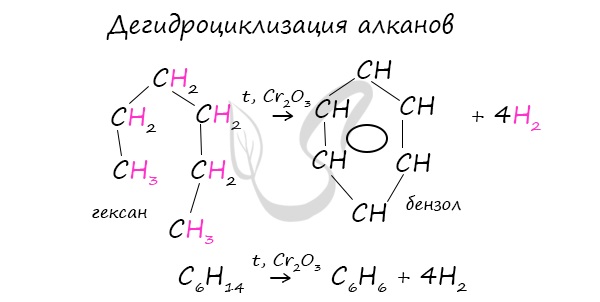
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
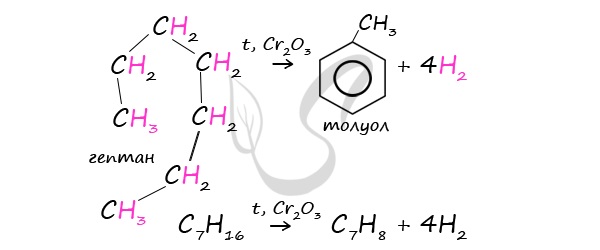
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
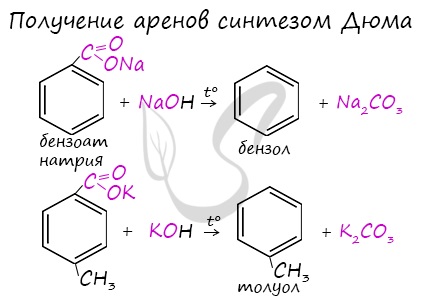
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
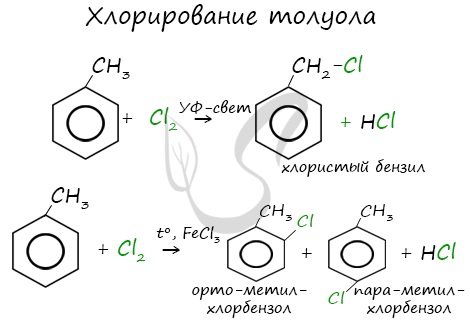
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
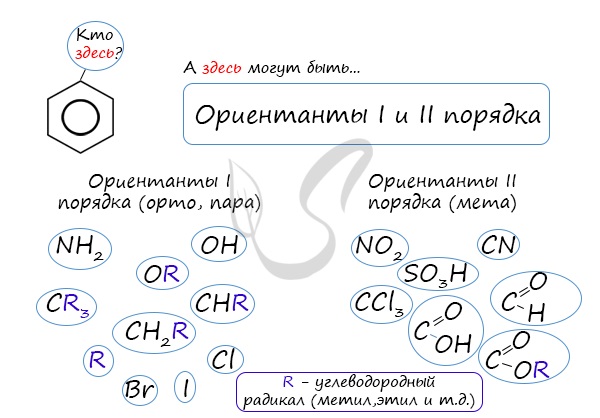
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
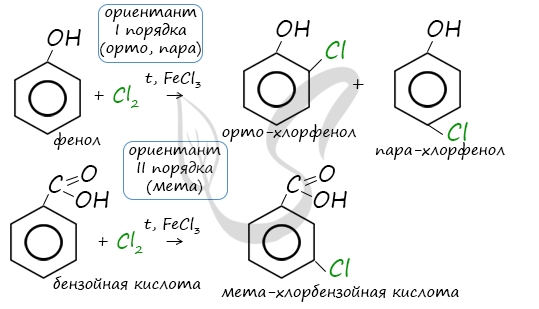
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
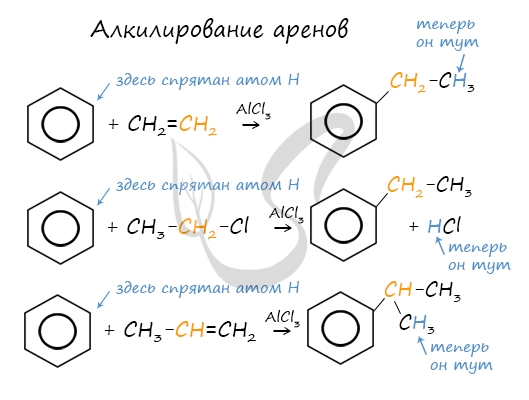
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
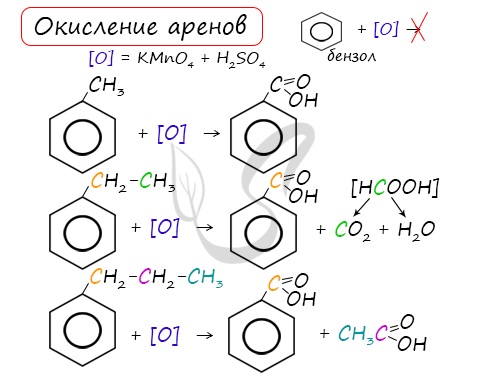
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
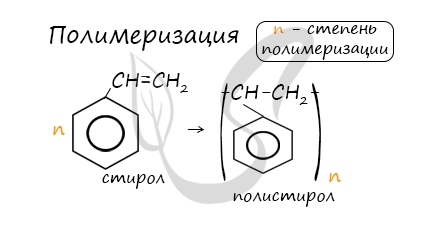
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник