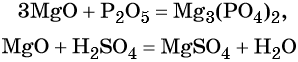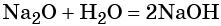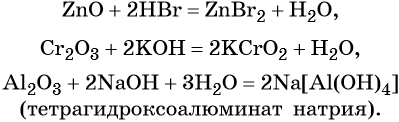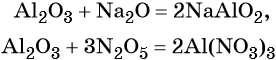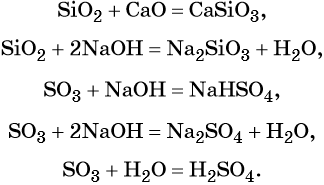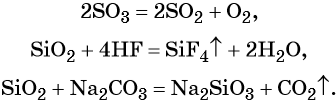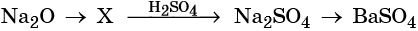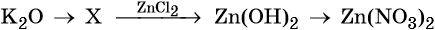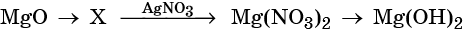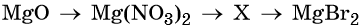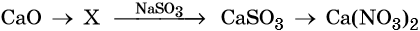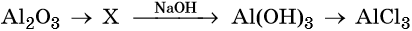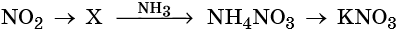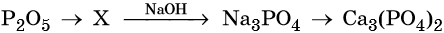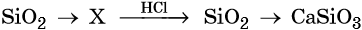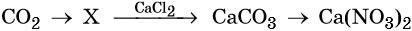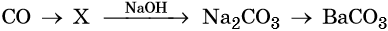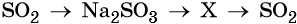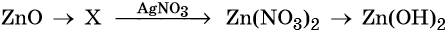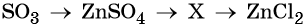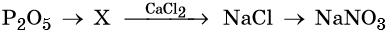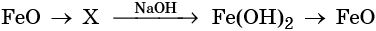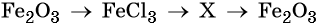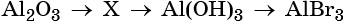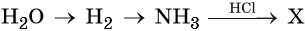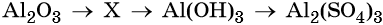Химия, Биология, подготовка к ГИА и ЕГЭ
Амфотерные соединения
Автор статьи — Саид Лутфуллин
Химия – это всегда единство противоположностей.
Посмотрите на периодическую систему.
Некоторые элементы (почти все металлы, проявляющие степени окисления +1 и +2) образуют основные оксиды и гидроксиды. Например, калий образует оксид K2O, и гидроксид KOH. Они проявляют основные свойства, например взаимодействуют с кислотами.
K2O + HCl → KCl + H2O
Некоторые элементы (большинство неметаллов и металлы со степенями окисления +5, +6, +7) образуют кислотные оксиды и гидроксиды. Кислотные гидроксиды – это кислородсодержащие кислоты, их называют гидроксидами, потому что в строении есть гидроксильная группа, например, сера образует кислотный оксид SO3 и кислотный гидроксид H2SO4 (серную кислоту):
Такие соединения проявляют кислотные свойства, например они реагируют с основаниями:
H2SO4 + 2KOH → K2SO4 + 2H2O
А есть элементы, образующие такие оксиды и гидроксиды, которые проявляют и кислотные, и основные свойства. Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Для начала, как определить является ли оксид или гидроксид амфотерным? Есть правило, немного условное, но все-таки пользоваться им можно:
Амфотерные гидроксиды и оксиды образуются металлами, в степенях окисления +3 и +4, например (Al2O3, Al(OH)3, Fe2O3, Fe(OH)3)
И четыре исключения: металлы Zn, Be, Pb, Sn образуют следующие оксиды и гидроксиды: ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, в которых проявляют степень окисления +2, но не смотря на это, эти соединения проявляют амфотерные свойства.
Свойства амфотерных соединений запомнить не сложно: они взаимодействуют с кислотами и щелочами .
Источник
Урок №46. Амфотерные оксиды и гидроксиды
Кислотный остаток (А)
со щелочами проявляет кислотные свойства:
H 2 ZnO 2 ↔ ZnO 2 ( II ) кислотный остаток — цинкат
со щелочами проявляет кислотные свойства:
HAlO 2 ↔ AlO 2 ( I ) кислотный остаток — метаалюминат
со щелочами проявляет кислотные свойства:
H 2 BeO 2 ↔ BeO 2 ( II ) кислотный остаток — бериллат
со щелочами проявляет кислотные свойства:
HCrO 2 ↔ CrO 2 ( I ) кислотный остаток — хромат
» jsaction=»rcuQ6b:WYd;»>
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Первоначальная классификация химических элементов на металлы и неметаллы является неполной. Существуют химические элементы и соответствующие им вещества, которые проявляют двойственную природу – амфотерные свойства , т.е. могут взаимодействовать как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами, например,
2Al(OH) 3 + 3SO 3 = Al 2 (SO 4 ) 3 + 3H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 3H 2 O
2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
Al 2 O 3 + 2NaOH = t°C = 2NaAlO 2 + H 2 O (при сплавлении)
Если реакция протекает в водном растворе: Al(OH) 3 + NaOH = Na[Al(OH) 4 ]
здесь AlO 2 (I) – одновалентный кислотный остаток метаалюминат
Так, гидроксид и оксид алюминия в реакциях (а) проявляют свойства основных гидроксидов и оксидов, т.е. реагируют с кислотными гидроксидом и оксидом, образуя соответствующую соль — сульфат алюминия Al 2 (SO 4 ) 3 , тогда как в реакциях (б) они же проявляют свойства кислотных гидроксидов и оксидов, т.е. реагируют с основными гидроксидом и оксидом, образуя соль — метаалюминат натрия NaAlO 2 .
Zn(OH) 2 + SO 3 = ZnSO 4 + H 2 O
ZnO + H 2 SO 4 = H 2 O + ZnSO 4
Zn(OH) 2 + Na 2 O = Na 2 ZnO 2 + H 2 O
Zn(OH) 2 + 2NaOH = Na 2 [Zn(OH) 4 ]
ZnO + 2NaOH = Na 2 ZnO 2 + H 2 O
здесь ZnO 2 (II) – двухвалентный кислотный остаток цинкат.
Оксиды и гидроксиды, которые способны реагировать и с кислотами, и со щелочами, называют амфотерными.
Химические элементы, которым соответствуют амфотерные оксиды и гидроксиды, обладают переходными химическими свойствами, не относящимися ни к металлам, ни к неметаллам, их называют амфотерными.
Амфотерность (от греч. Аmphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие. Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например,
Амфотерные гидроксиды практически нерастворимы в воде. Они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых валентность металла III, IV иногда II.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al 2 O 3 , SnO, SnO 2 , PbO, Sb 2 O 3 .
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН) 2 , Al(ОН) 3 , Рb(ОН) 2 и некоторые другие.
Оксиды и гидроксиды, в которых валентность металла III, IV, являются, как правило, амфотерными: Сг 2 O 3 и Cr(OH) 3 , Fe 2 O 3 и Fe(OH) 3 . Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например, ZnO и Zn(OH) 2 .
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ГИДРОКСИДОВ
(нерастворимы в воде)
1.Реагируют с кислотами: Zn(OH) 2 + 2HCl = ZnCl 2 + 2H 2 O
2.Реагируют со щелочами: Zn(OH) 2 + 2NaOH = Na 2 [Zn(OH) 4 ]
ПРИМЕНЕНИЕ
Из всех амфотерных гидроксидов наибольшее применение находит гидроксид алюминия:
· лекарственные препараты, приготовленные на основе гидроксида алюминия, врач назначает при нарушении кислотно-щелочного баланса в пищеварительном тракте;
· в качестве антипирена (средства для подавления способности гореть) вещество вводят в состав пластмасс и красок;
· путём разложения гидроксида алюминия в металлургии получают оксид алюминия (глинозём) — сырьё для получения металлического алюминия.
Товары, в производстве которых используется гидроксид алюминия: лекарственный препарат «Алмагель» и металлургический глинозём
Гидроксид цинка в промышленности служит сырьём для получения различных соединений этого металла, в основном — солей.
Источник
Химические свойства оксидов: основных, амфотерных, кислотных
Определения и формулы основных, амфотерных и кислотных оксидов были приведены ранее в уроке 6.
Характерные химические свойства основных оксидов: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:
Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:
В аналогичных условиях, например, оксид железа (II) с водой реагировать не будет, так как гидроксид железа (II) в воде нерастворим.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:
Кроме того, амфотерные оксиды могут взаимодействовать как с кислотными, так и с основными оксидами, например:
С водой амфотерные оксиды не взаимодействуют.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями, с образованием солей и воды или кислых солей, а также с водой, в том случае если образующаяся в ходе такой реакции кислота растворима в воде:
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:
Тренировочные задания
1. Оксид натрия взаимодействует с каждым из двух веществ:
1) серная кислота и вода
2) уксусная кислота и азот
3) оксид лития и фосфор
4) оксид бария и серная кислота
2. Оксид калия взаимодействует с
1) азотом и фосфором
2) водой и сульфатом натрия
3) серной кислотой и оксидом фосфора (V)
4) литием и хлоридом натрия
3. Оксид кальция взаимодействует с
1) оксидом кремния
2) оксидом углерода (II)
3) оксидом азота (II)
4) оксидом азота (I)
4. Оксид бария взаимодействует с каждым из двух веществ:
1) азотной кислотой и водой
2) уксусной кислотой и хлором
3) оксидом натрия и азотом
4) оксидом серы (IV) и кремнием
5. Оксид магния не взаимодействует с
1) соляной кислотой
2) серной кислотой
3) оксидом лития
4) оксидом кремния
6. Оксид кальция взаимодействует с каждым из двух веществ:
1) оксидом фосфора (V), водой
2) оксидом углерода (IV) и сульфидом натрия
3) оксидом магния и азот
4) кислородом и сульфатом натрия
7. Оксид кальция реагирует с
1) медью
2) фосфором
3) оксидом углерода (IV)
4) оксидом магния
8. Оксид натрия реагирует с
1) водой
2) сульфатом калия
3) нитратом железа (II)
4) оксидом азота (II)
9. Оксид бария реагирует с каждым из двух веществ:
1) оксидом азота (II) и хлором
2) азотной кислотой и водой
3) оксидом углерода (II) и железом
4) серой и хлоридом кальция
10. Оксид магния реагирует с каждым из двух веществ:
1) оксидом кальция и оксидом железа (II)
2) оксидом алюминия и оксидом хрома (II)
3) соляной кислотой и оксидом кремния (VI)
4) оксидом фосфора (V) и цинком
11. Оксид цинка
1) растворяется в кислотах, но не реагирует с основаниями
2) растворяется в щелочах, но не реагирует с кислотами
3) реагирует с оксидом натрия, но не реагирует с водой
4) реагирует с оксидом калия и водой
12. Оксид хрома (III) реагирует с
1) оксидом калия
2) водой
3) оксидом серы (VI)
4) оксидом азота (I)
13. Оксид алюминия амфотерен, поскольку он способен взаимодействовать
1) как с азотной, так и серной кислотой
2) с водой и кислотами
3) с водой и щелочами
4) как с кислотами, так и со щелочами
14. Оксид алюминия реагирует с
1) сульфатом калия
2) оксидом калия
3) оксидом азота (II)
4) оксидом углерода (IV)
15. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) оксидом лития и углекислым газом
2) водой и углекислым газом
3) водой и гидроксидом калия
4) кислородом и натрием
16. Оксид фосфора (V) взаимодействует с каждым из двух веществ:
1) кислородом и водородом
2) водой и углекислым газом
3) водой и гидроксидом натрия
4) водой и оксидом углерода (II)
17. Оксид серы (VI) не взаимодействует с
1) водой
2) хлоридом калия
3) гидроксидом натрия
4) оксидом бария
18. Оксид серы (IV) взаимодействует с
1) оксидом углерода (IV) и водой
2) оксидом фосфора (V) и водой
3) сульфатом калия и водой
4) оксидом кальция и гидроксидом натрия
19. Оксид серы (IV) не взаимодействует с
1) водой
2) фосфатом кальция
3) раствором гидроксида натрия
4) гидроксидом кальция
20. Оксид хлора (VII) взаимодействует с каждым из двух веществ:
1) кальцием и углекислым газом
2) водой и углеродом
3) водой и оксидом калия
4) кислородом и азотом
21. Установите соответствие между реагирующими веществами и продуктами реакций.
22. Установите соответствие между реагирующими веществами и продуктами реакций.
23. Установите соответствие между реагирующими веществами и продуктами реакций.
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + SiO2 →
Б) CaO + H3PO4 (разб.) →
В) CaO + HCl →
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + HCl →
Б) ZnO + NaOH ⎯⎯ H2O →
В) ZnO + Na2O ⎯⎯ сплавление →
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + H3PO4 →
Б) ZnO + NaOH + H2O →
В) ZnO + C →
27. Установите соответствие между реагирующими веществами и продуктами реакций.
28. Установите соответствие между реагирующими веществами и продуктами реакций.
29. Установите соответствие между реагирующими веществами и продуктами реакций.
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + H2S →
Б) SO2 (изб.) + NaOH →
В) SO2 + NaOH (изб.) →
31. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
32. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
33. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Источник