- Общая характеристика металлов главной подгруппы IА группы
- Физические свойства щелочных металлов
- Химические свойства
- 1. Взаимодействие с кислородом
- 2. Взаимодействие с галогенами
- 3. Взаимодействие с другими неметаллами (S, С, Si, Р)
- 4. Взаимодействие с водородом
- 5. Взаимодействие с водой
- 6. Взаимодействие с кислотами
- 7. Взаимодействие со спиртами и фенолами
- 8. Взаимодействие с галогеналканами (реакция Вюрца)
- 9. Замещение атомов водорода в гидридах неметаллов
- Способы получения
- 1. Электролиз расплавов солей или щелочей
- 2. Вакуум-термический способ
- Какие металлы реагируют с водой?
- Взаимодействие воды с металлами
- Как они взаимодействуют?
- Пример взаимодействие активных металлов с водой
- I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
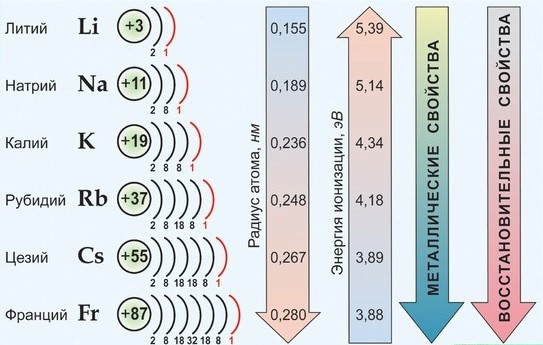
- Общая характеристика щелочных металлов
- Нахождение щелочных металлов в природе
- Способы получения щелочных металлов
- Химические свойства щелочных металлов
- Взаимодействие щелочных металлов с простыми веществами — неметаллами
- Взаимодействие щелочных металлов со сложными веществами
Общая характеристика металлов главной подгруппы IА группы
все атомы имеют крайне низкие величины энергии сродства к электрону и ЭО.
Элементы данной подгруппы имеют значительное сходство друг с другом, что обусловлено одинаковым строением внешнего электронного слоя атомов и аналогией в их важнейших характеристиках:
— атомы всех элементов на предвнешнем электронном слое имеют устойчивые 8-электронные конфигурации соответствующего благородного газа (у Li — оболочка Не);
— все атомы имеют очень низкие значения Eион и легко превращаются в катионы Me + ;
Физические свойства щелочных металлов
В чистом виде щелочные металлы представляют собой легкие, мягкие вещества серебристо-белого цвета на срезе, быстро тускнеющие на воздухе вследствие окисления (цезий имеет золотисто-желтый оттенок). Металлы отличаются высокой электро- и теплопроводностью.
Пары щелочных металлов интенсивно окрашены в различные цвета: Na — пурпурный, К — сине-зеленый, Rb — зеленовато-синий.
Щелочные металлы очень легкоплавки: Cs и Rb плавятся в руках; самый тугоплавкий Li имеет т. пл. 180°С. Плотность этих металлов также невелика — натрий и калий легче воды, а литий плавает даже в керосине.
Щелочные металлы хорошо растворяются в жидком аммиаке, полученные растворы имеют темно-синюю окраску (образуются коллоидные растворы).
Химические свойства
1. Взаимодействие с кислородом
Уже на воздухе щелочные Me немедленно окисляются, a Rb и Cs — самовоспламеняются
При повышении Т все металлы сгорают с образованием ослепительного пламени.
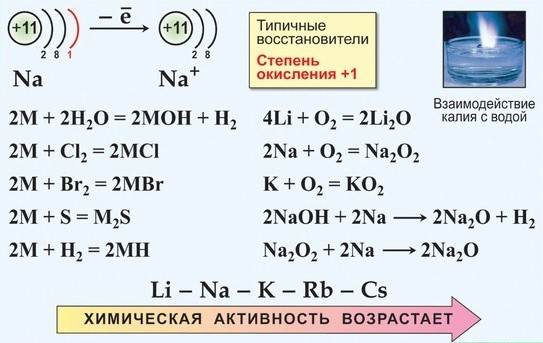
Все щелочные металлы очень химически активны, сильные восстановители:
С активными окислителями, водой и кислотами реакции протекают настолько бурно, что происходит самовоспламенение или взрыв. Часто реакции проводят в охлаждаемой среде. Реакции с неметаллами осуществляют в вакууме или в среде инертных газов.
а) только Li при горении образует нормальный оксид:
б) Na при горении образует бесцветный или слегка желтоватый пероксид
в) К, Rb и Cs сгорают с образованием окрашенных супероксидов:
г) К, Rb и Cs легко реагируют с озоном, образуя озониды:
2. Взаимодействие с галогенами
Соединение щел. Me с галогенами протекает очень бурно, часто в режиме горения, особенно с F2 и Cl2:
3. Взаимодействие с другими неметаллами (S, С, Si, Р)
а) все щел. Me реагируют с фосфором и серой (металлы предварительно нагревают):
2Na + S = Na2S сульфид натрия
3Na + Р = Na3Р фосфид натрия
б) с углеродом и кремнием реагирует непосредственно только литий:
2Li + 2С = Li2C2 карбид лития
4. Взаимодействие с водородом
Наиболее легко реакция протекает между водородом и предварительно слабо нагретым литием:
5. Взаимодействие с водой
6. Взаимодействие с кислотами
Реакции протекают очень энергично, даже со слабыми кислотами.
1) реакции с кислотами за счет восстановления ионов Н + :
2Na + 2HCl = 2NaCl + H2
2) реакции с кислотами за счет восстановления анионов:
3) реакции с органическими кислотами:
7. Взаимодействие со спиртами и фенолами
8. Взаимодействие с галогеналканами (реакция Вюрца)
9. Замещение атомов водорода в гидридах неметаллов
а) реакции с аммиаком расплавленных щелочных металлов:
б) реакции с ацетиленом и некоторыми его гомологами
2 Na + НС=СН → NaC =CNa + Н2
Способы получения
1. Электролиз расплавов солей или щелочей
2NaCI = 2Na + Cl2 (аналогично получают Li , К)
Выделение металлов происходит на ртутном, свинцовом или стальном катоде
2. Вакуум-термический способ
Металлы восстанавливают из расплавов их солей активными металлами:
Источник
Какие металлы реагируют с водой?
Прежде всего следует запомнить, что металлы делят в целом на три группы:
1) Активные металлы: к таким металлам относятся все щелочные металлы, щелочноземельные металлы, а также магний и алюминий.
2) Металлы средней активности: к таковым относят металлы, расположенные между алюминием и водородом в ряду активности.
3) Малоактивные металлы: металлы, расположенные в ряду активности правее водорода.
В первую очередь нужно запомнить, что малоактивные металлы (т.е. те, что расположены после водорода) с водой не реагируют ни при каких условиях.
Щелочные и щелочноземельные металлы реагируют с водой при любых условиях (даже при обычной температуре и на холоде), при этом реакция сопровождается выделением водорода и образованием гидроксида металла. Например:
Магний из-за того, что покрыт защитной оксидной пленкой, реагирует с водой только при кипячении. При нагревании в воде оксидная пленка, состоящая из MgO, разрушается и находящийся под ней магний начинает реагировать с водой. При этом реакция также сопровождается выделением водорода и образованием гидроксида металла, который, однако, в случае магния нерастворим:
Алюминий так же, как и магний, покрыт защитной оксидной пленкой, однако в этом случае кипячением ее разрушить нельзя. Для ее снятия требуются либо механическая чистка (каким-либо абразивом), либо ее химическое разрушение щелочью, растворами солей ртути или солей аммония:
Металлы средней активности реагируют с водой лишь тогда, когда она находится в состоянии перегретого водяного пара. Сам металл при этом должен быть нагрет до температуры красного каления (около 600-800 о С). В отличие от активных металлов, металлы средней активности при реакции с водой вместо гидроксидов образуют оксиды металлов. Продуктом восстановления и в этом случае является водород:
Fe + H2O = FeO + H2 (в зависимости от степени нагрева)
Источник
Взаимодействие воды с металлами
Вода обладает разнообразными свойствами. Она может замерзать. Превращаться в пар. С водой человек дружит с рождения. Помимо всего этого она так же может вступать во взаимодействие с металлом. Как? Читайте нашу статью, и Вы узнаете об этом! Вступая в контакт с жидкостью, металлы способны давать самые удивительные реакции! Например: чтобы насытить воду железом её настаивают несколько часов на железе, после чего употребляют во внутрь, а если бросить в стакан с водой щелочной металл то произойдет взрыв. Существует множество разнообразных металлов и каждый случай взаимодействия уникален! Проводите опыты, делайте собственные открытия, а посвятить Вас в основы взаимодействия воды с металлами поможет наша статья!
Как они взаимодействуют?
Взаимодействие металла с водой может происходить по разному, в зависимости от металла и воды. Каждый металл обладает своими неповторимыми особенностями. Так же, может показаться, что формулы очень сложные, однако со временем Вы легко научитесь их читать. Если алюминий, железо вступает в активные реакции с водой, то это значит что в нем присутствуют образующиеся соли. Он окисляется ионами водорода. Проследить это можно по формуле и записать в виде сокращенной формулировки Me + nH + → Me n+ + H2↑
Вступая в реакцию с водой, в исключительных ситуациях образуются гидроксиды. Очень активно в спокойных условиях вступают в реакцию с влагой щелочные металлы, например Литий (Li), натрий (Na) , Калий (К), Рубидий (Rb) , Цезий (Cs), Франций (FR).
Щелочные металлы вступают в очень бурную реакцию с водой. Отследить процесс взаимодействия металлов с водой можно по формулам:
NaH + HCl ® NaCl + H2

Активные металлы способны вступать во взаимодействие с водой при обычных условиях согласно схеме: 2Me + 2nH2O → 2Me(OH)n + nH2 .Итогом окисления как правило становится гидроксид Me(OH)n (где n-степень окисления металла).
Приведем пример: Ca + 2H2O → Ca(OH)2 + H2↑
Металлы же со средней степенью активности вступают во взаимодействие с водой при нагревании по схеме: 2Me + nH2O Me2On + nH2 . Итогом такой реакции становится появление оксида металла. Его формула — Me2On (где n-степень окисления металла) .
Пример взаимодействие активных металлов с водой
Металлы так же используют при изготовлении кухонной утвари. К примеру алюминиевая сковородка, металлический корпус чайника, лопасти блендера. Тут важна стойкость металла. Самой известной реакцией металла на воду является окисление самой обыкновенной стали на воздухе и в воде. Железо в таком случае разрушается, ржавеет. Происходящие при этом процессы являются весьма сложными и удивительным природным процессом. Если же окисление происходит в морской воде, то процесс ускоряется, этому способствует определенная концентрация соли находящаяся в составе воды.
Противостоять образованию ржавчины можно при использовании разнообразных лаков, призванных защитить от коррозии металла и перехитрить химические законы! Так же, вода вступая в реакцию с нагретым металлом способна образовывать накипь.
Это явление можно наблюдать на частях чайника сделанных из алюминия или стали, который давно не чистили. Такой чайник достаточно прокипятить с лимонной кислотой и он снова будет как новый!
Иногда образование накипи не связано с активными металлами, а имеет немного другую природу. В частности, накипь может появляться из-за солей жесткости в воде. В таком случае нужно купить качественный фильтр для жесткой воды.
Источник
I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
I группа главная подгруппа Периодической системы Менделеева представляет собой щелочные металлы. К щелочным металлам относят химические элементы:
Литий Li,
Натрий Na,
Калий K,
Цезий Cs,
Рубидий Rb
Франций Fr
Эти металлы очень активны, поэтому их хранят под слоем вазелина или керосина.
Общая характеристика щелочных металлов
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
Электронные конфигурации у данных элементов схожи, все они содержат 1 электрон на внешнем уровне ns 1 :
Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Нахождение щелочных металлов в природе
Способы получения щелочных металлов
Литий
- Литий получают в промышленности электролизом расплавахлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
- Известен также способ получения лития из его оксида в вакууме при 300°С:
Натрий
- Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
- Натрий можно получить, прокаливая соду с углем в закрытых тиглях, пары металла конденсируются на крышке тигля, выход реакции невысокий:
Калий
- Калий получают также электролизом расплавов солей или расплава гидроксида калия, однако на практике таким способом их не получают из-за высокой химической активности
- Наиболее распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов.:
KCl + Na = K + NaCl
KOH + Na = K + NaOH
В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний
Цезий, Рубидий
- Цезий и рубидий получают восстановлением их хлоридов специально подготовленным кальцием при 700–800 °С:
Са + 2CsCl → 2Cs + CaCl2
- В качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
- В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме
Химические свойства щелочных металлов
Качественные реакции — окрашивание пламени солями щелочных металлов
Цвет пламени:
Li — карминно-красный
Na — желтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Взаимодействие щелочных металлов с простыми веществами — неметаллами
С кислородом
- Литий образует оксид:
- Натрий образует пероксид:
- Калий образует надпероксид:
С галогенами (F, Cl, Br, I)
Щелочные металлы образуют галогениды:
С водородом
Щелочные металлы образуют гидриды:
С серой
Щелочные металлы образуют сульфиды:
С азотом
При комнатной температуре взаимодействует только литий:
Остальные щелочные металлы реагируют с азотом при нагревании:
С углеродом
Щелочные металлы при нагревании образуют карбиды, преимущественно ацетилениды:
С фосфором
Щелочные металлы активно реагируют с фосфором образуя фосфиды:
Взаимодействие щелочных металлов со сложными веществами
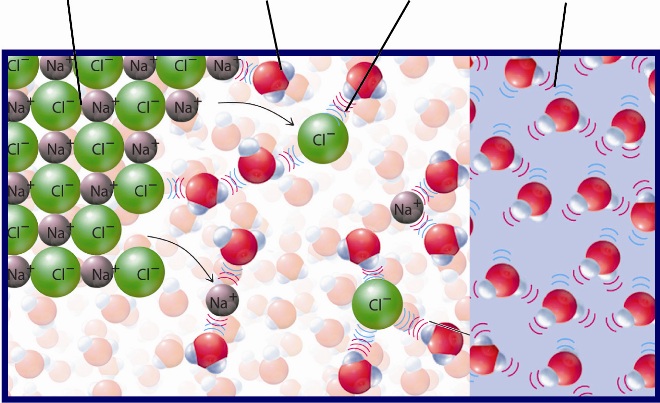
С водой
Щелочные металлы реагируют с водой при обычных условиях:
С кислотами
- С растворами HCl, H2SO4щелочные металлы взаимодействуют с образованием соли и выделением водорода:
с концентрированной серной:
с разбавленной азотной
с концентрированной азотной
- Со слабыми кислотами
С солями
В расплаве щелочные металлы могут взаимодействовать с некоторыми солями:
3Na + AlCl3 → 3NaCl + Al
Запомните! В растворе щелочные металлы взаимодействуют с водой, а не с солями других металлов.
Источник