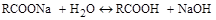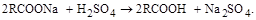Физико-химические свойства мыл и их водных растворов
а) Консистенция:
В зависимости от природы и свойств жирового сырья и жирозаменителей, щёлочи, а также содержания жирно-кислых солей в нём, получаемые мыла могут иметь твердую, мягкую или мазеобразную консистенцию.
Обычно, на основе твердых жирных кислот получают твердые мыла, на основе жидких жирных кислот – мягкие или мазеобразные.
При использовании в качестве щёлочи едкого кали или поташа (К2СО3) образуются мыла более мягкие, (т.е. при одинаковой природе кислотного радикала и концентрации солей жирных кислот в нём, такие мыла имеют меньшую температуру плавления). Данный эффект связан с тем явлением, что атомный радиус калия намного больше атомного радиуса натрия, что мешает более плотной упаковке молекул образующегося мыла в пространстве и приводит к аморфному (неупорядоченному) состоянию;
б) Температура плавления:
Чистые, абсолютно безводные мыла характеризуются весьма высокой температурой плавления, находящейся в пределах 225-270 0 С, зависящей от природы используемых жирных кислот и природы щелочного металла.
Присутствие в мыле воды снижает его температуру плавления и в тем большей степени, чем больше доля воды в нём. Например, хозяйственное 60% по содержанию жирнокислотных солей мыло (40% мас. влаги в нём), плавится уже при температуре ниже 100 0 С.
в) Плотность:
Плотность мыла зависит от степени упорядоченности его макромолекул (кристаллизации) в пространстве и обусловливается, содержанием в мыле солей жирных кислот, количества воды, природы щелочного металла, составом жировой основы, количеством электролитов в нём. Например, плотность 60% мыла при 90–95 0 С, в жидком состоянии равна 970 кг/м 3 . При наличии в мыле избытка электролитов, сверх допустимых значений – плотность его возрастает;
г) Гигроскопичность:
Мыла являются гигроскопичными продуктами. Причём, калиевые, в большей степени, чем натриевые; мыла на основе ненасыщенных жирных кислот, в большей степени, чем на основе насыщенных.
Этот показатель интересен тем, что поглощая влагу, мыло набухает, увеличиваясь в объёме, вплоть до полного растворения. Кроме того, процесс набухания сопровождается выделением соответствующего количества тепла, что в определённых условиях, при поглощении мыльной стружкой влаги или при хранении смеси сухой и влажной стружки мыла, может привезти к обугливанию и даже самовозгоранию, с большими негативными последствиями;
д) Растворимость в воде и спиртах:
Растворимость мыл в воде зависит от целого ряда факторов. Мыла на основе низкомолекулярных кислот растворяются в воде быстрее и в большей концентрации, чем мыла на основе высокомолекулярных жирных кислот. Растворимость в воде мыл на основе высокомолекулярных жирных кислот, в присутствии мыл на основе низкомолекулярных жирных кислот, растёт. Мыла на основе ненасыщенных жирных кислот растворяются лучше, чем мыла на основе насыщенных кислот.
Хорошей растворимостью в воде характеризуются мыла на основе нафтеновых и смоляных жирных кислот. Калиевые мыла обладают лучшей растворимостью, чем натриевые. С повышением температуры растворимость мыл в воде возрастает.
Что касается мыл тяжелых, щелочно-земельных металлов, то они в воде нерастворимы и их присутствие в товарном мыле недопустимо.
Мыла хорошо растворяются в спирте, особенно при повышенных температурах, образуя при этом истинные растворы.
В серном эфире, бензине, ацетоне и других органических растворителях мыла практически не растворяются. Зато кислые мыла наоборот – растворяются хорошо.
Такие органические вещества, как фенол, крезол, гексалин и другие хорошо растворяются в водных мыльных растворах, особенно с повышенной концентрацией мыла.
Мыла, будучи по своей природе, солями сильного основания и слабой органической кислоты, в водном растворе гидролизуются по схеме:
давая свободную щёлочь и слабую органическую кислоту. Именно это и обусловливает как электропроводность, так и щелочную реакцию водных мыльных растворов.
Одновременно, молекула жирной кислоты (если концентрация мыльного раствора не слишком мала), с молекулами негидролизованного мыла образует кислое мыло, по выше указанной схеме.
С повышением молекулярной массы жирной кислоты мыла, температуры раствора, с понижением концентрации мыльного раствора, гидролиз мыл усиливается. Причём, поскольку ненасыщенные жирные кислоты более сильные чем насыщенные, то гидролиз мыл на их основе протекает слабее.
Намного сильнее гидролизуются мыла на основе смоляных жирных кислот. Если в водный мыльный раствор вести щёлочь(в виде NaOH, Na2CO3, силиката натрия и др.), то уравнение процесса гидролиза мыла сдвигается влево, вплоть до полного подавления его.
Аналогично, снижает или полностью подавляет процесс гидролиза мыл введение в мыльные растворы этилового спирта, особенно в количестве более 60% мас.
е) Реакции разложения мыл:
Минеральные кислоты, как более сильные, разлагают мыла с выделением свободных жирных кислот по схеме:
Эту реакцию часто используют при разложении доомыленных соапстоков или грязных мыл с выделением жирных кислот и последующей их дистилляцией. Получаемые чистые жирные кислоты могут быть использованы даже для изготовления основы туалетных мыл.
Слабые кислоты, в частности угольная, при низкой температуре, частично разлагают натриевое мыло с образованием бикарбоната натрия и кислого мыла.
В горячих растворах такого разложения мыл не наблюдается.
Мыла могут вступать в реакции обменного разложения. В частности, калиевые мыла при обработке поваренной солью можно превратить в натриевые и наоборот.
Растворы солей тяжелых или щелочноземельных металлов вступают в реакции обменного разложения с обычными растворами мыл по схеме:
с образованием нерастворимых в воде щелочноземельных мыл.
и) Вязкость водных мыльных растворов:
Вязкость водных мыльных растворов снижается с повышением температуры и возрастает с повышением концентрации мыла вплоть до затвердевания. Введение в мыльные растворы небольшого количества электролитов способствует понижению вязкости, а большое количество приводит к изменению структуры водных клеевых мыльных растворов, повышению вязкости и последующей высолке мыла.
Источник
Как определить жесткость воды (ЧАСТЬ 2)
В прошлой статье мы рассказали:
- Как определить жесткость воды
- Как определить жесткость воды с помощью приборов
Как определить жесткость воды с помощью мыла
Этот способ был описан И. Шереметьевым. В его основе лежит трудность размыливания хозяйственного мыла в жесткой воде. Мыльная пена появляется в том случае, когда мыло свяжет избыток солей кальция и магния.
Определить жесткость воды этим способом можно таким образом: берем 1г хозяйственного мыла, измельчаем и постепенно, аккуратно, избегая появления пены, растворяем его в небольшом количестве горячей дистиллированной воды.
Полученный раствор переливаем в цилиндрический стакан, теперь в него нужно долить дистиллированной воды до уровня 6 см, если мыло 60 %,или до уровня 7 см, если мыло 72 % (этот процент указан на самом куске мыла). На каждый сантиметр имеющегося раствора приходится такое количество мыла, которое может связать соли жесткости, их содержится 1°dH на 1 л. воды. Теперь берем литровую банку и наполовину заполняем ее той водой, жесткость которой хотим определить. Затем при постоянном помешивании постепенно льем туда приготовленный раствор. Сначала будут видны только темные хлопья, а потом появятся цветные пузыри. Если образуется плотная белая пена, то это говорит о том, что все соли жесткости в исследуемой воде связаны. Теперь нужно посчитать, сколько сантиметров из приготовленного раствора мы вылили – каждый сантиметр связал в половине литра воды количество солей, соответствующее 2°dH, то есть если для получения пены пришлось добавить 4 см мыльного раствора, то жесткость исследуемой воды равна 8°dH.
В том случае если раствор уже закончился, а пены так и нет, мы имеем дело с жесткостью воды, превышающей 12°dH. Тогда, чтобы определить искомое значение, повторяем опыт, но исследуемую воду разбавляем дистиллированной водой в два раза. Тот результат, который получим в итоге повторного анализа, следует умножить на два, это и будет искомым показателем жесткости воды.
Обычные стаканы, как правило, имеют примерно такие параметры: объем – 200–250 мл, высота –10 см, нижний диаметр – 55 мм и более, верхний диаметр – 73 мм. Таким образом, его средний диаметр составляет примерно 63 мм. Наиболее точно определить жесткость воды у вас получится в том случае, если вы будете использовать химический цилиндрический стакан с диаметром около 6 см. Конечно, можно использовать и конусный стакан, но тогда погрешность будет большей. Хочется отметить, что абсолютной точности измерения от этого способа ждать не стоит, но точности 1–2 °dH вполне достаточно для определения состояния воды. Такая погрешность является в большей мере следствием разности верхнего и нижнего диаметров сосуда, в котором находится мыльный раствор, а также на нее влияют качество мыла, дистиллированной воды и ваш опыт осуществления данного анализа.
Этот метод очень простой и позволяет самостоятельно определить жесткость воды, поэтому такая небольшая погрешность при определении этого показателя не должна заставлять вас отказываться от его применения.
Как еще определить жесткость воды в домашних условиях
На самом деле определить жесткость воды несложно. Если вам нужно узнать точную цифру, вы всегда можете отнести пробу на анализ в лабораторию. Наиболее оптимальный способ определить жесткость воды – провести тест, используя реактив Трилон Б. Также возможно получить быстрые результаты, применив специальное оборудование, минимальная стоимость которого 10–15 у.е. Это небольшие деньги, если необходимо часто контролировать этот показатель дома.
Если у вас нет этого оборудования, но вам нужно прямо сейчас определить жесткость воды, можете воспользоваться следующим способом. Просто возьмите кусок мыла и умойтесь с ним – если пены нет и сушится кожа, при этом на лейке душа или в чайнике имеется налет, то вода жесткая. Если все наоборот, то вода мягкая или средней жесткости.
На самом деле существуют еще некоторые способы, которые позволят определить показатель жесткости:
- Наиболее доступный метод предполагает определить качество воды по внешнему виду и вкусу. В идеале она прозрачная, не имеет осадка и постороннего запаха.
- Чтобы определить, насколько вода чистая, ее нужно налить в прозрачный чистый стакан на 20 см и поставить на лист с текстом. Если сквозь воду текст получится прочитать, то этот показатель в норме.
- Цвет воды можно определить подобным образом, только налить нужно 100 мл воды в стакан и поставить его на белую бумагу. Если в воде присутствуют примеси органики, жидкость темнеет.
- По запаху можно определить чистоту жидкости. Нагрейте воду до 20°С, затем – до 60°С. Если вы замечаете неприятный гнилостный запах, значит, в ней есть примеси сероводорода.
- Вкус также позволяет определить некоторые качества. Для этого налейте воду в чистую посуду, прокипятите небольшой объем воды в течение пяти минут, после чего остудите до 20°С–25°С, теперь попробуйте. Сладковатый вкус свидетельствует о содержании в ней гипса, горький – соли магния, терпкий – соли железа. Гнилостный вкус появляется от попадания в воду растительных или животных организмов. Профильтровав, можно определить наличие твердых примесей, но предварительно воду нужно отстоять в течение некоторого времени.
- Попробуйте капнуть воду на стекло или зеркало. После того как жидкость испарится, изучите поверхность: если она осталась чистой – вода также чистая. Наличие пятен – явный признак плохого качества воды. Присмотритесь к аквариуму, если он у вас есть, его обитатели обычно очень чувствительны к качеству воды.
Вышеприведенные способы не позволят точно определить жесткость и качество воды, поэтому лучше всего обратиться к специалистам.
Если нужно определить жесткость воды для дома, дачи или коттеджа, лучше всего сделать анализ, так как количество магния и кальция может быть в ней любое в зависимости от множества факторов.
Вы потратите деньги на анализ, но будете точно знать, насколько эффективным окажется приобретённый фильтр.
Существует большое количество российских компаний, разрабатывающих системы водоочистки. Положившись только на себя, выбрать нужный фильтр затруднительно. Сделать дома очистную систему самим, даже если вы предварительно немного почитаете об этом, не будет достаточно эффективным способом очистки.
Надежнее обратиться в компанию по установке фильтров, которая предоставляет полный спектр услуг: консультацию специалиста, анализ воды из скважины или колодца, подбор подходящего оборудования, доставку и подключение системы. Кроме того, важно, чтобы компания предоставляла и сервисное обслуживание фильтров.
Статья была вам полезна? Помогите каналу , ставьте « палец вверх » и делитесь постом в соцсетях. Для нас это действительно важно .
Источник
Химическая правда о мыле
Все мы пользуемся мылом. А знаете ли что это такое, и как оно работает. Вот мы и решили «пролить» немного химии на ваши головы. Не пугайтесь, ничего сложного. Зато много полезного и познавательного.
Что такое «вымыть руки»? Если бы всё, что нас окружает, растворялось в воде (как, например, поваренная соль), то вымыть руки было бы очень легко – опустить их в воду и подождать чуть-чуть. К сожалению, большая часть веществ, к которым мы прикасаемся, нерастворимы в воде, и поэтому, если они прилипают к рукам или одежде, то одна вода не позволяет нам избавиться от этой грязи и пятен. Однако можно заставить любое вещество хотя бы через короткое время (несколько секунд) раствориться в воде, образовав эмульсию или суспензию – взвесь мельчайших частичек жидкого (или твёрдого) вещества в воде. Этого времени часто бывает достаточно для того, чтобы поток чистой воды смыл эмульгированную грязь, сделав руки чистыми. Мыло и служит прекрасным эмульгатором – химическим соединением, облегчающим получение водных эмульсий частичек самых различных веществ.
Как родилось мыло и как его делают сейчас? При раскопках Древнего Вавилона были найдены глиняные ёмкости, наполненные веществом, похожим на мыло. Надписи на этих сосудах гласили, что содержимое сделано при кипячении жира с пеплом. Поэтому считают, что варить мыло умели ещё в 2800-х гг. до н.э. Записи на папирусах, оставленные древними египтянами за 1500 лет до н.э., тоже сохранили рецепты мыловарения из смеси животных и растительных масел и пепла. Древние греки не знали мыла, а когда мылись, то сначала тёрли себя глиной, песком, пемзой и пеплом, потом наносили на тело растительное масло и соскребали его вместе с грязью. Одежду свою они мыли безо всякого мыла в проточной воде.
Английское слово soap (мыло) произошло от названия горы Sapo в Италии, на вершине которой, согласно легенде, приносили животных в жертву, убивая и сжигая их. Дождь смывал вниз в реку Тибр, протекающую неподалёку, смесь расплавленного жира и древесного пепла. Поэтому глина вдоль Тибра хорошо мылилась, что быстро оценили женщины, стиравшие бельё на его берегах.
До Второй мировой войны мыло варили кипячением в воде жирных масел со щелочами. Жиры – это соединения глицерина и органических кислот, известных как жирные кислоты. Во время кипячения жиров со щелочами образуются глицерин и соли жирных кислот, т.е. мыл. Использование мыла после Второй мировой войны пошло на убыль, его постепенно вытесняли синтетические моющие средства. Главная причина спада потребления мыла состояла в том, что в жёсткой воде образовывались нерастворимые соли жирных кислот, выпадающие в осадок и отвечающие за появление кольцевого пятна в ванне и серый оттенок белья. Синтетические моющие средства (детергенты) имеют такой состав, что этой реакции не происходит.
Что такое мыло? Мыло – это натриевая или калиевая соль одной из жирных кислот. Натриевые мыл более густые и, как правило, твёрдые; калиевые мыл более мягкие или жидкие. Молекула мыла представляет собой длинную цепочку (хвост), состоящую из десятка и более звеньев –CH2–, соединённых друг с другом, к одному концу которой (голове) прикреплена карбоксильная группа (–CO2). Простейшим мылом, например, является стеарат натрия, который можно представить формулой NaC17H35COO (жуть, правда?), где 17 атомов углерода с присоединёнными к ним атомами водорода вытянуты в извилистую цепочку. Асимметрия молекулы мыла – её важнейшее свойство. Голова молекулы в растворе заряжена отрицательно и поэтому притягивается к положительным полюсам диполей молекул воды или, как говорят, испытывает сродство к воде. Другой конец молекулы мыла электрически нейтрален и поэтому инертен по отношению к воде.
Вот так выглядит мыльная молекула стеарата натрия (а) и положение ионов этих молекул на поверхности плёнки воды (б):
Как мыло понижает поверхностное натяжение? Когда мыльная молекула стеарата натрия попадает в воду, то она диссоциирует на положительно заряженный ион Na+ и отрицательное основание жирной кислоты. Отрицательные ионы мыльных молекул выстраиваются так, чтобы с водой соприкасались лишь их головы, которые испытывают к ней сродство. Таким образом, на поверхности воды образуется двумерный «частокол» мыльных молекул, головы которых погружены в воду, а хвосты торчат наружу. Измерения показывают, что молекулы мыла на поверхности воды понижают её поверхностное натяжение почти в 2,5 раза. Происходит это из-за того, что, находясь на поверхности воды «головой вниз», они, во-первых, не стремятся внутрь и, во-вторых, отталкиваются друг от друга, а не притягиваются, как молекулы воды. Таким образом, увеличивать поверхность воды, если в ней растворено мыло, легче. А это значит, что жидкость может проникать в щели между нитями ткани. Другими словами, мыло делает воду «более мокрой», и «намыленные» капли воды легче пролезают в промежутки между нитями ткани.
Как работает мыло? Мыльный раствор обволакивает частицы грязи, приводя к образованию эмульсий различных загрязняющих веществ, и удерживает нерастворимые частицы в состоянии суспензии в мыльной пене и воде, которые могут быть потом удалены c очищаемой поверхности проточной водой. Для моющего действия важно то, что углеводородная часть (хвост) отрицательного иона мыльной молекулы нерастворима в воде, но растворима в жирах и маслах. Поэтому водорастворимая отрицательно заряженная голова остаётся в воде, тогда как хвост погружается в жир. Анионы молекул со всех сторон окружают капельки жира и вытаскивают их в воду, в результате чего образуется взвесь капелек жира в воде. Так как каждая из мельчайших капелек несёт на себе отрицательный заряд, то они отталкиваются друг от друга, а не сливаются в более крупные капли. Этим объясняется диспергирующий и эмульгирующий эффект мыльных растворов.
Почему горячая вода моет лучше? При нагревании средняя кинетическая энергия молекул воды растёт, а это значит, что каждой из них требуется меньше дополнительной энергии, чтобы выйти на поверхность. Поэтому коэффициент поверхностного натяжения воды уменьшается при нагревании, и она может проникать в самые мелкие поры и дырочки. Вот почему надо мыть руки горячей водой. Мыло и детергенты ещё больше понижают поверхностное натяжение горячей воды.
Почему мыло плохо стирает в морской воде? Морская вода характеризуется высоким содержанием двухвалентных катионов – Ca2+ и Mg2+. Эти катионы связываются с отрицательно заряженными головками мыльных молекул, мешая им образовать мицеллы вокруг частичек грязи и жира. Поэтому поверхностное натяжение мыльного раствора в морской воде увеличивается, что снижает качество стирки. То же происходит, когда в водопроводной воде высока концентрация двухвалентных ионов, например, железа. Такую воду называют «жёсткой», и мыло в ней стирает плохо.
Почему полоскать надо в холодной воде? Цель полоскания – убрать остатки мыла из выстиранной ткани. При стирке мы нагреваем воду, чтобы понизить поверхностное натяжение воды, поэтому мыльный раствор залезает в самые тонкие промежутки между волокнами ткани. Чтобы он вылез оттуда, необходимо повысить поверхностное натяжение, и тогда каждой из сплющенных капелек опять станет выгодно стать шарообразной, и они выскочат из тонких промежутков между нитями. Поэтому полоскать ткань после стирки следует в холодной воде, когда её поверхностное натяжение велико.
Надо ли использовать антибактериальное мыло? Мыльные молекулы обволакивают бактерии, как и частички прилипшей к коже грязи. Поэтому в мыльном растворе скоро оказывается большинство бактерий. Учёные доказали, что обычное мыло ничуть не хуже борется с бактериями, чем разрекламированное повсюду антибактериальное. В отличие от обычного антибактериальное мыло содержит химические препараты (антибиотики), убивающие бактерий. Однако именно это и является недостатком антибактериального мыла. Дело в том, что антибиотик не в состоянии убить абсолютно все бактерии, а оставшиеся в живых «супербактерии» обладают необычайно высокой стойкостью по отношению к данному антибиотику. Они начинают размножаться, и скоро на нашей коже появляется столько же бактерий, сколько было до мытья, но все эти бактерии являются «детками» супербактерий, поэтому многие их них переняли от своих родителей нечувствительность к действию этого антибиотика. В результате антибактериальное мыло скоро становится бесполезным, а супербактерии с кожи распространяются по всему организму, и бороться с ними нужно уже с помощью другого, более мощного антибиотика. В общем, «хотели, как лучше, а получилось…».
Что такое отбеливатель? В моющих средствах для стирки белья, помимо собственно детергента (мыла), используют ещё и отбеливатель. Отбеливатели не удаляют грязь, а лишь обесцвечивают её. Одни из них окисляют и тем самым разрушают некоторые виды загрязнителей и красящих веществ. Классическим окислителем для этих целей служит хлор. В современных стиральных порошках используют более избирательные отбеливатели на основе брома. Другие отбеливатели, называемые усилителями белизны, делают выстиранное белье буквально «белее белого». Для этого в стиральные порошки добавляют флюоресцирующий «бесцветный краситель», который обеспечивает не только полное отражение видимого света, но и частичное превращение ультрафиолетового света в белый или голубоватый. В результате ткань становится «ослепительно белой».
Источник