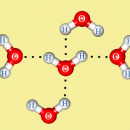
ГИДРАТНАЯ ВОДА
Словарь по гидрогеологии и инженерной геологии. — М.: Гостоптехиздат . Составитель: А. А. Маккавеев, редактор О. К. Ланге . 1961 .
Смотреть что такое «ГИДРАТНАЯ ВОДА» в других словарях:
ЦЕОЛИТНАЯ ВОДА — (гидратная вода) часть кристаллизационной воды, которая может выделяться и вновь поглощаться без разрушения кристаллической решетки минерала (см. Вода в минералах). Прямое удаление Ц. в. частично может быть осуществлено без нагревания в среде с… … Словарь по гидрогеологии и инженерной геологии
Известь гидратная — (пушонка) – тонкий порошок, состоящий из гидратной извести Са(ОН)2, получаемый в результате гашения комовой извести при ограниченном количестве воды. [Волженский А. В., Буров Ю. С., Колокольников В. С. Минеральные вяжущие вещества.… … Энциклопедия терминов, определений и пояснений строительных материалов
Дерево — деревянистое растение с очищенным от сучьев в нижней части стволом и кроной, или вершиной, образуемой из сучьев и ветвей в верхней части. Д. служит предметом садового, паркового и лесного хозяйства, причем сообразно с тем изменяется и уход за ним … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Дерево, материал — 1) Технические свойства. Техническими свойствами древесины должны быть называемы такие, от которых зависит большая или меньшая пригодность дерева для различных применений его в технике. Здесь будут рассмотрены важнейшие из таких свойств древесины … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Глина — (геологич.) весьма распространенная вторичная или обломочная горная порода, происшедшая от выветривания других горных пород, преимущественно заключающих в своем составе полевой шпат (см. Глина, техн. II. Образов. в природе). В чистом виде Г.… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Глина (технич.) — (франц. argile, нем. Thon, англ. clay) общеизвестное землисто порошковатое вещество, составляющее неизбежную составную часть поверхностного растительного слоя земли, образующее, в более или менее чистом виде или в смеси с песком (суглинки),… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Строительная гигиена — составляет часть так назыв. санитарной техники , задача которой заключается в эксплуатации всех научных и практических приобретений современной техники в интересах здоровья человека. В обширном смысле слова С. гигиена обнимает не только… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Гидратация — 1. Процесс связывания частиц растворимого в воде вещества с молекулами воды. Г. является частным случаем сольватации присоединения к веществам какого либо растворителя. Г. электролитов в растворах является главной причиной их диссоциации на ионы … Геологическая энциклопедия
Кислоты — (хим.) К. называется группа соединений с известной, довольно определенной химической функцией, которая резко выражена в таких типичных представителях этой группы, как серная К. H2SO4, азотная К. HNO3, соляная К. HCl и проч. Сделать характеристику … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Кислоты — (хим.). К. называется группа соединений с известной,довольно определенной химической функцией, которая резко выражена втаких типичных представителях этой группы, как серная К. H2SO4 азотнаяК. HNO3, соляная К. НСl и пр. Сделать характеристику их в … Энциклопедия Брокгауза и Ефрона
Источник
Большая Энциклопедия Нефти и Газа
Гидратная вода
Гидратная вода удаляется при 700, но температуру при прокаливании повышают до 1120, чтобы глинозем стал совершенно негигроскопичным. [2]
Гидратная вода иногда настолько прочно связана с растворенным веществом, что при выделении последнего из раствора входит в состав его кристаллов. Вода, входящая в структуру кристаллов других веществ, называется кристаллизационной. Состав кристаллогидратов обычно выражают, указывая при формуле вещества число молекул кристаллизационной воды, приходящееся на одну его молекулу. Подобно водному раствору сернокислой меди, кристаллогидрат этот имеет синюю окраску. [3]
Гидратная вода занимает при этом два противоположных угла октаэдра. Из небольшой разницы межатомных расстояний следует заключить, что обе молекулы воды принадлежат внутренней сфере комплекса. Таким образом, говоря точнее, речь идет о диакводиоксихинолинатах двухвалентных металлов. Когда это было возможно, мы приготовляли образующиеся при этом координационные соединения препаративно или определяли фотометрическим методом их стехиометрический состав в растворе. [4]
Гидратная вода содержится в минералах в непостоянном количестве; молекулы воды располагаются в свободном пространстве кристаллической решетки минерала. Так как они не участвуют в строении решетки, удаление воды не сказывается на структуре минерала, меняются лишь некоторые его физические свойства. Обезвоженные гидраты способны вновь поглощать воду с восстановлением прежних свойств. [5]
Гидратная вода иногда настолько прочно связана с растворенным веществом, что при выделении последнего из раствора входит в состав его кристаллов. Вода, входящая в структуру кристаллов других веществ, называется кристаллизационной. Состав кристаллогидратов обычно выражают, указывая при формуле вещества число молекул кристаллизационной воды, приходящейся на одну его молекулу. Подобно водному раствору сернокислой меди, кристаллогидрат этот имеет синюю окраску. [6]
Гидратная вода иногда настолько прочно связана с растворенным веществом, что при выделении последнего из раствора входит в состав его кристаллов. Вода, входящая в структуру кристаллов других веществ, называется кристаллизационной. Состав кристаллогидратов обычно выражают, указывая при формуле вещества число молекул кристаллизационной воды, приходящееся на одну его молекулу. Подобно водному раствору сульфата меди, кристаллогидрат этот имеет синюю окраску. [7]
Гидратную воду в перхлорате магния удобно определять путем измерения теплоты гидратации при растворении соли. Смит [91 ] помещал пробу соли массой 20 г, завернутую в фильтровальную бумагу, в сосуд Дьюара емкостью 300 мл, содержащий 75 мл воды. Сосуд встряхивали для ускорения растворения пробы и отмечали наибольшее повышение температуры А Т, линейно связанное с содержанием воды. [8]
Если гидратная вода сильно удерживается ионами, то из пересыщенных водных растворов выпадают не простые соли, содержащие только катион и анион, а так называемые кристаллогидраты. В них на каждый ион соли приходится строго определенное число молекул воды. В кристаллогидратах часто сохраняется первичная гидратная оболочка. Примерами могут служить А1С13 6Н2О, СгС13 6Н2О и MgCl2 6Н20, в кристаллических решетках которых каждый катион окружен шестью молекулами воды. [9]
Молекулы гидратной воды , адсорбированные на ионах, постоянно обмениваются с молекулами в объеме жидкости ( см. разд. Можно предположить, что обмен требует растяжения связи между ионом и адсорбированной на нем молекулой воды примерно на 0 8 А. Отношение энергии Ah, требуемой для растяжения этой связи, и энергии Aw влияет на первичную гидратацию. Если A / iiAiw, то молекула воды, адсорбированная на ионе, образует более сильную связь с ионом, чем с соседней молекулой воды; это явление, согласно Самойлову, можно назвать положительной гидратацией. При таких условиях соседние молекулы воды проводят в среднем больше времени у иона, чем в состоянии связи между собой. [10]
Выделение гидратной воды из гидрослюд, гипса, лимонита, каолинита, монтмориллонита и др. Эти минералы дегидратируются в основном в интервале температур 110 — 700 С. [11]
Количество гидратной воды дается для соли, высушенной на воздухе. [12]
При активации гидратная вода удаляется, а гидроокиси переходят в окиси. Помимо активации катализатора в контактных печах применяется также активация с помощью выносных активаторов. [13]
Большая часть гидратной воды в соединениях ВаО А12Оз — 6Н2О и ВаО А12О3 — 7Н2О является слабо связанной и удаляется при температуре ниже 140 — 150 С, что сопровождается распадом указанных гидратов и переходом в гидрат ВаО — А12О3 — Н2О, вода в котором имеет цеолитный характер связи. [14]
ОН-групп молекул гидратной воды зависит от числа доступных для водородной связи атомов кислорода таким образом, что это количество увеличивается по мере убывания числа акцепторов. [15]
Источник
Большая Энциклопедия Нефти и Газа
Гидратационная вода
Гидратационная вода называется связанной водой, в отличие от свободной воды, выполняющей функцию среды. На это обстоятельство в свое время обратили внимание Думанский, Гатчек и другие исследователи. [1]
Гидратационную воду можно определить как всю воду, которая измеримым образом оказывает влияние на белок или на которую влияет белок. [2]
Поскольку гидратационная вода должна увеличивать диаметр стержня в большей степени, чем его длину, следует ожидать, что отношение осей для гидродинамического стержня будет меньшим, чем для реальной частицы. Однако зависимость функций v и F от отношения осей такова, что уменьшение величины а / b в результате гидратации почти полностью компенсируется увеличением гидродинамического объема. [3]
Молекулы гидратационной воды находятся в постоянном обмене с молекулами свободной воды, и поэтому нерастворяющие свойства связанной воды в известной мере представляют условное понятие. Нерастворяющее пространство или объем зависит от природы веществ, обладающих сродством к воде. Таким образом, возникают липидные слои на границе белковой и водной фаз. [5]
Удаление прочно связанной гидратационной воды приводит к глубоким изменениям белков, и многие реакции белков можно объяснить, учитывая их гидратацию и изменение структуры воды. [6]
Так как гидратационная вода и другие адсорбирующиеся молекулярными ситами вещества могут быть удалены путем нагревания, то молекулярные сита можно легко регенерировать и реактивировать после их применения. Для этого рекомендуется нагревать их до температур 150 — 300 С. [8]
Не учитывается гидратационная вода . [9]
Знак Aq обозначает гидратационную воду , которая, очевидно, теряется при вступлении в переходное состояние. [10]
С уменьшением числа молекул гидратационной воды объем гидратированного иона уменьшается, оболочка сжимается и при известных условиях может наступить дегидратация. [12]
При нагревании гидраты теряют гидратационную воду и переходят в свою ангидридную форму. [13]
Эффект загущения связан с замещением гидратационной воды около борат-иона ОН-группами ПВС. [14]
Здесь для эффективной диэлектрической проницаемости гидратационной воды взято значение 10, а расстояние т от центра иона до центра водного диполя приравнено кристаллографическому ионному радиусу плюс 0 7 А. [15]
Источник
ГИДРАТАЦИЯ. ГИДРАТЫ. ГИДРОЛИЗ
ГИДРАТАЦИЯ. ГИДРАТЫ. ГИДРОЛИЗ. Гидратация (греч. «хюдор» – вода) – присоединение воды к ионам, атомам или молекулам. Продукты такого процесса называются гидратами. Гидролиз (греч. «лисис» – разложение, растворение) – химическая реакция разложения вещества водой.
В течение многих лет химики считали растворение веществ в воде чисто физическим процессом. И сейчас в школьных учебниках к таковым относят, например, растворение в воде сахара. Действительно, при испарении воды из раствора сахара при пониженном давлении легко получить исходное вещество в неизменном виде.
В то же время накапливались данные о том, что процесс растворения нельзя считать чисто механическим смешением компонентов, как, например, гексана и гептана. Так, растворы хлорида натрия и многих других соединений обладают электропроводностью, а сам процесс растворения нередко сопровождается значительными тепловыми эффектами (см. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ). Более того, некоторые соединения при растворении изменяют даже цвет. Например, сульфат меди бесцветный, а его разбавленный раствор – голубой, хлорид кобальта(II) голубой, а его водные растворы розовые. Все эти факты показывают, что растворение в воде – физико-химический процесс, вызванный гидратацией, то есть взаимодействием вещества с водой.
В ходе гидратации в ряде случаев происходит обратимое присоединение воды к ионам, атомам или молекулам растворяемого вещества с образованием гидратов. Так, при растворении в воде кристаллических ионных соединений (солей, щелочей, а также некоторых кислот, например, лимонной и щавелевой), молекулярных соединений (хлороводорода, серной кислоты, спирта, глюкозы и др.) происходит гидратация катионов и анионов, из которых состоит растворяемое вещество, либо гидратация ионов, образующихся в процессе растворения. При этом молекулы воды сохраняются как целое.
В процессе гидратации ионов участвует множество молекул воды, которые, благодаря электростатическим силам, окружают ионы со всех сторон гидратной «шубой», при этом лишь несколько молекул воды образуют первый, наиболее прочно связанный с центральным ионом слой. В целом же при гидратации ионов выделяется значительная энергия, так, при гидратации катионов Н + выделяется 1076 кДж/моль – это в 2,5 раза больше энергии диссоциации молекул Н2 на атомы. Энергия гидратации тем больше, чем меньше размер иона и чем больше его заряд. Например, энергия гидратации большого по размерам иона Cs + в 4 раза меньше, чем для иона Н + . Энергию гидратации ионов трудно определить экспериментально, но можно рассчитать на основании электростатических моделей. Энергии гидратации некоторых ионов приведены в таблице.
| Ион | Энергия гидратации, кДж/моль | Ион | Энергия гидратации, кДж/моль |
| H + | 1076 | Sr 2+ | 1477 |
| H3O + | 460 | Ba 2+ | 1339 |
| Li + | 502 | Zn 2+ | 2130 |
| Na + | 410 | Al 3+ | 4548 |
| K + | 329 | F – | 473 |
| NH4 + | 330 | Cl – | 330 |
| Rb + | 314 | Br – | 296 |
| Cs + | 264 | I – | 264 |
| Mg 2+ | 1887 | OH – | 339 |
| Ca 2+ | 1569 | MnO4 – | 247 |
Алгебраическая сумма энергии кристаллической решетки (или энергии разрыва связей) растворяемого вещества и энергии гидратации ионов определяет суммарный тепловой эффект растворения. В случае ионных соединений процесс может быть существенно экзотермическим (растворение в воде серной кислоты, гидроксидов натрия и калия может вызвать даже вскипание раствора), существенно эндотермическим (стакан с водой, в котором быстро растворяют нитрат аммония, примерзает к влажной подставке) или термонейтральным (растворение бромида натрия практически не сопровождается изменением температуры).
Гидратация многих безводных солей дозированным количеством воды (например, из газовой фазы) приводит к образованию твердых гидратов определенного состава, которые называются кристаллогидратами. Этот процесс всегда сопровождается выделением теплоты. Гидратация может быть ступенчатой, в зависимости от количества доступной воды и температуры. Одновременно может изменяться и цвет ионов. Например, при гидратации бесцветного сульфата меди(II) последовательно образуются различные окрашенные кристаллогидраты, из которых выделены в чистом виде моногидрат CuSO4·H2O, тригидрат CuSO4·3H2O и пентагидрат (медный купорос) CuSO4·5H2O. В разбавленных растворах присутствуют cине-зеленые гидраты – аква-ионы Cu(OH)6 2+ . Потеря воды розовым аква-ионом Со(Н2О)4 2+ приводит к появлению синей окраски.
При кристаллизации многих солей из их водных растворов молекулы воды входят в состав кристаллической решетки с образованием кристаллогидратов различного состава, например, LiCl·H2O, CuCl2·2H2O, Ba(ClO4)2·3H2O, CdBr2·4H2O, Na2S2O3·5H2O, AlCl3·6H2O, FeSO4·7H2O, MgI2·8H2O, Fe(NO3)3·9H2O, Na2SO4·10H2O, Na2HPO4·12H2O, Al2(SO4)3·18H2O и др. При нагревании, а также при хранении на воздухе (особенно при низкой влажности) многие кристаллогидраты выветриваются, теряя частично или полностью молекулы воды.
Гидратация молекулярных соединений происходит обычно за счет водородных связей и, как правило, не сопровождается существенным тепловым эффектом. Примером может служить растворение сахара. Молекулы воды легко образуют водородные связи с гидроксильными группами, поэтому даже вещества с большими молекулами хорошо растворяются в воде, если содержат много гидроксильных групп (сахароза, поливиниловый спирт). Соединения с небольшими полярными молекулами также легко гидратируются полярными молекулами воды, поэтому такие соединения обычно хорошо растворяются в воде. Примером может служить ацетонитрил СН3CN, который смешивается с водой в любых отношениях.
Необычные гидраты с некоторыми соединениями образует вода, находящаяся в твердом состоянии. В этих гидратах атомы, молекулы ряда веществ включаются в пустоты кристаллической решетки льда. Эти пустоты могут заполняться небольшими молекулами, такими как О2, N2, H2S, СН4, атомами благородных газов. Такие соединения «без химической связи» называют газовыми гидратами. Другие их название – клатраты (соединения включения). Отсутствие химических связей приводит к самым необычным соотношениям молекул воды и включенного вещества. Например, при низких температурах устойчивы соединения, содержащие на 46 молекул Н2О восемь атомов аргона, криптона, ксенона или радона. А вот маленькие атомы гелия и неона таких клатратов не образуют, так как они «ускользают» из слишком больших для них пустот. Клатрат состава Сl2·8H2O получил еще Дэви в 1811 из насыщенного при 0° С водного раствора хлора.
Клатраты, образованные водой и метаном, а также другими газами, часто называют газовыми гидратами. Внешне они похожи на снег или рыхлый лет, но под давлением могут существовать и при плюсовых температурах. Поэтому газовые гидраты могут закупорить газопровод и привести к аварии. Гидраты метана широко распространены в природе, в особенности на шельфе океанов; запасы природного газа в виде газовых гидратов значительно превышают его запасы в свободном состоянии.
Гидратация как химическое взаимодействие с водой может сопровождаться разрушением молекул воды, в этом случае происходит необратимая химическая реакция, которую обычно называют гидролизом – разложением водой. Реакции гидролиза известны как в неорганической, так и в органической химии. Примерами гидролиза неорганических соединений могут служить следующие процессы:
Гидролиз солей, образованных сильным основанием (щелочью) и слабой кислотой или слабым основанием и сильной кислотой сопровождается изменением кислотности среды: Na2S + H2O ® NaHS + NaOH, AlCl3 + H2O ® Al(OH)Cl2 + HCl. В случае таких солей как Al2S3 (их можно получить только сухим путем) гидролиз идет до конца с выделением гидроксида металла и слабой кислоты.
В органической химии реакции гидролиза сопровождаются либо разрушением органической молекулы (гидролиз сложных эфиров, белков): CH3COOC2H5 + H2O ® CH3COOH + C2H2OH, либо заменой в молекуле какой-либо группы на остаток молекулы воды, обычно гидроксил (гидролиз алкилгалогенидов): C2H5Br + H2O ® C2H5OH + HBr. В обоих случаях гидролизу способствует присутствие щелочи, которая связывает выделяющуюся кислоту. В случае белков и других биологически активных молекул реакцию гидролиза направляют в нужном направлении специальные ферменты – гидролазы. Например, фермент амилаза способствует гидролизу крахмала; фермент трипсин направленно гидролизует в белках пептидные связи, образованные аминокислотами аргинином и лизином.
Примерами реакции гидратации в органической химии может служить каталитическая гидратация алкенов с образованием спиртов:
Реакции гидратации широко используются в промышленном органическом синтезе. Например, каталитической гидратацией из этилена получают этиловый спирт, из пропилена – пропиловый спирт, из ацетилена – уксусный альдегид, из метилацетилена – ацетон. Реакция гидратации с образованием гидратов является ключевой при формовании изделий из гипса, при «схватывании» цемента. Образование газовых гидратов используют для разделения многокомпонентных газовых смесей. Наличие запасов гидратов метана в недрах Земли перспективно для будущей добычи природного газа. Реакции гидролиза широко используются в лабораторной практике и в промышленности. Гидролизом целлюлозы получают называемый гидролизный этиловый спирт, гидролизом сахарозы – глюкозу и фруктозу, гидролизом жиров – глицерин и соли карбоновых кислот – мыла. Ферментативный гидролиз органических соединений широко применяется в пищевой, текстильной и фармацевтической промышленности.
Источник