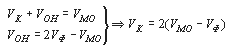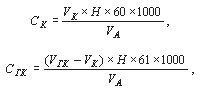Что такое карбонатная вода
Как отмечалось выше (в разделе «Щелочность и кислотность»), карбонаты и гидрокарбонаты представляют собой компоненты, определяющие природную щелочность воды. Их содержание в воде обусловлено процессами растворения атмосферной СО2, взаимодействия воды с находящимися в прилегающих грунтах известняками и, конечно, протекающими в воде жизненными процессами дыхания всех водных организмов.
Определение карбонат- и гидрокарбонат-анионов является титриметрическим и основано на их реакции с водородными ионами в присутствии фенолфталеина (при определении карбонат-анионов) или метилового оранжевого (при определении гидрокарбонат-анионов) в качестве индикаторов. Используя эти два индикатора, удается наблюдать две точки эквивалентности: в первой точке (рН 8,0–8,2) в присутствии фенолфталеина полностью завершается титрование карбонат-анионов, а во второй (рН 4,1–4,5) – гидрокарбонат-анионов. По результатам титрования можно определить концентрации в анализируемом растворе основных ионных форм, обуславливающих потребление кислоты (гидроксо-, карбонат- и гидрокарбонат-анионов), а также величины свободной и общей щелочности воды, т.к. они находятся в стехиометрической зависимости от содержания гидроксил-, карбонат- и гидрокарбонат-анионов. Для титрования обычно используют титрованные растворы соляной кислоты с точно известным значением концентрации – 0,05 моль/л либо 0,1 моль/л.
Определение карбонат-анионов основано на реакции:
Присутствие карбонат-аниона в концентрациях, определяемых аналитически, возможно лишь в водах, рН которых более 8,0–8,2. В случае присутствия в анализируемой воде гидроксо-анионов при определении карбонатов протекает также реакция нейтрализации:
Определение гидрокарбонат-анионов основано на реакции:
Таким образом, при титровании по фенолфталеину в реакции с кислотой участвуют анионы ОН– и СО32–, а при титровании по метиловому оранжевому – ОН – , СО3 2– и НСО3 – .
Величина карбонатной жесткости рассчитывается с учетом эквивалентных масс участвующих в реакциях карбонат- и гидрокарбонат-анионов.
При анализе карбонатных природных вод правильность получаемых результатов зависит от величины потребления кислоты на титрование по фенолфталеину и метилоранжу. Если титрование в присутствии фенолфталеина обычно не вызывает трудностей, т.к. происходит изменение окраски от розовой до бесцветной, то в присутствии метилового оранжевого, при изменении окраски от желтой до оранжевой, определить момент окончания титрования иногда довольно сложно. Это может привести к значительной ошибке при определении объема кислоты, израсходованной на титрование. В этих случаях, для более четкого выявления момента окончания титрования, определение полезно проводить в присутствии контрольной пробы, для чего рядом с титруемой пробой помещают такую же порцию анализируемой воды (во второй склянке), добавляя такое же количество индикатора.
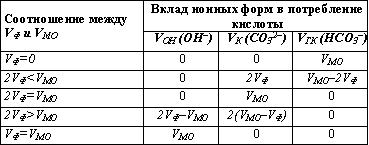
В результате титрования карбоната и гидрокарбоната, которое может выполняться как параллельно в разных пробах, так и последовательно в одной и той же пробе, для расчета значений концентраций необходимо определить общее количество кислоты в миллилитрах, израсходованной на титрование карбоната (VK) и гидрокарбоната (VГК). Следует иметь в виду, что при определении потребления кислоты на титрование по метилоранжу (VМО) происходит последовательное титрование и карбонатов, и гидрокарбонатов. По этой причине получаемый объем кислоты VМО содержит соответствующую долю, обусловленную присутствием в исходной пробе карбонатов, перешедших после реакции с катионом водорода в гидрокарбонаты, и не характеризует полностью концентрацию гидрокарбонатов в исходной пробе. Следовательно, при расчете концентраций основных ионных форм, обуславливающих потребление кислоты, необходимо учесть относительное потребление кислоты при титровании по фенолфталеину (VФ) и метилоранжу (VМО). Рассмотрим несколько возможных вариантов, сопоставляя величины VФ и VМО.
VФ = 0. Карбонаты, а также гидроксо-анионы в пробе отсутствуют, и потребление кислоты при титровании по метилоранжу может быть обусловлено только присутствием гидрокарбонатов.
VФ
VФ = VМО. В исходной пробе отсутствуют и карбонаты, и гидрокарбонаты, и потребление кислоты обусловлено присутствием сильных щелочей, содержащих гидроксо-анионы.
Присутствие свободных гидроксо-анионов в заметных количествах (случаи 4 и 5) возможно только в сточных или загрязненных водах.
Массовые концентрации анионов (не солей!) рассчитываются на основании уравнений реакций потребления кислоты карбонатами (СК) и гидрокарбонатами (СГК) в мг/л по формулам:
где:
VК и VГК – объем раствора соляной кислоты, израсходованный на титрование карбоната и гидрокарбоната соответственно, мл;
Н – точная концентрация титрованного раствора соляной кислоты (нормальность), моль/л экв.;
VА – объем пробы воды, взятой для анализа, мл;
60 и 61 – эквивалентная масса карбонат- и гидрокарбонат-аниона соответственно, в соответствующих реакциях;
1000 – коэффициент пересчета единиц измерений.
Результаты титрования по фенолфталеину и метилоранжу позволяют рассчитать показатель щелочности воды, который численно равен количеству эквивалентов кислоты, израсходованной на титрование пробы объемом 1 л. При этом потребление кислоты при титровании по фенолфталеину характеризует свободную щелочность, а по метилоранжу – общую щелочность, которая измеряется в ммоль/л. Показатель щелочности используется в России, как правило, при исследовании сточных вод. В некоторых других странах (США, Канаде, Швеции и др.) щелочность определяется при оценке качества природных вод и выражается массовой концентрацией в эквиваленте СаСО3.
Следует иметь в виду, что, при анализе сточных и загрязненных природных вод, получаемые результаты не всегда корректно отражают величины свободной и общей щелочности, т.к. в воде, кроме карбонатов и гидрокарбонатов, могут присутствовать соединения некоторых других групп (см. «Щелочность и кислотность»).
Оборудование и реактивы
Пипетка на 2 мл или на 5 мл, мерный шприц с наконечником и соединительной трубкой; пипетка-капельница; склянка с меткой «10 мл».
Раствор индикатора метилового оранжевого (0,1%) водный; раствор индикатора фенолфталеина; раствор соляной кислоты титрованный (0,05 моль/л).
Приготовление растворов см. приложение 3.
Выполнение анализа
А. Титрование карбонат-аниона
 | ||||||||||||||||||
 | ||||||||||||||||||
 | ||||||||||||||||||
 | |||||||||||||||
 | |||||||||||||||
 | |||||||||||||||
| Состав исходной воды | Вид жесткости | Способ определения жесткости воды | |
| катионы кальция | анионы магния | ||
| Са | С плюсом | Карбонатная или некарбонатная | Химический анализ |
| Са | Постоянная или временная | Тест-полоска для определения жесткости | |
| Са Временная, карбонатная и в малой | Специализированная лаборатория | ||
Если вы пренебрегли каким либо способом, приведённым в таблице, вы можете лишиться своего дорогостоящего оборудования. Каждый из приведенных в таблице способов определения карбонатной жесткости воды крайне важен!
Во-первых, ухудшается работа любого оборудования или бытового прибора. КПД резко идет вниз. Из-за того, что накипь плохо нагревается, приходится расходовать в разы больше топлива, электричества, мощности с целью хоть как то нагреть воду. Для промышленности такая особенность накипи выливается в огромные расходы. Прибор постепенно покрывается накипью, пока поверхность практически полностью прекращает передавать тепло воде. Тогда срабатывает система защиты. Прибор самопроизвольно отключается, с целью защитить себя от перегрева. Получив такой сигнал, приступить к очистке поверхностей следует немедленно.
.jpg)
Возиться с постоянным устранением налета, особенно в промышленности чрезвычайно накладно. Существует ряд способов, как справиться с повышенной жесткостью воды не повредив всю систему. Средства от накипи не дешевые. Как и вызов бригады для очистки. Подвергать таким нагрузкам поверхности постоянно тоже нельзя. Какой же путь избрать? Как наиболее эффективно бороться с карбонатной жесткостью воды?
Сразу скажу, что определение карбонатной жесткости воды в домашних условиях невозможно. Единственный, так сказать, кустарный вариант доступен только для очищения очень малого количества воды. И это вода будет скорее лечебной, чем просто умягченной. Многие ведь считают, что умягчители воды – дорогое удовольствие. Сегодня, к счастью это не так. Грамотность населения и просвященность в сфере очистки воды с каждым годом растет и потому между производителями фильтров для воды увеличивается конкуренция. И в ценах на подобные очистительные приборы наметилась положительная динамика к снижению.
Но вернемся к определению карбонатной жесткости воды в домашних условиях. Единственный материал, который позволит вам действительно получить качественную воду, это кремний. Все, что вам для этого нужно, это купить кусочек кремния и настоять на нем воду в течении недели. Вода получается мягкой, еще и снабженной всевозможными полезными веществами. Все полезные свойства кремния еще не изучены до конца, в будущем его планирует плотно использовать медицина. Но для очищения воды в домашних условиях, его достаточно, только для небольших обьемов.
Если же вы хотите поставить определение жесткости воды на поток, то вам нужен не просто умягчитель, вам нужна водоподготовка. Обойтись одним фильтром проблематично. Вода для быта и вода для потребления несколько разные инстанции и требования к качеству немного отличаются.
Для максимальной защиты предприятия или семьи дома потребуется, как минимум два умягчителя воды. Причем один должен чистить всю воду, априори. Другой будет проводить дополнительную очистку, которая поможет получить качественную питьевую воду. Для общих целей больше всего подходят, да и их чаще всего, и используют ионообменный фильтр для воды и электромагнитный умягчитель воды АкваЩит. Для получения вкусной питьевой воды лучше всего подойдет обратный осмос или фильтр-кувшин. Если уж совсем экономично.
Для специальной очистки, которая нужна в той же фармакологии или микроэлектронике используют микро или нанофильтрацию. Из последовательного соединения всех этих приборов и складывается водоподготовка. Часто, когда обрабатывают первичную воду, такую систему дополнительно оснащают механическими фильтрами, обеззараживателями, кондиционерами и обезжелезивателями. Тогда чистка идет сто процентная. От А до Я.
В быту из всех фильтров больше всего сегодня помогают избавиться от карбонатной жесткости воды электромагнитные приборы АкваЩит. Еще совсем недавно самыми прогрессивными очистителями считались магнитные устройства. Но в процессе эксплуатации было выявлена уйма недостатков, которые очень быстро привели к закату «звезды» магнитного устройства. Тогда собственно и изобрели электромагнитный прибор, как улучшенный вариант магнита.
Ионообменный фильтр хоть и считается одним из самых старых способов понижения жесткости воды, но тем не менее сегодня по прежнему занимает лидирующие позиции. Хотя в работе он довольно затратный. Его фильтрующая смола после полного забивания солями жесткости требует замены или восстановления. Стоит сменный картридж не то, чтобы дорого, но и не дешево. Менять при этом фильтр приходится раз в квартал.
Как вычислить карбонатную жесткость воды?
Теперь зададимся вопросом: как вычислить карбонатную жесткость воды? Вот лишь несколько способов, как это можно сделать:
- Сделать химический анализ на жесткость;
- Отдать исходную воду в лабораторию;
- Купить специальный тест-полоску, которая покажет точную жесткость питьевой воды;
- Обратиться к специалистам за помощью в определении жесткости воды.
Если это крупное промышленное предприятие, вычислить жесткость воды можно и иными способами. Смолу придется восстанавливать путем постоянных промывок с помощью сильносоленого раствора. Потом появляются проблемы с устранением отходов, которые к тому же сильно соленные и требуют доочистки для утилизации. Но умягчает воду такой прибор намного лучше любых других. Как эконом вариант, этот прибор для вычисления карбонатной жесткости необходим и незаменим.
Электромагнитный прибор заслужил море комплиментов при использовании в быту, а также на предприятиях теплоэнергетики. У него масса плюсов, которые выгодно выделяют его из основной массы умягчителей.
Вычислить карбонатную и некарбонатную жесткость воды можно по следующей формуле Ca 2+ + 2HCO 3 — = CaCO 3 ↓ + H 2 O + CO 2 ↑ или же такой H + + HCO 3 — H 2 CO 3 CO 2 + H 2 O
При всей компактности и удобстве, электромагнитный прибор в состоянии не просто связать карбонатную жесткость воды, он отлично поможет избавиться от старой накипи, застрявшей на стенках. И сделает это крайне осторожно и очень качественно. Достаточно проработать прибору месяц, как слой накипи на стенках уменьшиться значительно. Вам даже достаточно будет замерить слой накипи перед установкой прибора и спустя месяц. Разница будет ощутимой. И при этом за месяц, вам к прибору даже не придется притрагиваться. Полное отсутствие обслуживания также является немаловажным плюсом данного прибора для вычисления жесткости воды. И никакого привыкания к влиянию электромагнитных волн.
Акващит прекрасно сотрудничает с любыми поверхностями, ему не важно, из чего сделаны трубы, а также все равно с какой скоростью течет вода и холодная она, или горячая. Не работает такой прибор только с неподвижной водой. АкваЩит прекрасно уменьшает жесткость воды не меняя химический состав жидкости. Но поскольку он сам устраняет осадок, то стоячая вода ему не страшна.
При монтаже прибора следует помнить, что ставить его нужно только на чистую внутри трубу. С остатками старой накипи прибор справится, а вот сразу пробиться через нее не сможет. Поэтому место установки следует обязательно чистить.
Мы рассмотрели все варианты классификаций карбонатной жесткости воды, а также узнали как вычислить и как определить карбонатную жесткость. С нею сегодня есть масса возможностей справится. При этом достаточно недорогих. Так, что с целью защитить себя от вредного влияния некачественной воды лучше продумайте варианты установки системы подготовки воды заранее.
Источник