Сверхкритическая вода
кандидат химических наук В. Благутина
Сверхкритическая вода
С недавних пор сверхкритические (флюидные) технологии стали весьма популярны. На Западе их используют для чистки белья, очистки сточных вод и металлов, в пищевой и фармацевтической промышленности, — для экстракции душистых веществ, в синтезе полимеров и даже для производства мелкодисперсных порошков. Это позволяет сократить технологическую цепочку, а значит, снизить стоимость продукции и услуг. Но главное — это экологически чистые процессы. Первое промышленное производство, применяющее сверхкритические флюиды, заработало в 1978 году — это была установка по декофеинизации кофе, за ним в 1982 году последовала промышленная экстракция хмеля (для пивоваренной промышленности). Сегодня на Западе довольно много предприятий работает по этой прогрессивной технологии.
Наиболее популярные сверхкритические флюиды — углекислый газ, вода, пропан, аммиак и некоторые другие соединения с невысокими критическими температурами. Чаще всего используют сверхкритический углекислый газ, поскольку он нетоксичен, дёшев, легко доступен и имеет удобные параметры (Tс = 31°C, Pс = 7,38 МПа). У нас таких предприятий почти нет (НИЦ ЭР „ГОРО» — пожалуй, единственное исключение).
Впрочем, научные исследования у нас продолжаются, специализированные конференции проводятся, в 2005 году был даже создан Консорциум организаций в области сверхкритических флюидных технологий (Консорциум СКФТ). С октября 2006 года начал выходить специализированный журнал „Сверхкритические флюиды: теория и практика».
Краткий экскурс в историю
Сверхкритическую воду систематически исследуют с начала прошлого века. Однако сегодня эти работы привлекательны не только с теоретической точки зрения. Есть надежда, что самый распространённый, дешёвый, безопасный и экологически чистый растворитель займет свою уникальную нишу в химической промышленности. (Конечно, речь не об обычной воде.)
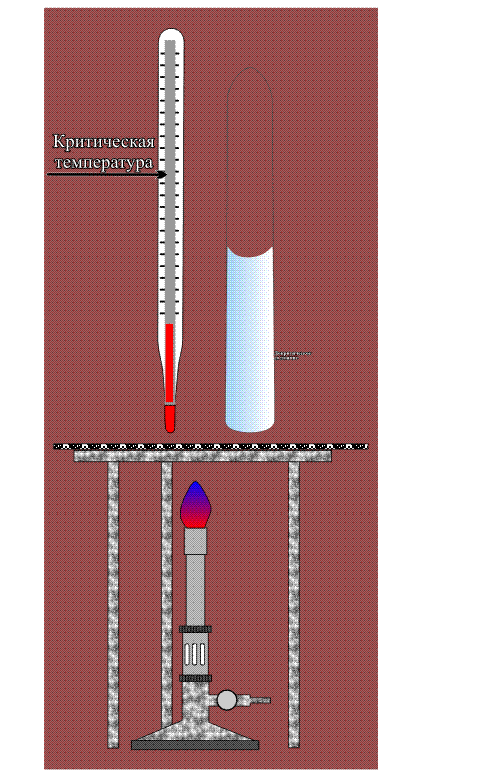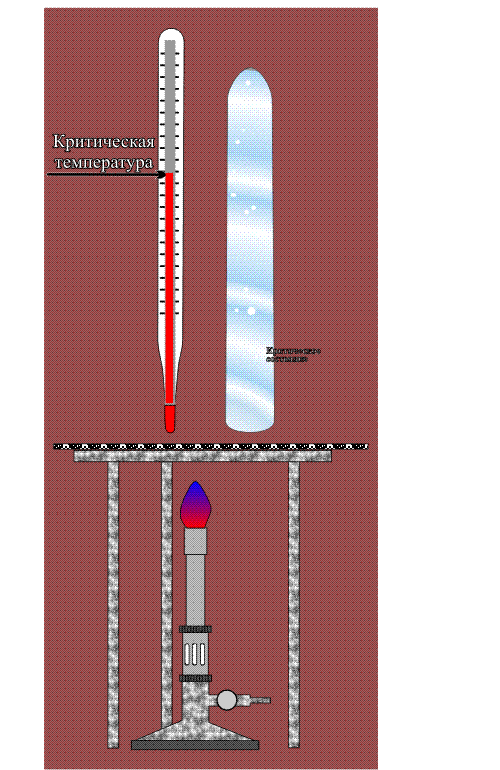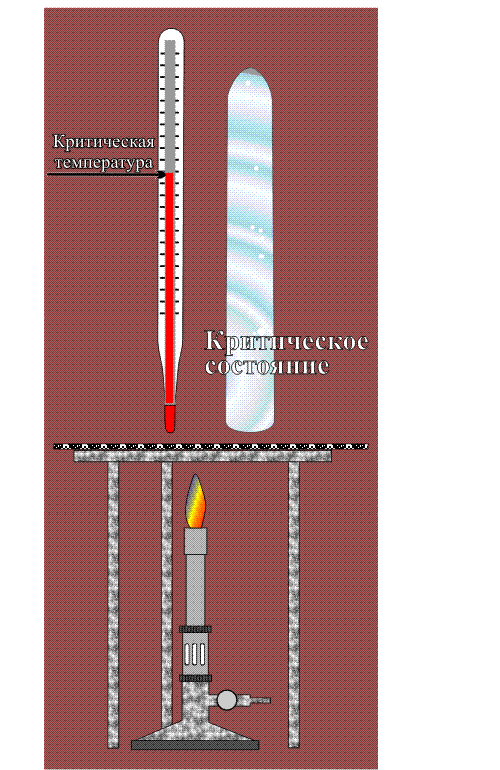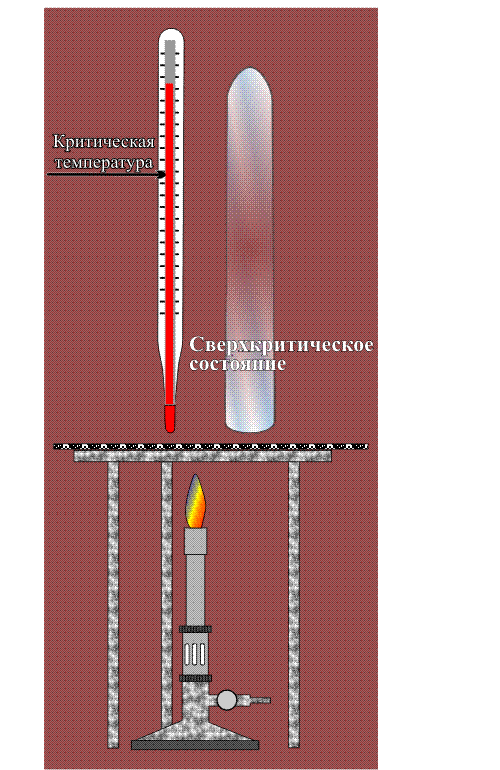
Сверхкритические состояния первым начал изучать Каньяр де ля Тур в 1822 году. Если любую кипящую жидкость (когда существует равновесие между жидкостью и паром) продолжать нагревать и увеличивать давление, то в какой-то момент плотности жидкости и пара становятся одинаковыми, а граница раздела между этими фазами исчезает. В этой критической точке вещество переходит в промежуточное состояние — становится не газом и не жидкостью. При температуре выше критической точки уже двух фаз не получится, хотя если этот однородный флюид сжимать, то его плотность будет меняться от газоподобного к жидкоподобному. При меньших температурах вода находится в докритическом состоянии, а при изменении давления её плотность меняется скачком: жидкость переходит в пар. Выше — в сверхкритическом, вещество однородно, а плотность меняется непрерывно.
В XIX веке химия сверхкритических сред развивалась довольно медленно, и только к концу века вышел первый обзор на эту тему. Во второй половине XX века учёные стали всерьёз задумываться об экологической безопасности и повышении эффективности химических производств и потому заинтересовались веществами в сверхкритическом состоянии (их называют флюидами). И если лет тридцать назад об экологически чистой химии на основе сверхкритических флюидов рассуждали на языке теории, то сегодня на Западе эта область химической технологии активно развивается („Химия и жизнь», 2000, № 2; 2004, № 6).
| Таблица: Параметры критического состояния различных веществ | |||
| Растворитель | T, С | P, МПа | ρ, кг/м 3 |
| C2H4 | 8,95 | 5,041 | 214 |
| Xe | 16,35 | 5,840 | 1110 |
| CO2 | 30.75 | 7,375 | 468 |
| C2H6 | 32,05 | 4,884 | 203 |
| N2O | 36,25 | 7,255 | 452 |
| NH3 | 132,15 | 11,350 | 235 |
| C2H5OH | 240,55 | 6,137 | 276 |
| H2O | 373,75 | 22,060 | 322 |
Критическая точка вещества характеризуется критическими значениями температуры, давления и плотности (см. рис.). Разброс этих параметров для различных веществ очень велик (они приведены в таблице), но все они легко достижимы и в лаборатории, и в промышленности. Для технологических процессов лучше всего подходит диоксид углерода — именно его сегодня применяют для экстракции, разделения веществ и многого другого. Сверхкритическую воду пока используют значительно реже, поскольку она становится флюидом при 374°C и , что для практического использования не очень удобно. А между тем в этом состоянии она приобретает ценнейшие свойства. Например, сверхкритическая вода становится почти универсальным растворителем, а также довольно сильным окислителем. Как же это происходит?
На самом деле до сих пор нет однозначного ответа на вопрос, каково физическое состояние среды, именуемой флюидом.
Если мы говорим о твёрдых телах, то обычно используем термины „структура», „строение». Это крайне неудачные слова для обозначения того, что происходит в жидкости или газе. Если бы нам каким-то образом удалось получить координаты всех частиц в жидкости, то уже в следующее мгновение эти данные устареют, поскольку положение частиц сильно изменится. Само слово „структура» подразумевает нечто прочное, незыблемое, и это искажает представления о жидком и флюидном состоянии вещества. К сожалению, другого подходящего термина нет. Можно, конечно, говорить о „ближнем порядке», но и это не передает главную особенность флюидного состояния — непрерывно меняющегося движения молекул.
В обычных условиях молекулы воды связаны между собой водородными связями и объединены в трёхмерную сетку, образуя „бесконечный кластер», или агрегаты (H2O)i+1 По мере повышения температуры водородные связи рвутся, а упорядоченность молекулярного строения нарушается. По мнению авторов гипотезы о строении сверхкритической воды (см. журнал „Сверхкритические флюиды», 2007, № 2), выше критической температуры бесконечных кластеров уже нет. В области критической изотермы на фазовой диаграмме в сверхкритическом флюиде существуют только кластеры конечных размеров и молекулы с большим дефицитом водородных связей, свободно вращающиеся в среде. Похоже это на состояние молекул в жидкости? В жидкости преобладают силы притяжения между молекулами (взаимодействие Ван-дер-Вальса, или водородные связи) — это условие существования бесконечного кластера. С этой точки зрения сверхкритический водный флюид совершенно не похож на жидкость. Но это и не газ (когда большая часть молекул может свободно вращаться), поскольку в такой среде часто возникают конфигурации, типичные для жидкого состояния. Авторы гипотезы называют это состояние транзитным. Получается, что критическая изотерма — это граница существования бесконечного кластера связанных молекул. В общем, с физическим состоянием среды учёным ещё предстоит разбираться.
Уже накоплено много экспериментальных данных по сверхкритическому состоянию воды. Все эти данные подтверждают, что при повышении температуры и давления меняются: её диэлектрическая проницаемость, электропроводность, ионное произведение, структура водородных связей.
Из всех жидкостей вода, наверное, претерпевает самые сильные изменения, переходя в сверхкритическое состояние. Если при нормальном давлении и температуре вода — полярный растворитель, то в сверхкритической воде растворяются почти все органические вещества. Растворимость неорганических веществ также меняется. Даже небольшое отклонение температуры и давления вблизи критической точки изменяет все физико-химические характеристики воды, поэтому при малейших флуктуациях давления и температуры в такой воде могут полностью растворяться или, наоборот, осаждаться оксиды и соли. Собственно, на этом основана технология гидротермального выращивания кристаллов, которой больше полувека.
Естественный сверхкритический реактор
В природе существует громадный естественный сверхкритический реактор. Это — земные недра, в которых на глубине более 50 км вода находится в сверхкритических условиях. Вода — основа „гидротермального флюида» (геологический термин), то есть горячего, сильно сжатого водного раствора, содержащего много компонентов. Перенося на огромные расстояния растворённые в ней вещества, сверхкритическая вода (скH2O) принимает непременное участие в важнейших геологических процессах: в формировании земной коры, вулканической деятельности, в концентрировании минеральных веществ в земной коре. Можно сказать, что благодаря сверхкритической воде сформировался геологический облик нашей планеты.
По образу и подобию того, что происходит под землёй, исследователи уже почти полвека назад разработали технологию гидротермального синтеза кристаллов. Наверное, это единственная технология на сверхкритической воде, которую уже давно и успешно применяют. Гидротермальный синтез позволяет получать кристаллы неорганических веществ (например, кварца и других оксидов, алюмосиликатов, фосфатов и других) в условиях, моделирующих процессы образования минералов в земных недрах. Основан этот метод на способности воды при высоких температурах и давлении растворять оксиды, силикаты, сульфиды и другие вещества, практически нерастворимые в обычных условиях, а при направленном изменении параметров, наоборот, провоцировать их кристаллизацию. Так ежегодно выращивают сотни тонн крупных монокристаллов кварца (массой до 50 кг). По этой же технологии получают искусственные рубины, сапфиры и другие материалы для современной промышленности.
В сверхкритическом состоянии вода (скH2O ) неограниченно смешивается с кислородом, водородом и углеводородами, облегчая их взаимодействие между собой — в ней очень быстро протекают все реакции окисления. Одно из особенно интересных применений такой воды — эффективное уничтожение боевых отравляющих веществ. В смеси с другими веществами скH2O можно использовать не только для окисления, но и в реакциях гидролиза, гидратации, образования и расщепления углерод-углеродных связей, гидрирования и других.
До- и сверхкритическая вода — это нетоксичный растворитель, свойствами которого можно управлять, подстраивая их под конкретную каталитическую реакцию. В процессах со сверхкритическим флюидом нет проблем с диффузией на границе газ-жидкость (ведь это не газ и не жидкость), а значит, легче регулировать скорость такой реакции. Есть данные, что и процесс отравления катализатора также протекает гораздо медленнее.
Наконец, сверхкритическая вода может быть реагентом или средой для получения нанокристаллических частиц (в частности, оксидных катализаторов) с заданными свойствами, которые уже синтезируют в проточных реакторах. Частицы, образующиеся в таком процессе, имеют примерно один размер и довольно развитую поверхность. Кстати, воду в сверхкритическом состоянии можно использовать для получения не только оксидных, но и других нанокристаллических материалов, например, из аморфного углерода синтезировать углеродные нанотрубки.
Несмотря на всё разнообразие возможных применений до- и сверхкритической воды, она прежде всего важна для решения экологических проблем. Переработка и разложение всё возрастающих количеств неорганических и органических отходов — вот задача, для решения которой понадобится безопасный растворитель практически любых твёрдых соединений. Все традиционные способы — сжигание, жидкофазное окисление или биоразложение — имеют свои недостатки. Так, при сжигании органических отходов образуются токсичные вещества, в частности оксиды азота, которые нужно утилизировать. А биоразложение требует много времени и возможно лишь для нейтрализации отходов, содержащих до 1 мас.% органических веществ.
Переработка органических отходов с использованием скH2O — хорошая альтернатива. По оценке специалистов, строительство предприятия по переработке пиридинсодержащих растворов с помощью сверхкритической воды обойдётся дешевле, чем сжигание и низкотемпературное жидкофазное окисление. Уже есть методы дехлорирования и деароматизации растворов органических соединений, переработки полимеров и пластмасс, окисления коммунальных и пищевых отходов, газификации биомассы, окисления токсичных отходов военно-морского флота, гидролиза целлюлозы и лигнина, а также удаления тяжёлых металлов из различных стоков.
Главная проблема, которая тормозит внедрение технологий со сверхкритической водой, — это довольно высокая стоимость промышленных аппаратов, работающих под большим давлением: для них нужны жаропрочные сплавы и специальная обвязка, исключающая возможность взрывов реакторов. Кроме того, скH2O — агрессивная среда, она вызывает коррозию деталей. Эта проблема, как и отложение солей в трубопроводах, хорошо известна по работе тепловых электростанций. Когда же технические задачи будут решены, а стоимость уже не будет определяющим фактором, останется пробить мощное лобби традиционных химических компаний.
Подготовлено по материалам:
Галкин А.А., Лунин В.В. „Вода в суб- и сверхкритическом состояниях — универсальная среда для осуществления химических реакций», журнал „Успехи химии», 2005, 74 (1).
Горбатый Ю.Е., Бондаренко Г.В. „Сверхкритическое состояние воды», журнал „Сверхкритические флюиды. Теория и практика», 2007, № 2.
Автор благодарит доктора химических наук В.М. Валяшко за помощь в подготовке материала.
Источник
СВЕРХКРИТИЧЕСКИЕ ЖИДКОСТИ В ХИМИИ
СВЕРХКРИТИЧЕСКИЕ ЖИДКОСТИ В ХИМИИ (правильнее, сверхкритические флюиды) – четвертая форма агрегатного состояния вещества, в которую способны переходить многие органические и неорганические вещества при достижении определенной температуры и давления.
Впервые сверхкритическое состояние вещества обнаружил Каньяр де ла Тур в 1822, нагревая различные жидкости в наглухо закрытом металлическом шаре (шаровая форма была выбрана, чтобы сосуд мог выдержать максимально возможное давление). Внутрь шара, помимо жидкости, он помещал простейший датчик – небольшой камешек. Потряхивая шар в процессе нагревания, Каньяр де ла Тур установил, что звук, издаваемый камешком при столкновении со стенкой шара, в определенный момент резко меняется – становится глухим и более слабым. Для каждой жидкости это происходило при строго определенной температуре, которую стали именовать точкой Каньяра де ла Тура. Настоящий интерес к новому явлению возник 1869 после экспериментов Т.Эндрюса. Проводя опыты в толстостенных стеклянных трубках, он исследовал свойства CO2, легко сжижающегося при повышении давления. В результате он установил, что при 31° С и 7,2 Мпа, мениск – граница, разделяющая жидкость и пространство, заполненное газом, исчезает и весь объем равномерно заполняется молочно-белой опалесцирующей жидкостью. При дальнейшем повышении температуры она быстро становится прозрачной и подвижной, состоящей из постоянно перетекающих струй, напоминающих потоки теплого воздуха над нагретой поверхностью. Дальнейшее повышение температуры и давления не приводило к видимым изменениям.
Точку, в которой происходит такой переход, он назвал критической, а состояние вещества, находящегося выше этой точки – сверхкритическим. Несмотря на то, что внешне оно напоминает жидкость, в применении к нему сейчас используется специальный термин – сверхкритический флюид (от английского слова fluid, то есть «способный течь»). В современной литературе принято сокращенное обозначение сверхкритических флюидов – СКФ.
Критическая точка.
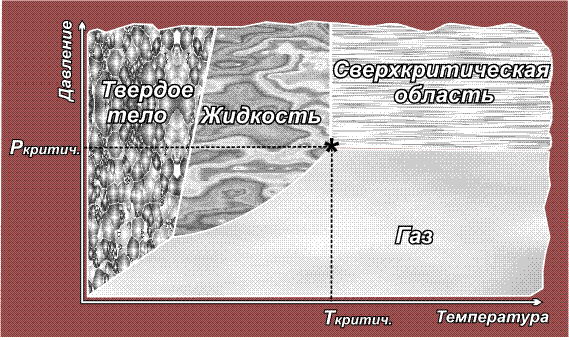
При изменении температуры или давления происходят взаимные переходы: твердое тело – жидкость – газ, например, при нагревании твердое тело переходит в жидкое, при повышении температуры или при понижении давления жидкость превращается в газ. Все эти переходы, как правило, обратимы. В общем виде они представлены на рисунке:
Расположение линий, разграничивающих области газообразного, жидкого и твердого состояния, а также положение тройной точки, где сходятся эти три области, для каждого вещества свои. Сверхкритическая область начинается в критической точке (обозначена звездочкой), которая характеризуется непременно двумя параметрами – температурой и давлением (так же, как точка кипения). Понижение либо температуры, либо давления ниже критического выводит вещество из сверхкритического состояния.
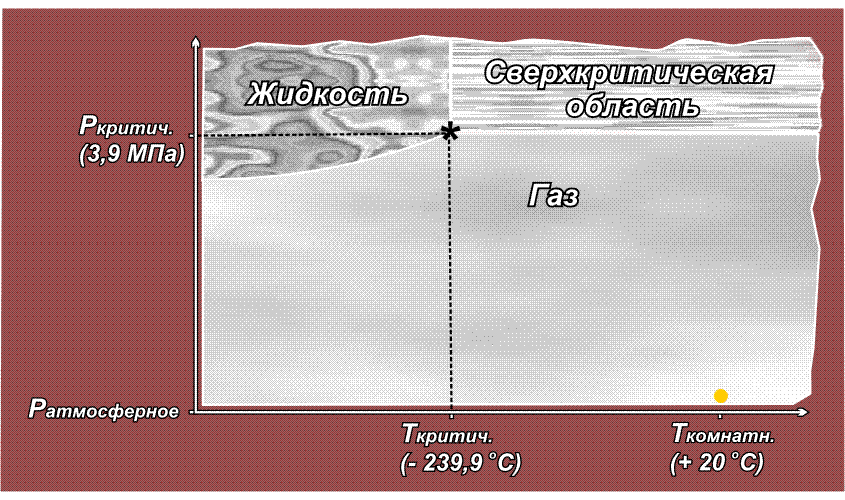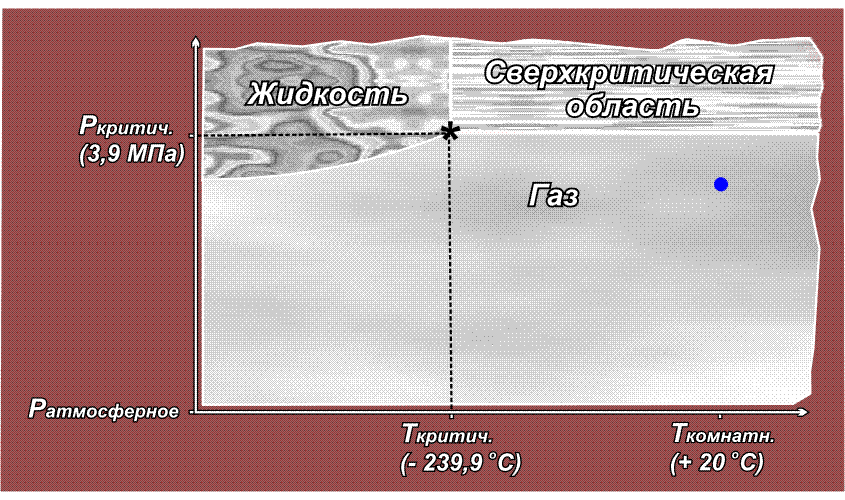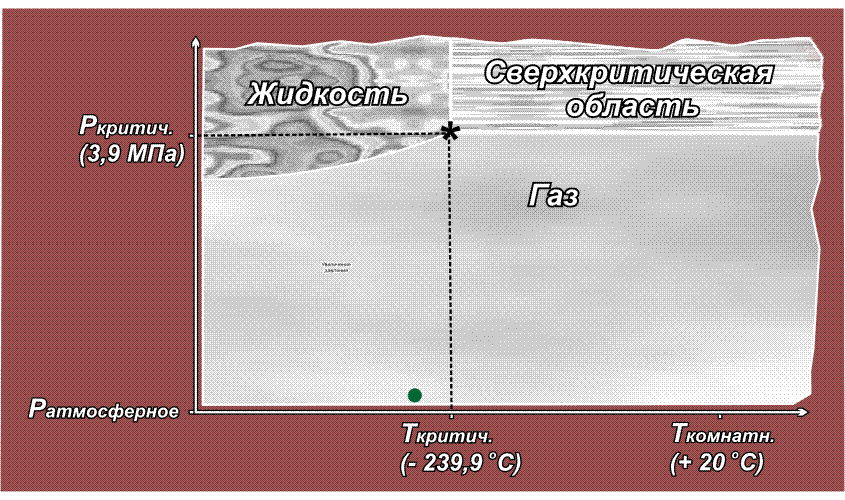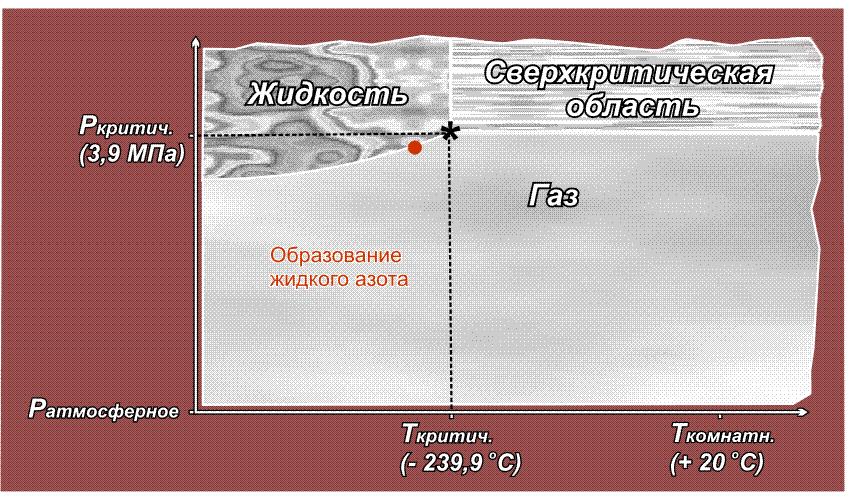
Факт существования критической точки позволил понять, почему некоторые газы, например, водород, азот, кислород долгое время не удавалось получить в жидком виде с помощью повышенного давления, из-за чего их ранее называли перманентными газами (лат. permanentis – постоянный). Из приведенного выше рисунка видно, что область существования жидкой фазы расположена слева от линии критической температуры. Таким образом, для сжижения какого либо газа необходимо его вначале охладить до температуры ниже критической. У таких газов как СО2 или Cl2 критическая температура выше комнатной (31° С и 144° С соответственно), поэтому их можно сжижать при комнатной температуре, только повышая давление. У азота критическая температура много ниже комнатной: –239,9° С, поэтому, если сжимать азот, находящийся при нормальных условиях (исходная точка желтого цвета на приведенном ниже рисунке), то можно достичь в конечном итоге сверхкритической области, но жидкий азот при этом образоваться не может. Необходимо вначале охладить азот ниже критической температуры (зеленая точка) и затем, повышая давление, достичь области, где возможно существование жидкости – красная точка (твердое состояние азота возможно только при очень высоких давлениях, поэтому соответствующая область на рисунке не показана):
Аналогичная ситуация для водорода, кислорода (критические температуры соответственно –118,4° С, –147° С), поэтому перед сжижением их вначале охлаждают до температуры ниже критической, и лишь затем повышают давление.
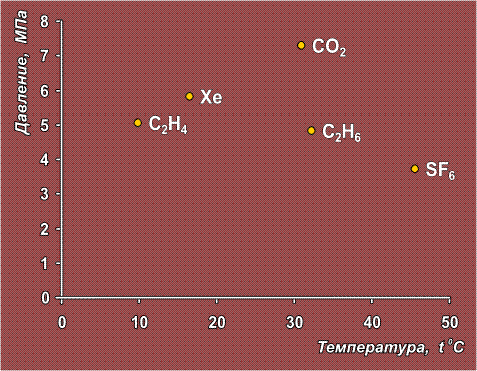
Сверхкритическое состояние
возможно для большинства жидких и газообразных веществ, нужно лишь, чтобы вещество не разлагалось при критической температуре. Вещества, для которых такое состояние наиболее легко достижимо (т.е. нужны сравнительно невысокие температура и давление), показаны на диаграмме:
В сравнении с указанными веществами критическая точка для воды достигается с большим трудом: tкр = 374,2° С и ркр = 21,4 МПа.
Начиная с середины 1880-х критическая точка признается всеми как важный физический параметр вещества, такой же, как точка плавления или кипения. Плотность СКФ исключительно низка, например, вода в форме СКФ имеет плотность в три раза ниже, чем при обычных условиях. Все СКФ имеют крайне низкую вязкость.
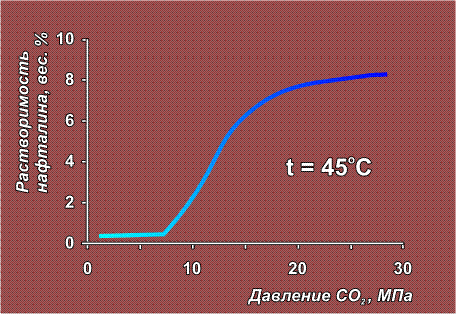
Сверхкритические флюиды представляют собой нечто среднее между жидкостью и газом. Они могут сжиматься как газы (обычные жидкости практически несжимаемы) и, в тоже время, способны растворять твердые вещества, что газам не свойственно. Сверхкритический этанол (при температуре выше 234° С) очень легко растворяет некоторые неорганические соли (CoCl2, KBr, KI). Диоксид углерода, закись азота, этилен и некоторые другие газы в состоянии СКФ приобретают способность растворять многие органические вещества – камфару, стеариновую кислоту, парафин и нафталин. Свойства сверхкритического СО2 как растворителя можно регулировать – при повышении давления его растворяющая способность резко увеличивается:
Опыты, поставленные для визуального наблюдения сверхкритического состояния, были опасны, поскольку не каждая стеклянная ампула способна выдержать давление в десятки МПа. Позже для того, чтобы установить момент, когда вещество становится флюидом, вместо визуальных наблюдений в стеклянных трубках вернулись к методике, близкой к той, что использовал Каньяр де ла Тур. С помощью специальной аппаратуры стали измерять скорость прохождения звука в изучаемой среде, в момент достижения критической точки скорость распространения звуковых волн резко падает.
Применение СКФ.
К середине 1980-х справочники содержали сведения о критических параметрах сотен неорганических и органических веществ, но необычные свойства СКФ все еще не находили применения.
Сверхкритические флюиды стали широко использовать только в 1980-х, когда общий уровень развития индустрии позволил сделать установки для получения СКФ широко доступными. С этого момента началось интенсивное развитие сверхкритических технологий. В первую очередь исследователи сосредоточили внимание на высокой растворяющей способности СКФ. На фоне традиционных методов использование сверхкритических флюидов оказалось очень эффективным. СКФ – это не только хорошие растворители, но и вещества с высоким коэффициентом диффузии, т.е. они легко проникают в глубинные слои различных твердых веществ и материалов. Наиболее широко стали применять сверхкритический СО2, который оказался растворителем широкого круга органических соединений. Диоксид углерода стал лидером в мире сверхкритических технологий, поскольку обладает целым комплексом преимуществ. Перевести его в сверхкритическое состояние достаточно легко (tкр – 31° С, ркр – 73,8 атм.), кроме того, он не токсичен, не горюч, не взрывоопасен и к тому же дешев и доступен. С точки зрения любого технолога он является идеальным компонентом любого процесса. Особую привлекательность ему придает то, что он является составной частью атмосферного воздуха и, следовательно, не загрязняет окружающую среду. Сверхкритический СО2 можно считать экологически абсолютно чистым растворителем.
Фармацевтическая промышленность одна из первых обратилась к новой технологии, поскольку СКФ позволяют наиболее полно выделять биологически активные вещества из растительного сырья, сохраняя неизменным их состав. Новая технология полностью соответствует современным санитарно-гигиеническим нормам производства лекарственных препаратов. Кроме того, исключается стадия отгонки экстрагирующего растворителя и последующей его очистки для повторных циклов. В настоящее время организовано производство некоторых витаминов, стероидов и других препаратов по такой технологии.
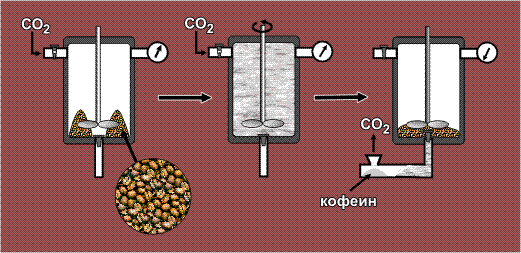
Кофеин – препарат, используемый для улучшения деятельности сердечно-сосудистой системы, получают из кофейных зерен даже без предварительного их измельчения. Полнота извлечения достигается за счет высокой проникающей способности СКФ. Зерна помещают в автоклав – емкость, выдерживающую повышенное давление, затем подают в него газообразный СО2, и далее создают необходимое давление (>73 атм.), в результате чего СО2 переходит в сверхкритическое состояние. Все содержимое перемешивают, после чего флюид вместе с растворенным кофеином сливают в открытую емкость. Диоксид углерода, оказавшись в условиях атмосферного давления, превращается в газ и улетает в атмосферу, а экстрагированный кофеин остается в открытой емкости в чистом виде:
В производстве косметических и парфюмерных препаратов СКФ-технологии используютсядля извлечения эфирных масел, витаминов, фитонцидов из растительных и животных продуктов. В извлеченных веществах нет следов растворителя, а мягкий способ извлечения позволяет сохранить их биологическую активность.
В пищевой промышленности новая технология позволяет деликатно извлекать из растительного сырья различные вкусовые и ароматические компоненты, добавляемые в пищевую продукцию.
Радиохимия использует новую технологию для решения экологических задач. Многие радиоактивные элементы в сверхкритической среде легко образуют комплексы с добавленными органическими соединениями – лигандами. Образующийся комплекс, в отличие от исходного соединения радиоактивного элемента, растворим во флюиде, и потому легко отделяется от основной массы вещества. Таким способом можно извлекать остатки радиоактивных элементов из отработанных руд, а также проводить дезактивацию почвы, зараженной радиоактивными отходами.
Удаление загрязнений при использовании СК-растворителя особенно эффективно. Есть проекты установок для устранения загрязнений с одежды (сверхкритическая химчистка), а также для очистки различных электронных схем в процессе их производства.
Помимо упомянутых преимуществ новая технология в большинстве случаев оказывается дешевле, чем традиционная.
Основной недостаток сверхкритических растворителей состоит в том, что емкости, заполненные СКФ, работают в режиме периодического процесса: загрузка сырья в аппарат – выгрузка готовой продукции – загрузка свежей порции сырья. Не всегда можно повысить производительность установки, увеличивая объем аппаратов, поскольку создание больших емкостей, выдерживающих давление, близкое к 10 МПа, – трудная техническая задача.
Для некоторых процессов химической технологии удалось разработать непрерывные процессы – постоянная подача сырья и непрерывный вывод полученного продукта. Производительность повышается, т.к. что не нужно тратить время на загрузку и выгрузку. В этом случае объем аппаратов можно заметно уменьшить.
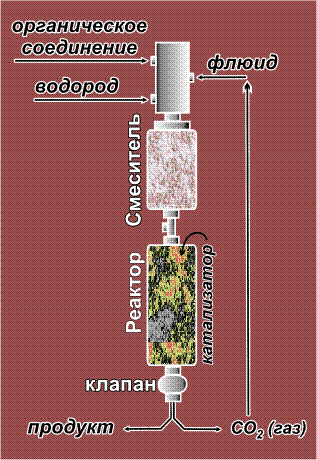
Газообразный водород хорошо растворяется в сверхкритическом CO2, что позволяет непрерывно гидрировать органические соединения в среде флюида. В реактор, содержащий катализатор гидрирования, непрерывно подают реагенты (органическое вещество и водород), а также флюид. Продукты выводятся через специальный клапан, при этом флюид просто испаряется и его можно вновь направить в реактор. Описанным способом удается за две минуты прогидрировать почти килограмм исходного соединения, причем реактор с такой производительностью буквально умещается на ладони. Изготовить столь небольшой реактор, выдерживающий высокие давления, намного проще, чем крупный аппарат.
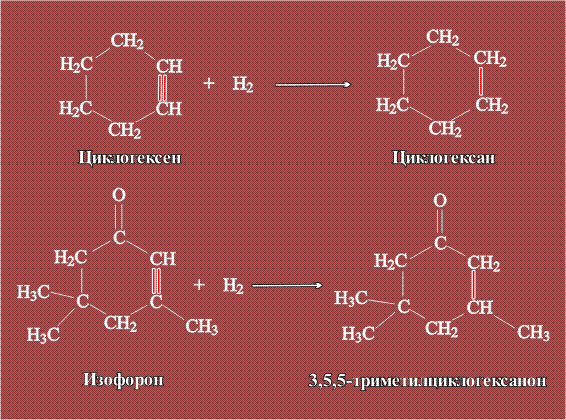
Такой реактор испытан в процессах гидрирования циклогексена до циклогексана (применяумого как растворитель эфирных масел и некоторых каучуков), а также изофорона до триметилциклогексанона (используют в органическом синтезе):
В химии полимеров сверхкритический СО2 как среда для полимеризации используется редко. Большинство мономеров в нем растворимо, но в процессе полимеризации растущая молекула теряет растворимость задолго до того, как успевает заметно вырасти. Этот недостаток удалось превратить в преимущество. Полимеры, полученные обычным путем, затем эффективно очищают от примесей, извлекая не прореагировавший мономер и инициатор полимеризации с помощью СКФ. Благодаря исключительно высоким диффузионным свойствам, флюид легко проникает в массу полимера. Процесс технологичен – не нужны громадные количества органических растворителей, которые, кстати, трудно удаляются из полимерной массы.
Кроме того, полимеры легко набухают при пропитывании флюидом, поглощая его до 30 %. Резиновое кольцо после набухания увеличивает свою толщину почти вдвое:
При медленном снижении давления прежний размер восстанавливается. Если взять не эластичный материал, а твердый и после набухания резко сбросить давление, то СО2 быстро улетает, оставляя полимер в виде микропористого материала. Это, по существу, новая технология получения поропластов.
СК-флюид незаменим для введения в массу полимера красителей, стабилизаторов, а также различных модификаторов. Например, в полиарилат вводят комплексы меди, которые при последующем восстановлении образуют металлическую медь. В итоге из полимера и равномерно распределенного металла возникает композиция, обладающая повышенной износоустойчивостью.
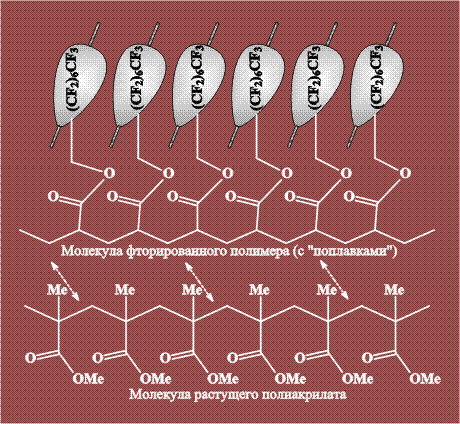
Некоторые полимеры (полисилоксаны и фторированные полиуглеводороды) растворяются в СК-СО2 при температуре, близкой к 100 0 С и давлении 300 атм. Этот факт позволяет использовать СКФ в качестве среды для полимеризации обычных мономеров. К полимеризующемуся акрилату добавляют растворимые фторированные полиуглеводороды, при этом растущая молекула и фторированная «добавка» удерживают друг друга полярными взаимодействиями. Таким образом, фторированные группы добавленного полимера играют роль «поплавков», поддерживающих всю систему в растворе. В результате растущая молекула полиакрилата не выпадает из раствора в осадок и успевает вырасти до значительных размеров:
В полимерной химии используется и ранее упомянутое свойство флюидов – изменять растворяющую способность при повышении давления (см. график растворения нафталина). Полимер помещают в среду флюида и, постепенно увеличивая давление, отбирают порции раствора. Таким образом удается достаточно тонко разделить полимер на составляющие его фракции, то есть рассортировать молекулы по величине.
Вещества, используемые как флюиды. Перспективы.
Сейчас 90% всех СКФ – технологий ориентированы на сверхкритический СО2. Помимо диоксида углерода начинают постепенно входить в практику другие вещества. Сверхкритический ксенон (tкр – 16,6° С, ркр – 58 атм.) представляет собой абсолютно инертный растворитель, и потому химики используют его как реакционную среду для получения нестабильных соединений (чаще всего, металлоорганических), для которых СО2 является потенциальным реагентом. Широкого применения этого флюида не ожидается, поскольку ксенон – дорогой газ.
Для извлечения животных жиров и растительных масел из природного сырья более подходит сверхкритический пропан (tкр – 96,8, ркр – 42 атм.), поскольку он лучше, чем СО2, растворяет указанные соединения.
Одно из самых распространенных и экологически безвредных веществ – вода, но перевести ее в сверхкритическое состояние достаточно трудно, поскольку параметры критической точки очень велики: tкр – 374° С, ркр – 220 атм. Современные технологии позволяют создавать установки, отвечающие таким требованиям, но работать в этом диапазоне температур и давлений технически сложно. Сверхкритическая вода растворяет практически все органические соединения, которые не разлагаются при высоких температурах. Такая вода, при добавлении в нее кислорода, становится мощной окислительной средой, превращающей за несколько минут любые органические соединения в Н2О и СО2. В настоящее рассматривают возможность перерабатывать таким способом бытовые отходы, прежде всего пластиковую тару (сжигать такую тару нельзя, т.к. при этом возникают токсичные летучие вещества).
Поляков В.Н. Баграташвили. Сверхкритические среды: растворители для экологически чистой химии. Российский химический журнал, т. 43. 1999, №2
Леменовский Д.А., Баграташвили В.Н. Сверхкритические среды. Новые химические реакции и технологии. Соросовский Образовательный журнал, 1999, № 10
Источник