Неорганические вещества клетки. Вода, соли, их роль в жизнедеятельности клетки.
Большинство химических соединений, которые входят в состав клетки, встречаются только в живой природе. Почти все молекулы за небольшим исключением, встречающиеся в клетке, относятся к соединениям углерода и рассматриваются в курсе органической химии. Однако вода встречается и в живой, и в неживой природе. В среднем почти 70% от массы живых организмов составляет вода. Но содержание воды в клетке может колебаться в зависимости, например, от ее конкретного вида или возраста. Помимо воды в клетках в значительных количествах встречаются некоторые соли, которые важны для осуществления функций живых организмов.
Вода (H2O) представляет собой вещество, которое в физическом и химическом отношении существенно отличается от других растворителей. Жизнь возникла в первичном океане, и в процессе дальнейшего развития природа использовала уникальные свойства воды.
У воды в отличии от других жидкостей необычайно высокие температуры кипения и плавления и высокая удельная теплоемкость. Также отличительными особенностями воды являются большая удельная теплота испарения, плавления и высокое поверхностное натяжение. Вода имеет все эти свойства благодаря тому, что ее молекулы более прочно связаны друг с другом в отличии от молекул других растворителей.
Эти уникальные свойства воды оказывают большое влияние на жизнедеятельность клеток. Например, высокая теплоемкость воды, т.е. способность поглощать тепло при незначительном изменении своей собственной температуры, предохраняет клетки от резких изменений температуры. Высокую теплоту испарения воды живые организмы используют для предохранения от перегрева. Вспомним, что испарение жидкости животными и растениями — это защитная реакция на повышение температуры. Благодаря высокой теплопроводности воды обеспечивается равномерное распределение теплоты по всему организму, а благодаря тому, что вода плохо сжимается, клетки обладают упругостью и могут поддерживать свою форму.
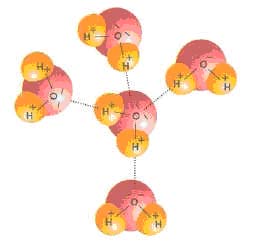
Свои уникальные физические и химические свойства вода получила благодаря особенностям структуры своей молекулы, а точнее, благодаря тому, как именно в молекуле воды располагаются электроны в атомах кислорода и водорода. Два электрона, располагающиеся на внешней электронной орбите атома кислорода в молекуле воды, объединяются с двумя электронами, принадлежащими атомам водорода (у атома водорода на внешней орбите только один электрон). Благодаря этому в молекуле воды образуются две ковалентные связи (между атомом кислорода и двумя атомами водорода). Электроотрицательность * атома кислорода выше, чем у атомов водорода, благодаря чему, электроны притягиваются к нему сильнее. В результате этого на атоме кислорода появляется частично отрицательный заряд, а на атомах водорода — частично положительный. Между более отрицательно заряженными атомами кислорода одних молекул воды и более положительно заряженными атомами водорода других молекул воды образуются так называемые водородные связи, и молекулы воды оказываются связанными между собой.
* Электроотрицательность — это способность атома в молекуле смещать к себе общие электронные пары. Относится к фунадментальным свойствам атома и выражается в количественных характеристиках.
5 молекул воды с водородными связями между ними
На рисунке изображены молекулы воды. Ковалентные связи связывают атомы кислорода и водорода внутри каждой молекулы (сплошные линии), а водородные связи образуются между соседними молекулами (пунктирные линии).
Водородные связи примерно в 20 раз более слабые, чем ковалентные. Поэтому они легко образуются и разрываются. Даже при температуре кипения (100°С) взамодействие между молекулами воды остается достаточно сильным. Именно водородные связи обеспечивают структурированность воды и объясняют такие ее свойства, как высокие температуры кипения и плавления, а также высокую теплоемкость.
Другое важное свойство молекулы воды — ее дипольность. В молекуле воды, как отмечалось ранее, атомы кислорода имеют небольшой отрицательный заряд, а атомы водорода — положительный. Т.к. угол между связями H-O-H составляет 104.5°, получается, что отрицательный заряд в молекуле воды сосредотачивается на одной стороне, а положительный — на другой. Благодаря дипольности молекулы воды имеют способность к ориентации в электрическом поле. Это свойство объясняет, что вода является уникальным растворителем. Если в молекулах веществ присутствуют заряженные группы атомов, они, вступая в электростатическое взаимодействие с молекулами воды, растворяются в ней. Такие вещества с заряженными или полярными группами, растворяющиеся в воде, называются гидрофильными.
Растворение NaCl в воде.
Способность воды растворять кристалл NaCl зависит от электростатического притяжения между полярными молекулами воды и заряженными ионами натрия и хлора.
К гидрофильным соединениям, которые в большом количестве есть в клетках, относятся соли, некоторые низкомолекулярные органические соединения (органические кислоты, аминокислоты, простые сахара), а также полимеры: некоторые полисахариды, белки, нуклеиновые кислоты. Однако существует ряд веществ, почти не имеющих заряженных атомов, и, поэтому, не растворяющихся в воде. Такие вещества называются гидрофобными. К ним, например, относятся липиды (жиры). Гидрофобные вещества не взаимодействуют с водой, но могут взаимодействовать друг с другом. Поэтому они хорошо растворяются в некоторых органических растворителях, как, например, хлороформ. Липиды, относящиеся к гидрофобным соединениям, формируют двумерные структуры (биологические мембраны), практически непроницаемые для воды.
По сравнению с другими растворителями вода может растворить больше химических веществ, благодаря своей полярности. Жизнедеятельность клетки невозможна без многочисленных химических реакций, которые осуществляются в ее водной среде, где растворены различные химические вещества. Также вода растворяет и продукты реакций. Затем в растворенном виде они выводятся из клеток и многоклеточных организмов. За счет перемещения воды в организмах животных и растений осуществляется обмен различными веществами между тканями. Еще одним важным свойством воды является то, что, как химическое соединение, вода вступает во многие химические реакции, которые протекают в клетке. Такие реакции называют реакциями гидролиза. В свою очередь, молекулы воды сами образуются в результате многих реакций в клетках живых организмов.
Т.к. масса атома водорода мала, а атом кислорода в молекуле воды удерживает его единственный электрон, протон (ядро атома водорода, лишенное электрона) способен отрываться от молекулы воды. В результате этого из молекулы воды образуются гидроксильный ион (ОН — ) и протон (Н + ).
H2O H + + OH —
Данный процесс называют диссоциацией воды. Гидроксильные ионы и протоны, которые образуются при диссоциации воды, являются, в свою очередь, участниками многих важных реакций в живых организмах.
В жизнедеятельности клетки также очень важны соли, растворенные в воде. Главным образом соли представлены катионами калия (К + ), натрия (Na + ), магния (Mg 2+ ), кальция (Ca 2+ ) и других металлов, а также анионами соляной (Cl — ), угольной (НСО3 — ) и фосфорных кислот (Н2РО4 — , НРО4 2- ).
Многие катионы характеризуются неравномерным распределением между клеткой и окружающей ее средой. Например, для цитоплазмы характерна более высокая концентрация К + , чем для окружающей клетку среды, между тем, в той же цитоплазме концентрация Na + и Са 2+ будет ниже, чем снаружи клетки. В качестве внешней среды по по отношению к клетке может выступать не только природная среда, например, океан, но и жидкости внутри живого организма, такие как кровь или тканевая жидкость, близкие по своему ионному составу к морской воде. В процессе жизнедеятельности неравномерное распределение катионов между клетками и окружающей их средой постоянно поддерживается, на это затрачивается значительная часть энергии в клетках. Такая неравномерная концентрация ионов между клетками и окружающей их средой необходима для многих процессов жизнедеятельности, к примеру, для передачи возбуждения по нервным и мышечным клеткам или сокращения мышц. Когда клетка умирает, концентрация катионов внутри нее и снаружи быстро становится одинаковой.
Кислотность цитоплазмы клетки в процессе жизнедеятельности практически нейтральная (т.е. значение концентрации ионов водорода (рН) в цитоплазме находится в диапазоне 6,5-7,5). Это происходит несмотря на то, что в процессе жизнедеятельности в клетке образуются и щелочи, и кислоты. Важную роль в поддержании нейтральной кислотности играют анионы слабых кислот (НСО3 — , НРО4 2- ), содержащиеся в клетке. Анионы слабых кислот нейтрализуют внутриклеточную среду, связывая протоны кислот и гидроксильные ионы щелочей.
Необходимо отметить, что анионы слабых кислот вступают в химические реакции, происходящие в клетке. Например, для синтеза АТФ, одного из важных соединений для клетки, необходимы анионы фосфорной кислоты. О синтезе АТФ я расскажу более подробно позднее. Неорганические вещества в живых организмах содержатся не только в растворенном, но и в твердом состоянии. В качестве примера можно привести кости, где преобладает фосфат кальция и в меньшем количестве фосфат магния. В раковинах моллюсков преобладает карбонат кальция.
Источник
Неорганические соединения. Вода и ее свойства
Среди всех веществ на первом месте по массе находится вода. Она составляет около 60-70 %, а в некоторых организмах-до 98 % содержимого. В эмали зубов — 10 %, в нервных клетках — до 85 %. Содержание воды зависит от возраста организма, его активности. Наиболее высокое содержание воды у эмбрионов (90-95 %). У эмбриона человека в 1,5 месяца вода составляет 97,5 %, у восьмимесячного — 83 %, у новорожденного ребенка 74 %, у взрослого человека — в среднем 66 %. С возрастом содержание воды постепенно уменьшается. Содержание воды в разных тканях различное и зависит от их метаболической активности: чем более интенсивные процессы обмена веществ, тем выше содержание воды.
Плотность
Теплоемкость воды и метана. Плотность и структура воды и льда. Гидратация: глицерин, катион и анион.
Вода имеет наибольшую плотность при 4 °С, а плотность льда меньше, чем плотность воды. Поэтому водоемы промерзают очень медленно, снаружи покрываясь льдом.
Вода почти не сжимается, что важно для придания формы и упругости клеткам, органам и тканям, обеспечивает тургорное давление, необходимое положение органов и частей организма в пространстве. В сравнении с другими жидкостями вода характеризуется высокой температурой кипения, плавления, большей теплотой испарения (что обеспечивает защиту организма от перегревания). Объясняется это тем, что молекулы воды более крепко связаны между собой, чем молекулы других растворителей.
Форма
Вода находится в двух формах — свободной и связанной (структурированной). Свободная вода составляет 95 % всей воды клетки. Используется преимущественно как растворитель и среда для коллоидной системы цитоплазмы. Связанная вода составляет 4-5% всей воды клетки.
Полярность
Молекулы воды полярны, состоят из двух атомов водорода, которые соединены с атомом кислорода ковалентной связью. Они способны образовывать диполя (в области водорода преобладает положительный заряд, в области кислорода — отрицательный), которые формируют вокруг веществ (белков) водную оболочку и не позволяют им склеиваться. Вода неустойчиво соединена водородными и другими связями с белками.
Молекулы воды способны притягиваться одна к другой положительным и отрицательным зарядами, образуя водородные связи. Водородные связи слабее, чем ковалентные, в 15-20 раз. В жидком состоянии молекулы воды находятся в постоянном движении. Водородные связи при этом то создаются, то разрываются, создавая текучесть.
Растворитель
Вода хороший растворитель, лучше других жидкостей. В ней хорошо растворяется много минеральных и органических веществ, газов. Свойства растворителя обусловлены особенностями ее внутренней молекулярной структуры.
Вещество растворяется, если энергия притяжения молекул воды к молекулам любого вещества большая, чем энергия притяжения между молекулами воды. Вещества делятся, в зависимости от этого, на гидрофильные (от греч. гидрос — вода и филио — люблю), которые хорошо растворяются, и гидрофобные (от греч. гидрос — вода, фобос — бояться), которые практически не растворимы. Гидрофильные вещества: большинство солей натрия, калия, некоторые белки, кислоты и т. п. Гидрофобные — преимущественно неполярные вещества: жиры, жирообразные вещества, каучук, полисахариды и т. п. Они содержат неполярные группы, которые не взаимодействуют с молекулами воды. Проникновение веществ в клетку и выведение из нее продуктов диссимиляции возможно преимущественно только в растворенном виде.
Вода является важной, основной средой, где протекают важные химические реакции.
Вода непосредственно принимает участие в биохимических реакциях — реакциях гидролиза (от греч. гидрос — вода и лизис — расщепление). Например, расщепление белков, углеводов и других веществ происходит вследствие взаимодействия их с водой с участием ферментов.
Вода образуется вследствие многих химических реакций обмена веществ.
Теплоемкость
Вода имеет большую теплоемкость (способность поглощать тепло при незначительных изменениях собственной температуры) и высокую теплопроводность. То есть она является идеальной жидкостью для поддержания теплового равновесия организма, защищает клетку от резких колебаний температуры.
Вода является источником ионов водорода и кислорода при фотосинтезе. Водород используется для восстановления продуктов ассимиляции углекислого газа.
Вода активно участвует в поддержке осмотического давления в клетке. Осмосом (от греч. осмос — давление) называется проникновение молекул растворителя через полупроницаемую мембрану в раствор большей концентрации растворенного вещества. То есть осмос — это односторонняя диффузия молекул воды в направлении растворенного вещества. Переход молекул воды сквозь мембрану прекращается при выравнивании концентраций растворов или при повышении давления в более концентрированном растворе вследствие поступления в него воды. Давление, с которым вода проникает сквозь мембрану, называется осмотическим. Величина осмотического давления возрастает с увеличением концентрации раствора. Осмотическое давление жидкостей организма человека и млекопитающих равняется давлению 0,85% раствора хлорида натрия. Это — изотонический раствор. Два раствора с одинаковым осмотическим давлением, независимо от химического состава растворенных веществ, называются изотоническими (от греч. изос — равный и тонус — сила, напряжение). Более концентрированный раствор называется гипертоническим, менее — гипотоническим.
На явлениях осмоса основано движение воды проводящими тканями растений и напряженное состояние стенок растительных клеток — тургор (от лат. turgere — быть набухшим). Вода, которая всасывается корневыми волосками растений, содержит мало растворенных веществ. Вода проникает в клетки сквозь мембраны и создает в них повышенное давление, придает упругость (тургор) листьям, лепесткам цветов, стеблям травы.
Вода — это основное средство движения веществ в организме и клетке. Благодаря этому происходит обмен веществ между тканями.
Вода с растворенными в ней веществами изменяет температуру замерзания и кипения. Это свойство предотвращает замерзание клеток, организмов.
Источник