- Щелочная вода: пить или не пить?
- Нейтрализация сточных вод
- Материалы для нейтрализации сточных вод
- Расчет процесса нейтрализации
- Соли, образующиеся в процессе реакции
- Фильтрация азотной и соляной кислоты
- Вертикальные фильтры
- Горизонтальные фильтры
- Комплекты оборудования для станции нейтрализации
- Промышленная
- Очистка воды от аммиака
- Что такое аммиак и аммоний?
- Современные метод очистки воды от аммонийного азота:
- 1. Хлорирование воды
- 2. Биологический метод
- 3. Флотация
- 4. Метод ионного обмена на сильнокислом катионите
- 5. Метод напорной аэрации
- 6. Очистка на сорбционных фильтрах
- 7. Метод обратного осмоса
- 8. Низкотемпературная дистилляция
- Почему необходимо удалять аммиак из воды?
- Некоторые факты об аммиаке
Щелочная вода: пить или не пить?
Щелочная вода: пить или не пить?
Обычная питьевая или водопроводная вода имеет нейтральную кислотность, т.е. ее уровень рН колеблется от 6 до 7. У щелочной воды этот показатель выше, в диапазоне от 7 до 9. Ее любители утверждают, что она способна уменьшить жировые отложения, поддержать здоровье костей и пр. Однако эксперты считают, что плюсы щелочной воды сильно преувеличены.
Польза
• Против изжоги. Доказано, что щелочная вода помогает при гастро- эзофагеальной рефлюксной болезни. Исследователи протестировали щелочную воду с рН 8,8 и обнаружили, что она может давать такой же эффект, как прием антацидных препаратов.
• Для укрепления костей. Исследование 2010 года подтвердило, что у женщин старше 75 лет, которые снизили кислотную нагрузку на организм (придерживались специальной диеты и употребляли щелочную воду), плотность костной ткани была выше. Эти выводы подтвердил и эксперимент с участием 30 молодых женщин. На фоне одинаковой диеты часть из них пила богатую бикарбонатом щелочную минеральную воду, остальные употребляли нейтральную. Спустя четыре недели те, кто пил воду с более высоким рН, имели меньшие показатели потери костной массы.
• Против обезвоживания и лишнего веса. Небольшое исследование, в котором приняли участие 38 здоровых добровольцев, показало, что люди, употреблявшие щелочную воду (рН 10), имели лучшие показатели гидратации организма, чем пившие обычную воду. А исследование, проведенное на мышах, показало, что щелочная вода помогает сбросить вес. Одной группе лабораторных животных давали щелочную воду, а другой – водопроводную, при этом все они получали пищу с высоким содержанием жиров. В первой группе мыши набрали значительно меньший вес, чем во второй. Это подтвердило теорию о том, что организм использует жир для защититы от повышенной кислотности. Если пить щелочную воду, такая защита не нужна, и организм избавляется от лишнего жира.
Золотая середина
Наиболее полезной для здоровья считается естественная щелочная вода, которая, проходя через скальные породы, обогащается природными минералами, увеличивающими ее pH. Однако многие производители в целях экономии используют искусственные методы ощелачивания, например, пропускают нейтральную воду через ионизаторы, добавляют в нее электролиты или бикарбонат натрия (пищевую соду). Злоупотреблять такой водой не стоит. Ведь, в отличие от естественной щелочной, она практически не содержит необходимых организму минералов.
Вред
• Неоправданная цена. Основной недостаток щелочной воды заключается в том, что она намного дороже водопроводной или обычной питьевой. Расходы могут быть оправданы, только если преимущества воды с высоким рН получат неопровержимые доказательства. Однако пока это не так. Клинические исследования, подтверждающие пользу щелочной воды при остеопорозе, ожирении и недостаточной гидратации, слишком малочисленны.
• Проблемы с пищеварением. Постоянно пить щелочную воду вредно, так как высокий рН может нейтрализовать действие соляной кислоты в желудке, вызывая проблемы с пищеварением, например диарею. Избыток щелочной воды чреват возникновением трудностей с перевариванием белков и поглощением питательных веществ. Кроме того, ее не рекомендуется употреблять людям, имеющим проблемы с почками.
• Теоретическая опасность. Организм человека имеет систему регулировки кислотности, которая практически не зависит от внешних воздействий. Употребляя щелочную воду, изменить кислотность крови невозможно. Впрочем, даже если допустить такую возможность, влияние щелочной воды может быть просто опасным. Нарушение кислотно-щелочного равновесия организма приводит к метаболическому алкалозу, который сопровождается тошнотой и рвотой, запорами, тремором и судорогами, головокружениями, спутанностью сознания, обмороками. В долговременной перспективе он также уменьшает количество свободного кальция в организме, что может негативно повлиять на здоровье костей.
Источник
Нейтрализация сточных вод
Нейтрализация сточных вод проводится с целью получить показатель pH равным 7 ед. Процесс основан на взаимодействии кислот или щелочей, содержащихся в жидкости с веществами, приводящими концентрации к нужным показателям. Данная реакция практически осуществляется двумя способами: добавление в жидкость химикатов или фильтрация через нейтрализующие материалы.
Материалы для нейтрализации сточных вод
Для нейтрализации сточных вод с большим включением кислот используется: известь, доломит, мрамор. Для приведения к нужным показателям стоков с высоким содержанием щелочей – техническая серная кислота. Самым доступным реагентом является известь, чаще ее используют в виде известкового молочка, но актуальны материалы в виде пасты или сухого порошка.
Расчет процесса нейтрализации
Расчеты процесса нейтрализации заключаются в установлении нужных объемов реагента. Удобнее пользоваться выражениями г-экв/л. Если концентрация выражена в г/л, ее легко перевести в соответствие так:
- обозначаем 1/Э = a,
- получаем b = aC г-экв/л.
Актуален показатель d, он равен 10 a. В таблице ниже приведены показатели a и d для некоторых реагентов.
Значение коэффициентов a и d для пересчета весовых (в г/л) и процентных концентраций некоторых кислот и щелочей в г·экв/л
Наименование кислот и щелочей
Количество реагентов для нейтрализации устанавливаются на основании стехиометрических соотношений. Ниже приведены расчетные данные для наиболее популярных кислот.
Расход химически чистых щелочей в г на 1 г кислоты
В следующей таблице приведены показатели для часто применяемых щелочей.
Расход кислоты в г на 1 г щелочи
Данные таблиц приведены для реагента в формате сухого порошка, и требуют корректировок. Например, для известкового молочка и пасты, используемой для удаления окиси кальция, реагенты берутся 105% или 95% — соответственно.
Соли, образующиеся в процессе реакции
В процессе нейтрализации образуются соли с различными показателями растворимости. Этот фактор нужно учитывать для установления остаточной их концентрации в жидкости и объемов осадка.
Растворы некоторых солей
Растворимость в г на 1 л воды при температуре в град
Сернокислый натрий, гидрат
Сернокислый кальций (гипс)
Азотнокислый кальций, гидрат
практически не растворим (1,45*10 -2 при t=25°)
Сернокислый магний, гидрат
Суммарный объем солей, образующийся при нейтрализации 1 грамма кислоты, приведен в таблице ниже:
Количество образующихся солей и углекислот при нейтрализации серной, соляной и азотной кислоты
Растворимость в г на 1 л воды при температуре в град
Фильтрация азотной и соляной кислоты
Этот способ эффективен при содержании азотной и соляной кислоты в сточных водах в пределах от 6 до 8 г/л. При более высоких показателях нейтрализующий материал загипсовывается и непригоден к работе. Кроме этого, в водах не должно быть тяжелых солей.
Вертикальные фильтры
На вертикальном фильтре минимальная высота загрузочного материала рассчитывается по формуле Вознесенского:
H = KD n ( 3 + lg b ) √v, где:
- H – высота загрузки фильтра в см;
- D – диаметр зерен загрузочного материала в мм;
- b – концентрация кислоты в г-экв/л;
- v – скорость фильтрации в м/час;
- K и n – эмпирические константы, n – относительно постоянна и равна значению в 1,47, а K – варьируется в пределах от 0,62 до 1,31, и зависит от сорта доломита.
Это справедливо для серной кислоты, для других кислот нужно экспериментально устанавливать эмпирические константы.
Показатели скорости фильтрации обычно располагаются в пределах от 4 до 8 м/ч. Точное значение зависит от высоты загрузочного слоя и концентрации примеси.
Длина горизонтального фильтра определяется по формуле:
- l – длина фильтра в метрах;
- v – скорость движения потока в фильтре в м/сек;
- t – продолжительность контакта загрузочного материала и сточной воды в сек.
Стандартные показатели v находятся в пределах: от 0,01 до 0,03 м/сек. Длительность контакта t определяется по формуле:
t = 6KD1,5/ √v ( 3 + lg b ), где
- D – средний диаметр зерен загрузочного материала в см;
- b – концентрация кислоты в г-экв/л;
- K – коэффициент, характеризующий активность реагента – доломита.
Горизонтальные фильтры
Горизонтальный фильтр должен располагаться под уклоном, его значения i определяются по формуле:
i = v 2 /DS 2 p0 2 , где:
- v – скорость потока воды в см/сек;
- D – крупность зерен загрузочного материала в см;
- p0 – порозность загрузки, стандартные показатели: от 0,35 до 0,45;
- S – коэффициент, находящийся в зависимости от D в пропорции, рассчитываемой по формуле Избаша: S = 20 – 14/ D.
Соотношение между B – шириной и H – высотой фильтра определяются для каждого конкретного случая индивидуально.
Суммарные потери напора в фильтре устанавливаются по формуле:
Площадь поперечного сечения фильтра рассчитывается таким уравнением:
- q – приток сточных вод в м 3 /сек;
- v – скорость фильтрации в м 3 /сек.
Для установления расхода загрузочного материала за 1 сутки определяется формула:
- Q – количество нейтрализуемых стоков в сутки в м 3 /сутки;
- C – концентрация кислоты в стоках в г/л или кг/м 3 ;
- m – коэффициент стехиометрического соотношения, его значения берутся из таблиц выше.
Поскольку 100-процентное использование загрузочного материала невозможно, то фактическое Mф превышает расчетное M. Например, при использовании доломита Mф = 1,5 M.
Расчетная работа фильтра без перезагрузки определяется по формуле:
- P – вес загрузочного материала на фильтр.
Рассмотрим пример расчета. Количество нейтрализуемых стоков в сутки составляет 100 м3/сутки. Они загрязнены соляной кислотой в концентрации 5 г/л. Загрузочный материал – известняк с активностью 50%. Требуется определить расход нейтрализатора.
M = 100 х 1,37 х 5 = 685 кг/сутки.
Увеличив на 5% (о чем сказано выше) получим:
M = 685 х 5 = 720 кг/сутки.
Но поскольку активность известняка составляет 50%, делается еще один расчет:
M = 720 / 0,5 = 1440 кг/сутки.
Комплекты оборудования для станции нейтрализации
Станции для нейтрализации сточных вод состоят из многих рабочих модулей: песколовки, резервуары-усреднители, склады реагента, аппараты для приготовления реагента, дозаторы, смесители, камеры реакции, отстойники, накопители, шламовые площадки. Каждый из агрегатов интегрируется в систему по необходимости. Так, если в стоках есть песок – устанавливается песколовка.
Если на предприятии есть и кислотные, и щелочные стоки – минимальное количество усреднителей должно быть не менее двух. И они, согласно нормативам, должны быть доступны для чистки
Подача извести в пределах предприятия должна быть механизирована. Гашение реагента выполняется в специальных машинах, конструкции Руссола и Полякова. Крупные фракции извести должны предварительно дробиться. Известковое молочко приготовляется в мешалках с оборотами лопастей не менее 40 об/минуту. Его концентрация определяется по активности окиси кальция в пределах от 5 до 10%.
Для стоков, содержащих только соляную кислоту продолжительность контакта с реагентом должна быть 5 минут. Если в составе жидкости есть тяжелые металлы, время увеличивается до 30 минут. При повышенной мощности мешалки – уменьшается до четверти часа.
Объемы накопителей зависят от количества осадка при нейтрализации сточных вод. В таблице ниже приведены показатели для нейтрализации стоков известковым молочком с 50-процентной активностью окиси кальция.
Количество осадка, накапливаемого за 1 год от 1м 3 нейтрализованной воды
Концентрация кислоты и ионов тяжелых металлов в кг * м 3
Источник
Промышленная
Очистка воды от аммиака
Очистка воды от аммиака
Если у вас возникла задача провести очистку питьевой воды от аммиака и/или аммония, то прежде всего вы должны понять, что для решения этой задачи не существует одного какого-то фильтра, а в каждой конкретной ситуации это конкретный комплекс оборудования. Так как способ удаления аммиака и/или аммония зависит от концентраций аммиака и/или аммония, других показателей воды, объемов и назначения очищенной воды.
Ниже даны определения и перечислены методы. Методов много, но как правило, в отдельности они не применяются, кроме окисления для питьевой воды и биологической очистки для сточной воды. Для питьевой воды используют окисление, окисление + ионообмен, окисление + обратноосмотическую фильтрацию и окисление + коагуляцию + скорую фильтрацию + сорбцию.
В нашей практике мы реализовали более 10 объектов, но ни где не встречали аммиак и/или аммоний в чистом виде. Во всех случаях присутствовали прочие загрязнители — органика, механика, железо, марганец, жесткость, минерализация и т.д. Везде присутствовала повышенная цветность (как правило с желтовато зеленоватым оттенком органического происхождения). А так же были завышены органолептические показатели. Поэтому все реализованные нами объекты по очистке воды от аммиака — это не один фильтр, это комплексная индивидуальная система водоочистки.
Аммиак — газ органического происхождения, имеющий специфический запах.
Он присутствует в стоках животноводческих и садоводческих предприятий и ряда сельскохозяйственных производств.
Не стоит игнорировать тот факт, что помимо растворенного аммиака и ионов аммония, в воде присутствуют и другие растворенные вещества и ионы, такие как: соли жесткости, железо, нитраты, сероводород, хлориды и чуть ли не вся таблица Менделеева. Разумеется, прежде чем определиться с методом очистки воды от аммиака и подобрать оборудование, следует провести химический анализ воды. Только тогда можно подобрать оптимальную систему очистки на предприятии.
Что такое аммиак и аммоний?
В воде обычно содержатся две формы: аммоний и аммиак, способные взаимодействовать с другими элементами в воде и образовывать токсичные соли, которые могут нанести вред не только здоровью человека, но и технологичному оборудованию.
Аммиак (NH3) – бесцветный газ с резким характерным запахом, легче воздуха в 1,7 раза, хорошо растворяется в воде. Порог ощущения аммиака — 0,037 г/м 3 . Газообразный аммиак при концентрации 0,28 г/м 3 в воздухе вызывает раздражение горла, 0,49 — раздражение глаз, 1,2 — кашель, к смертельному исходу приводит концентрация 1,5 — 2,7 при длительности воздействии 0,5 — 1 часа.
Аммоний (катион) (NH4 + ) — с противоионом образуют соли аммония, аммониевые соединения, которые входят в класс ониевых соединений. Содержание аммонийного азота в скважинах сопровождается присутствием железа, марганца, углекислого газа, сероводорода и т.д.
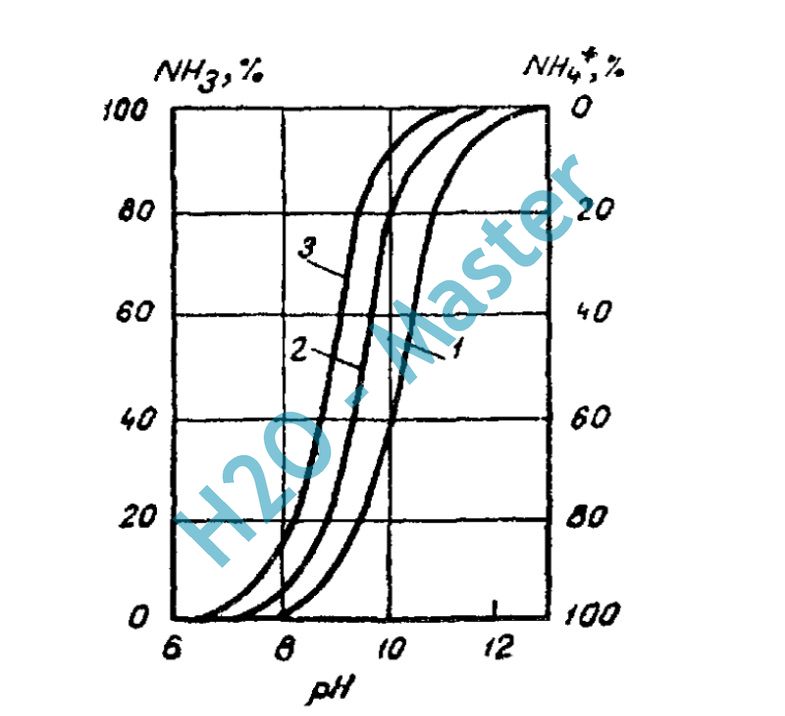
Общий аммонийный азот — это показатель представляющий собой сумму аммиака, ионов аммония и их производных. Данный показатель связан напрямую с показателем pH воды. Так при рН 11, то в воде обнаруживается аммиак. Если рН лежит в промежутке между 8-11, в воде содержатся оба соединения в строго определенном соотношении. Ниже представлен график зависимости концентрации аммиака и аммония от рН воды:
Современные метод очистки воды от аммонийного азота:
Очистка воды от аммиака – это важный этап водоподготовки на различных предприятиях промышленного назначения.
- Хлорирование воды
- Биологический метод
- Флотация
- Метод ионного обмена на сильнокислом катионите
- Метод напорной аэрации
- Очистка на сорбционных фильтрах
- Метод обратного осмоса
- Низкотемпературная дистилляция
Выбор метода зависит удаления аммонийного азота от качества исходной воды, от требуемой производительности установки, от требований к степени очистки воды, от эксплуатационных затрат и финансовых вложений заказчика.
Ниже немного подробнее рассмотрены вышеперечисленные методы.
1. Хлорирование воды
Аммиак может быть удален из воды по средствам хлорирования. Аммиак окисляется до газообразного азота, так же в процессе образуются хлорамины. Чтобы свести к минимуму образование хлораминов, воду обрабатывают избытком хлора (соотношение хлор:аммиак = 8-10:1). В данном методе очистки воды от аммиака необходимо поддерживать рН на уровне 7, при таком значение практически не образуются нитраты и трихлориды.
2. Биологический метод
Метод биологической очистки воды от аммиака осуществляется с использованием микроорганизмов (бактерии, водоросли, грибы). Очистка воды от аммиака биологическим методом требует выполнения следующих действий:
- — Применение микроорганизмов
- — Последующая очистка
- — Обеззараживание воды
Данный метод требует постоянного наблюдения и контроля специалистов за процессами.
3. Флотация
Одним из современных технологических методов очистки воды от аммиака является флотация. В данном методе подбирается окисляющий реагент, с помощью которого удаляется не только аммиак — взвешенные частицы, присутствующие в воде, укрупняются и в дальнейшем легко удаляются на механических фильтрах.
4. Метод ионного обмена на сильнокислом катионите
Для удаления аммонийной формы из воды целесообразно применять ионнообменные фильтры с загрузкой из природных цеолитов. Степень очистки от ионов аммония составляет 90-95%. Цеолитовые фильтры регенерируются поваренной солью (NaCl) при высоком значении pH, а затем промывают водой.
Промывочный раствор нейтрализуют раствором серной кислоты для выделения аммиака. Применение цеолитовых фильтров обеспечивает высокую надежность очистки как воды для нужд производства, так и сточных вод от аммонийного азота.
5. Метод напорной аэрации
При помощи метода аэрации из воды возможно удалить не только от аммиак, но и железо, марганец, даже сероводород. В данном методе осуществляется окисление присутствующих в воде веществ кислородом воздуха. В процессе окисления выпадают нерастворимые осадки, которые в дальнейшем могут быть удалены с помощью механического фильтра. Для очистки воды от аммиака с помощью аэрации используют компрессоры, благодаря которым в аэрационную колонну или окислительный бак нагнетается воздух. Важными составными частями установки являются система управления, датчики потока, а также газоотделительный клапан, через который выводятся выделяемые газы и избыток воздуха.
6. Очистка на сорбционных фильтрах
На сегодняшний день популярной является очистка от аммиака при помощи активированного угля. Активированный уголь — прекрасный материал для кондиционирования воды. Он эффективно удаляет неприятный запах, привкус и цветность воды. Уголь способен очистить не только воду, но и практически любую жидкость от органических веществ и хлорпроизводных.
7. Метод обратного осмоса
Промышленные системы обратного осмоса с эффективностью до 99,8 % способны удалить из воды не только аммиак и его производные, но вещества и ионы иных загрязнителей. Подробнее о системах обратного осмоса вы можете прочитать в нашей статье «системы обратного осмоса»
8. Низкотемпературная дистилляция
При низкотемпературной дистилляции обрабатываемая вода контактирует с газом-носителем, температура которого лежит в пределах 80 о С. В качестве реагента может быть добавлена щелочь, при контакте с водой она разогревается, повышается парциальное давление веществ, находящихся в воде. Ионы аммония в воде не диссоциируют, при изменении давления вывести их из воды довольно легко. Данный метод применим на крупных производствах и требует постоянного контроля обслуживающим персоналом.
Почему необходимо удалять аммиак из воды?
- Токсичность воды, в которой содержится аммиак обуславливается уровнем содержания аммиака и его производных. При небольших концентрациях аммиака вода опасности для человеческого здоровья не несет. В случае если вода имеет резко выраженный запах аммиака, это сигнализирует о том, что в воде повышено содержание ионов аммония. Содержание аммиака в питьевой воде тоже строго регламентировано и не должно превышать 1,5 мг/л.
- Необходимость в снижении концентрации аммиака в воде возникает потому, что его избыток в паре и в присутствии кислорода усиливает коррозию медьсодержащих сплавов конструкций теплообменников, что ставит под угрозу их исправное функционирование. Концентрация аммиака в устройстве тепловых сетей не должна превышать 10 мг/л. Следует произвести очистку воды от аммиака в сети, где показатели его концентрации превышают 5 мг/л в обессоленной воде и 10 мг/л в умягченной.
Некоторые факты об аммиаке
- Норма содержания аммиака в природных водах, которая в зависимости от региона составляет от 10 до 200 мкг/дм 3 в пересчете на азот, что позволяет оценить необходимость в очистке от аммиака и умягчении воды.
- Если концентрация аммония превышает 1 мг/дм 3 , то снижается способность гемоглобина рыб связывать кислород. Это приводит к сокращению их численности, поскольку в результате избытка аммиака рыба мечется в судорогах и выпрыгивает на поверхность.
- Стоки промышленных предприятий содержат до 1 мг/дм 3 аммония, бытовые стоки — 2-7 мг/дм 3 . С хозяйственно-бытовыми сточными водами в канализационные системы ежесуточно поступает до 10 г аммонийного азота на одного жителя.
- В грунтовые воды аммиак попадает из-за использования удобрений, в частности, аммиачной селитры. Особенно остро вопрос очистки воды от ила и от аммиака стоит в регионах, где с азотсодержащими удобрениями и отходами обращаются недостаточно осмотрительно: там вода зачастую становится непригодной для питья.
Уважаемые посетители сайта, если у Вас возникла потребность реализации очистки воды от аммиака и/или аммония для доведения качества воды до определённых нормативов, сделайте запрос специалистам компании нашей компании. Мы разработаем для Вас оптимальную технологическую схему очистки воды.
Источник