- Изотопы водорода: свойства, характеристика и применение
- Сколько разновидностей имеет водород
- Легкий водород
- Дейтерий
- Роль дейтерия в природе
- Как получают тяжелый водород
- Тритий
- Применение изотопов водорода
- Тяжелая вода
- Содержание
- История открытия
- Свойства
- Нахождение в природе
- Биологическая роль и физиологическое воздействие
- Некоторые сведения
- Применение
- Другие виды тяжёлых вод
- Полутяжёлая вода
- Сверхтяжёлая вода
- Тяжёлокислородные изотопные модификации воды
- Общее число изотопных модификаций воды
- См. также
- Ссылки
Изотопы водорода: свойства, характеристика и применение
Любой химический элемент имеет разновидности природного или искусственного происхождения, называемые изотопами. Различие между ними заключается в неодинаковом количестве нейтронов в ядрах и, следовательно, в атомном весе, а также в степени стабильности. Что касается количества протонов, то оно одинаково, благодаря чему элемент, собственно, и остается самим собой. В этой статье мы обратимся к изотопам водорода – самого легкого и распространенного элемента во Вселенной. Нам предстоит рассмотреть их свойства, роль в природе и область практического применения.
Сколько разновидностей имеет водород
Ответ на этот вопрос зависит от того, какие изотопы водорода имеются в виду.
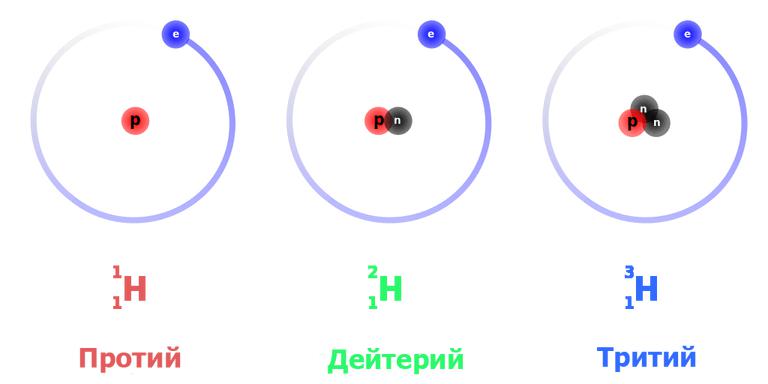
Для этого элемента установлено три природных изотопных формы: протий – легкий водород, тяжелый дейтерий и сверхтяжелый тритий. Все они обнаружены в естественном виде.
Помимо них, существуют четыре искусственно синтезированных изотопа: квадий, пентий, гексий и септий. Характеризуются данные разновидности чрезвычайной нестабильностью, время жизни их ядер выражается величинами порядка 10 -22 – 10 -23 секунд.
Таким образом, всего на сегодняшний день у водорода известно семь изотопных разновидностей. На трех из них, имеющих практическое значение, мы и сосредоточим свое внимание.
Легкий водород
Это наиболее просто устроенный атом. Изотоп водорода протий с атомной массой 1,0078 а. е. м. обладает ядром, в состав которого входит только одна частица – протон. Поскольку он стабилен (теоретически время жизни протона оценивается не менее чем в 2,9×10 29 лет), то стабилен и атом протия. При записи ядерных реакций он обозначается как 1 H1 (нижний индекс – это атомный номер, то есть число протонов, верхний – общее число нуклонов в ядре), иногда просто p – «протон».
Легкий изотоп – это почти 99,99 % всего водорода; лишь чуть более одной сотой процента приходится на остальные формы. Именно протий вносит решающий вклад в распространенность водорода в природе: во Вселенной в целом – около 75 % массы барионного вещества и приблизительно 90 % атомов; на Земле – 1 % массы и целых 17 % атомов всех элементов, входящих в состав нашей планеты. Вообще, протий (точнее сказать, протон как один из главных компонентов Вселенной) смело можно назвать важнейшим элементом. Он обеспечивает возможность термоядерного синтеза в недрах звезд, в том числе и Солнца, и за счет него образуются прочие элементы. Кроме того, легкий водород играет важную роль в построении и функционировании живого вещества.
В молекулярной форме водород вступает в химические взаимодействия при высоких температурах, поскольку для расщепления его достаточно прочной молекулы нужно много энергии. Атомарный водород характеризуется очень высокой химической активностью.
Дейтерий
Тяжелый изотоп водорода имеет более сложно устроенное ядро, состоящее из протона и нейтрона. Соответственно атомная масса дейтерия вдвое больше – 2,0141. Принятое обозначение – 2 H1 или D. Эта изотопная форма также стабильна, так как в процессах сильного взаимодействия в ядре протон и нейтрон постоянно превращаются друг в друга, и последний не успевает претерпеть распад.
На Земле водород содержит от 0,011% до 0,016% дейтерия. Концентрация его различна в зависимости от среды: в морской воде этого изотопа больше, а в составе, например, природного газа – существенно меньше. На других телах Солнечной системы отношение дейтерия к легкому водороду может быть иным: так, лед некоторых комет содержит большее количество тяжелого изотопа.
Дейтерий плавится при 18,6 К (легкий водород – при 14 К), а кипит при 23,6 К (соответствующая точка протия – 20,3 К). Тяжелый водород проявляет, в общем, те же химические свойства, что и протий, образуя все характерные для этого элемента типы соединений, однако ему присущи и некоторые особенности, связанные с серьезной разницей в атомной массе – ведь дейтерий тяжелее в 2 раза. Следует заметить, что по этой причине изотопным формам водорода свойственны наибольшие химические различия из всех элементов. В целом для дейтерия характерны более низкие (в 5 – 10 раз) скорости протекания реакций.
Роль дейтерия в природе
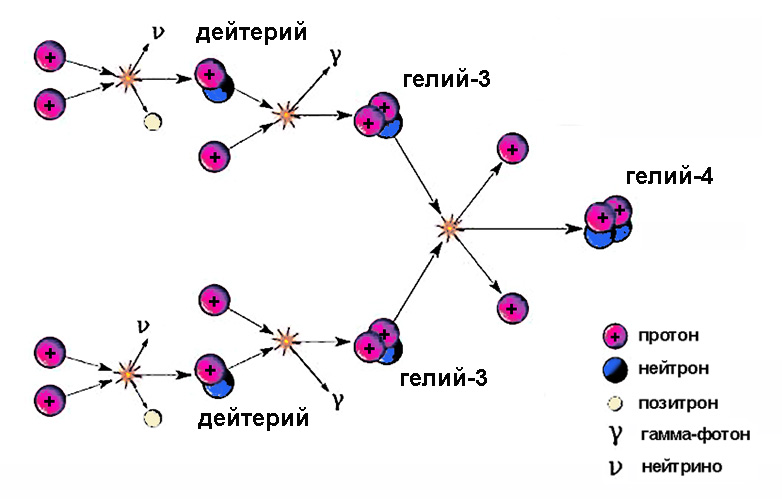
Ядра тяжелого водорода принимают участие в промежуточных стадиях термоядерного цикла. Солнце светит благодаря этому процессу, на одном из этапов которого образующийся изотоп водорода дейтерий, сливаясь с протоном, рождает гелий-3.
Вода, в состав которой входит, кроме протия, один атом дейтерия, называется полутяжелой и имеет формулу HDO. В молекуле тяжелой воды D2O дейтерий полностью заменяет легкий водород.
Тяжелая вода характеризуется замедленным течением химических реакций, вследствие чего в больших концентрациях она вредна для живых организмов, особенно высших, таких как млекопитающие и в том числе человек. Если в составе воды четверть водорода замещена дейтерием, длительное употребление ее чревато развитием бесплодия, анемии и других заболеваний. При замещении 50% водорода млекопитающие погибают через неделю употребления такой воды. Что касается кратковременных повышений концентрации тяжелого водорода в воде, она практически безвредна.
Как получают тяжелый водород
Удобнее всего получать этот изотоп в составе воды. Есть несколько способов обогащения воды дейтерием:
- Ректификация – процесс разделения смесей на компоненты, кипящие при разной температуре. Разделение достигается через многократное испарение и конденсацию смеси изотопов в жидком водороде или воде на специальном оборудовании – ректификационных колоннах, в которых потоки газообразной и жидкой фаз идут во встречных направлениях.
- Электролитическое разделение. Метод основан на том, что при электролизе воды от ее молекул более активно отщепляется легкий изотоп. Электролиз проводят в несколько этапов.
- Ионный изотопный обмен, при котором происходит взаимное замещение ионов разных изотопов в составе реагентов. В настоящее время этот способ с использованием воды и сероводорода в качестве реагирующих компонентов является наиболее эффективным и экономичным.
Тритий
Сверхтяжелый изотоп водорода, в ядре которого наличествуют протон и два нейтрона, имеет атомную массу 3,016 – примерно втрое больше, чем у протия. Тритий обозначается символом Т либо 3 H1. Он плавится и кипит при еще более высоких температурах: 20,6 К и 25 К соответственно.
Это радиоактивный нестабильный изотоп с периодом полураспада 12,32 года. Образуется он при бомбардировке ядер атмосферных газов, например, азота, частицами космических лучей. Распад изотопа происходит с испусканием электрона (так называемый бета-распад), при этом один нейтрон в ядре претерпевает превращение в протон, а химический элемент повышает атомный номер на единицу, становясь гелием-3. В природе тритий присутствует в следовых количествах – его очень мало.
Сверхтяжелый водород образуется в тяжеловодных ядерных реакторах при захвате дейтерием медленных (тепловых) нейтронов. Часть его доступна для извлечения и служит источником трития. Кроме того, его получают как продукт распада лития при облучении последнего тепловыми нейтронами.
Тритий характеризуется малой энергией распада и представляет некоторую радиационную опасность только в случаях, когда попадает внутрь организма с воздухом или пищей. Для защиты кожных покровов от бета-излучения достаточно резиновых перчаток.
Применение изотопов водорода
Легкий водород используется во множестве отраслей: в химической промышленности, где с его помощью ведется производство аммиака, метанола, соляной кислоты и других веществ, в нефтепереработке и металлургии, где он необходим для восстановления тугоплавких металлов из оксидов. Также он применяется на некоторых стадиях производственного цикла (в производстве твердых жиров) в пищевой и косметической промышленности. Водород служит одним из видов ракетного топлива и используется в лабораторной практике в науке и на производстве.
Дейтерий незаменим в ядерной энергетике как прекрасный замедлитель нейтронов. Он применяется в этом качестве, а также как теплоноситель в тяжеловодных реакторах, позволяющих использовать природный уран, что снижает затраты на обогащение. Он также, наряду с тритием, является компонентом рабочей смеси в термоядерном оружии.
Химические свойства тяжелого водорода позволяют использовать его в производстве медицинских препаратов в целях замедления выведения их из организма. И, наконец, дейтерий (как и тритий) имеет перспективы в качестве топлива в термоядерной энергетике.
Итак, мы видим, что все изотопы водорода так или иначе «находятся при деле» как в традиционных, так и в высокотехнологичных, имеющих прицел на будущее отраслях техники, технологии и научных исследований.
Источник
Тяжелая вода
Тяжелая вода
| Тяжёлая вода | |
|---|---|
 | |
| Общая информация | |
| Другие названия | оксид дейтерия |
| Формула | D2O |
| Молярная масса | 20,04 г/моль |
| В твердом виде | ? |
| Вид | прозрачная жидкость без цвета, вкуса и запаха |
| Номер CAS | [7732-20-0] |
| Свойства | |
| Плотность и фазовое состояние | 1104,2 кг/м³, жидкость 1017,7 кг/м³, твёрдая (при н. у.) |
| Растворимость | Малорастворима в диэтиловом эфире; Смешивается с этанолом; C обычной водой смешивается в любых пропорциях. |
| удельная теплоёмкость | 5,301(?) кДж/моль |
| Точка плавления | 3,81 °C (276,97 K) |
| Точка кипения | 101,43 °C (374,55 K) |
| Константа диссоциации кислоты (pKa) | ? |
| Вязкость | 0,00125 Па·с (0,0125 пз) при 20 °C |
Тяжёлая вода́ (также оксид дейтерия) — обычно этот термин применяется для обозначения тяжёловодородной воды. Тяжёловодородная вода имеет ту же химическую формулу, что и обычная вода, но вместо атомов обычного лёгкого изотопа водорода (протия) содержит два атома тяжёлого изотопа водорода — дейтерия. Формула тяжёловодородной воды обычно записывается как D2O или ²H2O. Внешне тяжёлая вода выглядит как обычная — бесцветная жидкость без вкуса и запаха.
Содержание
История открытия
Молекулы тяжёловодородной воды были впервые обнаружены в природной воде Гарольдом Юри в 1932 году, за что был отмечен Нобелевской премией по химии в 1934 году. А уже в 1933 году Гилберт Льюис выделил чистую тяжёловодородную воду.
Свойства
| Молекулярная масса | 20,03 а.е.м. |
| Давление паров | 10 мм. рт. ст. (при 13,1 °C), 100 мм. рт. ст. (при 54 °C) |
| Показатель преломления | 1,32844 (при 20 °C) |
| Энтальпия образования ΔH | −294,6 кДж/моль (ж) (при 298 К) |
| Энергия Гиббса образования G | −243,48 кДж/моль (ж) (при 298 К) |
| Энтропия образования S | 75,9 Дж/моль·K (ж) (при 298 К) |
| Мольная теплоёмкость Cp | 84,3 Дж/моль·K (жг) (при 298 К) |
| Энтальпия плавления ΔHпл | 5,301 кДж/моль |
| Энтальпия кипения ΔHкип | 45,4 кДж/моль |
| Критическое давление | 21,86 МПа |
| Критическая плотность | 0,363 г/см³ |
Нахождение в природе
В природных водах один атом дейтерия приходится на 6400 атомов протия. Почти весь он находится в составе молекул полутяжёлой воды DHO (см. ниже), одна такая молекула приходится на 3200 молекул лёгкой воды. Лишь очень незначительная часть атомов дейтерия формирует молекулы тяжёлой воды D2O, поскольку вероятность двух атомов дейтерия встретиться в составе одной молекулы в природе мала (примерно 0,5·10 −7 ). При искусственном повышении концентрации дейтерия в воде эта вероятность растёт.
Биологическая роль и физиологическое воздействие
Тяжёлая вода токсична лишь в слабой степени, химические реакции в её среде проходят несколько медленнее, по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Эксперименты над млекопитающими (мыши, крысы, собаки) [1] показали, что замещение 25 % водорода в тканях дейтерием приводит к стерильности, иногда необратимой. Более высокие концентрации приводят к быстрой гибели животного; так, млекопитающие, которые пили тяжёлую воду в течение недели, погибли, когда половина воды в их теле была дейтерирована; рыбы и беспозвоночные погибают лишь при 90% дейтерировании воды в теле. Некоторые микроорганизмы и грибы способны жить в 70 % растворе D2O в H2O и даже в чистой тяжёлой воде [1] . Человек может без всякого вреда для здоровья выпить несколько стаканов тяжёлой воды, весь дейтерий будет выведен из организма через несколько дней.
Таким образом, тяжёлая вода гораздо менее токсична, чем, например, поваренная соль. Тяжёлая вода использовалась для лечения артериальной гипертензии у людей в суточных дозах до 1,7 г дейтерия на кг веса пациента; этот метод запатентован (U.S. Patent 5223269 (англ.) ).
Некоторые сведения
Тяжёлая вода накапливается в остатке электролита при многократном электролизе воды. На открытом воздухе тяжёлая вода быстро поглощает пары обычной воды, поэтому можно сказать, что она гигроскопична. Производство тяжёлой воды очень энергоёмко, поэтому её стоимость довольно высока (ориентировочно 200—250 долларов за литр).
Среди населения бытует миф о том, что при длительном кипячении природной воды концентрация тяжёлой воды в ней повышается, что якобы может вредно сказаться на здоровье. В действительности же реальное повышение концентрации тяжёлой воды при кипячении ничтожно (менее процента) и к тому же, как сказано выше, тяжёлая вода практически не ядовита. Гораздо сильнее сказывается на вкусе и свойствах воды при кипячении повышение концентрации растворённых солей.
Применение
Важнейшим свойством тяжёловодородной воды является то, что она практически не поглощает нейтроны, поэтому используется в ядерных реакторах для торможения нейтронов и в качестве теплоносителя. Она используется также в качестве изотопного индикатора в химии, биологии и гидрологии. В физике элементарных частиц тяжёлая вода используется для детектирования нейтрино; так, крупнейший детектор солнечных нейтрино SNO (Канада) содержит 1 килотонну тяжёлой воды.
Другие виды тяжёлых вод
Полутяжёлая вода
Выделяют также полутяжёлую воду (известную также под названиями дейтериевая вода, монодейтериевая вода, гидроксид дейтерия), у которой только один атом водорода замещен дейтерием. Формулу такой воды записывают так: DHO или ²HHO. Следует отметить, что вода, имеющая формальный состав DHO, вследствие реакций изотопного обмена реально будет состоять из смеси молекул DHO, D2O и H2O (в пропорции примерно 2:1:1). Это замечание справедливо и для THO и TDO.
Сверхтяжёлая вода
Сверхтяжёлая вода содержит тритий, период полураспада которого более 12 лет. По своим свойствам сверхтяжёлая вода (T2O) еще заметнее отличается от обычной: кипит при 104 °С, замерзает при +9 °С и имеет плотность 1,33 г/см 3 . Известны (то есть получены в виде более или менее чистых макроскопических образцов) все девять вариантов сверхтяжёлой воды: THO, TDO и T2O с каждым из трёх стабильных изотопов кислорода. Иногда сверхтяжёлую воду называют просто тяжёлой водой, если это не может вызвать путаницы. Сверхтяжёлая вода имеет высокую радиотоксичность.
Тяжёлокислородные изотопные модификации воды
Термин тяжёлая вода применяют также по отношению к тяжёлокислородной воде, у которой обычный лёгкий кислород 16 O заменён одним из тяжёлых стабильных изотопов 17 O или 18 O. Тяжёлые изотопы кислорода существуют в природной смеси, поэтому в природной воде всегда есть примесь обеих тяжёлокислородных модификаций.
Общее число изотопных модификаций воды
Если подсчитать все возможные нерадиоактивные соединения с общей формулой Н2О, то общее количество возможных изотопных модификаций воды всего девять (так как существует два стабильных изотопа водорода и три — кислорода):
- Н2 16 O − лёгкая вода, или просто вода
- Н2 17 O
- Н2 18 O − тяжёлокислородная вода
- HD 16 O − полутяжёлая вода
- HD 17 O
- HD 18 O
- D2 16 O − тяжёлая вода
- D2 17 O
- D2 18 O
С учётом трития их число возрастает до 18. Таким образом, кроме обычной, наиболее распространённой в природе «лёгкой» воды 1 H2 16 O, в общей сложности существует 8 нерадиоактивных (стабильных) и 9 слаборадиоактивных «тяжёлых вод».
Всего же общее число возможных «вод» с учётом всех известных изотопов водорода (7) и кислорода (17) формально равняется 476 (!). Однако распад почти всех радиоактивных изотопов водорода и кислорода происходит за секунды или доли секунды (важным исключением является тритий, период полураспада которого более 12 лет). Например, все более тяжёлые, чем тритий, изотопы водорода живут порядка 10 −20 с; за это время никакие химические связи просто не успевают образоваться, и, следовательно, молекул воды с такими изотопами не бывает. Тяжёлые радиоизотопы кислорода имеют периоды полураспада от нескольких десятков секунд до наносекунд. Поэтому макроскопические образцы воды с такими изотопами получить невозможно, хотя молекулы и микрообразцы могут быть получены.
См. также
Ссылки
- ↑ 12 D. J. Kushner, Alison Baker, and T. G. Dunstall (1999). «Pharmacological uses and perspectives of heavy water and deuterated compounds». Can. J. Physiol. Pharmacol.77 (2): 79–88. DOI:10.1139/cjpp-77-2-79. PMID 10535697. “used in boron neutron capture therapy . D2O is more toxic to malignant than normal animal cells . Protozoa are able to withstand up to 70% D20. Algae and bacteria can adapt to grow in 100% D2O”
Wikimedia Foundation . 2010 .
ТЯЖЕЛАЯ ВОДА — (оксид дейтерия, D2O), вода, в которой атомы водорода замещены ДЕЙТЕРИЕМ (изотоп ВОДОРОДА с ОТНОСИТЕЛЬНОЙ АТОМНОЙ МАССОЙ, примерно равной 2, в то время как у обычного водорода относительная атомная масса равна примерно 1). Встречается в малых… … Научно-технический энциклопедический словарь
Тяжелая вода — Heavy water оксид дейтерия, D2О вода, в которой атомы водорода замещены атомами дейтерия. Тяжелая вода используется как замедлитель в ядерных реакторах. В обычной воде на 5000 частей приходится примерно одна часть тяжелой воды. Термины атомной… … Термины атомной энергетики
тяжелая вода — Оксид дейтерия, D2О вода, в которой атомы водорода замещены атомами дейтерия. Тяжелая вода используется как замедлитель в ядерных реакторах. В обычной воде на 5000 частей приходится примерно одна часть тяжелой воды.… … Справочник технического переводчика
ТЯЖЕЛАЯ ВОДА — D2О, изотопная разновидность воды, в молекулах которой атомы водорода заменены атомами дейтерия. Плотность 1,104 г/см³ (3,98 .С), tпл 3,813 .С, tкип 101,43 .С. Соотношение в природных водах Н:D в среднем 6900:1. На организмы действует… … Большой Энциклопедический словарь
ТЯЖЕЛАЯ ВОДА — см … Большая политехническая энциклопедия
тяжелая вода — Встречающаяся в природе изотопная разновидность воды, в состав которой вместо обычного водорода входит его тяжелый изотоп дейтерий … Словарь по географии
тяжелая вода — sunkusis vanduo statusas T sritis chemija formulė D₂O atitikmenys: angl. heavy water rus. тяжелая вода … Chemijos terminų aiškinamasis žodynas
тяжелая вода — sunkusis vanduo statusas T sritis apsauga nuo naikinimo priemonių apibrėžtis D₂o, vanduo, kuriame vietoje paprastų vandenilio atomų yra sunkieji vandenilio izotopai – deuterio atomai. Sunkiojo vandens tankis 1,104 g/cm³, lydymosi temperatūra… … Apsaugos nuo naikinimo priemonių enciklopedinis žodynas
тяжелая вода — sunkusis vanduo statusas T sritis Energetika apibrėžtis Vanduo, kurio molekulėje vietoje vandenilio H₂ yra dvigubai didesnės masės deuteris D₂. formulė D₂O atitikmenys: angl. heavy water vok. schweres Wasser, n rus. тяжелая вода, f pranc. eau… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
Источник