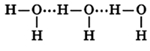- Интересные факты о воде Доклад
- Ещё интересные факты о воде Доклад
- Температура льда
- Температура воды
- Что такое вода химия 8 класс доклад
- Вода (H2O)
- Физические свойства воды
- Строение молекулы воды
- Химические свойства воды
- Растворимость веществ в воде
- Что такое вода химия 8 класс доклад
- Физические свойства воды
- Химические свойства воды
- Вода в жизнедеятельности человека. Водные растворы
Интересные факты о воде Доклад
Интересные факты о воде Доклад по химии 8 класс
Вода является самым уникальным веществом на планете. Из нее на 75% состоит организм человека и на 70% — Земная поверхность.
Воды 10 раз больше содержится в Земной мантии, чем на Земной поверхности – в океанах и морях.
Только 3% общего объёма всей воды на Земле — это пресная вода. И лишь треть от ее запасов годна для употребления человеком, животными и растениями. 2/3 запасов пресной воды хранится в ледниках.
Вода в океане и в море синего цвета из-за рассеянного потока света в его водах.
Ещё интересные факты о воде Доклад
Вода в разном физическом состоянии по-разному отражает свет. Например, от снега отражается 85% солнечных лучей , от воды – только 5%. Зато под лёд океана проникают лишь 2% солнечных лучей.
Температура льда
Как ни удивительно, лёд имеет различные температуры в разных частях света. Например, в Антарктике самый холодный лёд, его температура (- 60 °С), в Гренландии (– 28°С), зато в Альпах – всего (0°С).
Химическая формула воды H2О — известна всем. Но существует она только на бумаге. Но существование такой чистой воды в природе невозможно, т.к.вода — это замечательный растворитель. И в ней растворено большое количество примесей.
По своему происхождению, вода может быть талой, почвенной или из свежего снега. А по количеству содержащихся в ней веществ, видов воды гораздо больше. Потому на сегодня известно примерно 1300 видов воды.
Температура воды
Температура поверхностных вод мирового океана в среднем – 17.4°С. А, температура воздуха над океаном – 14.4°С. Океаны,занимающие 3/4 Земной поверхности, смягчают климат на планете, нагревая нижний слой атмосферы.
В 1 см³ морской воды 1,5 г белка и огромное количество других веществ. Поэтому, учёные сравнивают, питательность Атлантического океана с 20 000 мировыми годовыми урожаями.
С поверхности Земли каждый день происходит испарение одного триллиона тонн воды.
В обычном стакане воды присутствует около 8 септиллионов молекул. Это 8 с 24-мя нулями молекул.
15. 46% всего объёма воды на поверхности Земли содержится в Тихом океане, 23% — в Атлантическом 20,3% -в Индийском, 3,7% — в Северном Ледовитом.
Это всё про интересные факты о воде Доклад Желаю Вам успехов в учебе.
- Интересные факты об углероде ДокладИнтересные факты об углероде Доклад по химии 8 класс.
- Интересные факты о кислороде ДокладИнтересные факты о кислороде Доклад по химии 8 класс.
- Интересные факты об осадках ДокладИнтересные факты об осадках Доклад по географии 8 класс.
- Интересные факты о Китае ДокладИнтересные факты о Китае Доклад по географии 7 класс.
- Интересные факты о всемирной силе тяготенияИнтересные факты о всемирной силе тяготения. Доклад по физике. 9.
Источник
Что такое вода химия 8 класс доклад
Вода (химия, 8 класс):
Мы уже много говорили об этом полезном веществе (и вы наверняка о нем уже многое слышали), теперь посмотрим на воду подробнее, с позиции химии.
Формула воды, как вам уже известно, H2O (аш два о)
Около 75% Земли покрыто водой. Примерно такое же количество воды и в человеке.
Даже сухие на вид вещества удерживают в себе много влаги, например, высушенная на воздухе древесина еще содержит 15% воды. Для выпаривания всей воды из древесины требуется еще несколько часов подержать древесину при высокой температуре. И все равно, даже после этого, древесина будет стараться поглотить влагу из воздуха, как и подобные ей гидроскопичные вещества. Также хорошо поглощает из воздуха воду сахар, соль, силикагель (мешочки с шариками в обуви и по совместительству наполнитель для кошачьего туалета) и т.д.
— выше 0 °C и до 100 °C вода жидкая
— при превышении 100 °C кипит
— при 0 °C и ниже превращается в лед. Удивительное качество воды, при замерзании становиться больше (обычно все вещества на холоде уменьшаются), поэтому плотность льда меньше плотности воды и мы ежегодно видим подтверждение этому, ведь лёд не тонет
— при 2500 °C вода разлагается на водород и кислород.
— под действием электрического тока вода также способна к разложению (это реакция электролиза)
— плотность воды 1 г/см 3
— имеет высокую теплоемкость (медленно нагревается, медленно остывает)
— вода без примесей плохо проводит электрический ток и тепло (меньше всего примесей в дождевой воде)
Если в воде растворены минеральные соли из источников, то такая вода называется минеральной.
Вода, которая течет в домах из кранов, предварительно фильтруется, обеззараживается хлором на водоочистительных станциях. Но все равно её качество не всегда удовлетворительное из-за труб и других факторов. Поэтому желательно производить дополнительную обработку воды, пропуская её через собственные фильтры или производя кипячение.
Чистейшую воду для опытов, медицинских и других целей получают дистилляцией (перегонкой). Т.е. нагревают воду, она переходит в пар, пар охлаждается и опять переходит в жидкость. Соли и другие примеси не могут испариться вместе с водой, поэтому такая вода становится практически чистой и называется дистиллированной.
Для питья дистиллированная вода не очень подходит, так как нам необходима вода с солями. При этом количество солей в питьевой воде не должно быть слишком большим. Например, от морской воды быстро становится плохо.
Для нас пригодна речная, ключевая вода, вода из источников, но, к сожалению, постоянные выбросы из канализаций, с заводов, поступление в воды удобрений с полей и другие факторы, портят качество всей воды на планете.
В некоторых регионах мира проблема с водой катастрофическая, например, в большей части Африки, в Китае,…. Китай, в связи с этим, даже начал закупать воду в России из озера Байкал.
Редактировать этот урок и/или добавить задание Добавить свой урок и/или задание
Добавить интересную новость
Добавить анкету репетитора и получать бесплатно заявки на обучение от учеников
user->isGuest) < echo (Html::a('Войдите', ['/user/security/login'], ['class' =>»]) . ‘ или ‘ . Html::a(‘зарегистрируйтесь’, [‘/user/registration/register’], [‘class’ => »]) . ‘ , чтобы получать деньги $$$ за каждый набранный балл!’); > else < if(!empty(\Yii::$app->user->identity->profile->first_name) || !empty(\Yii::$app->user->identity->profile->surname))< $name = \Yii::$app->user->identity->profile->first_name . ‘ ‘ . \Yii::$app->user->identity->profile->surname; > else < $name = ''; >echo ‘Получайте деньги за каждый набранный балл!’; > ?>—>
При правильном ответе Вы получите 2 балла
Отметьте верные утверждения о воде
Выберите те ответы, которые считаете верными.
Добавление комментариев доступно только зарегистрированным пользователям
Lorem iorLorem ipsum dolor sit amet, sed do eiusmod tempbore et dolore maLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborgna aliquoLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempbore et dLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborlore m mollit anim id est laborum.
28.01.17 / 22:14, Иван Иванович Ответить +5
Lorem ipsum dolor sit amet, consectetu sed do eiusmod qui officia deserunt mollit anim id est laborum.
28.01.17 / 22:14, Иван ИвановичОтветить -2
Lorem ipsum dolor sit amet, consectetur adipisicing sed do eiusmod tempboLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod temLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborpborrum.
28.01.17 / 22:14, Иван Иванович Ответить +5
Источник
Вода (H2O)
Оксид водорода (H2O), гораздо более известный всем нам под названием «вода», без преувеличения, является главной жидкостью в жизнедеятельности организмов на Земле, ибо все химико-билогические реакции проходят, либо с участием воды, либо в растворах.
Вода является вторым, после воздуха, самым важным веществом для организма человека. Прожить без воды человек может не более 7-8 суток.
Чистая вода в природе может существовать в трех агрегатных состояниях: в твердом — в виде льда, в жикдом, собственно вода, в газообразном — в виде пара. Таким разнообразием агрегатных состояний в природе больше не может похвастаться ни одно вещество.
Физические свойства воды
- при н.у. — это жидкость без цвета, запаха и вкуса;
- вода обладает высокой теплоёмкостью и низкой электропроводностью;
- температура плавления 0°C;
- температура кипения 100°C;
- максимальная плотность воды при 4°C равна 1 г/см 3 ;
- вода — хороший растворитель.
Строение молекулы воды
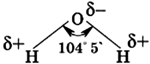
Молекула воды состоит из одного атома кислорода, который соединен с двумя атомами водорода, при этом связи O-H образуют угол в 104,5°, при при этом общие электронные пары смещены к атому кислорода, который более электроотрицателен по сравнению с атомами водорода, поэтому, на атоме кислорода формируется частичный отрицательный заряд, соответственно, на атомах водорода — положительный. Таким образом, молекулу воды можно рассматривать, как диполь.
Молекулы воды могут между собой образовывать водородные связи, притягиваясь противоположно заряженными частями (на рисунке водородные связи показаны пунктиром):
Формирование водородных связей объясняет высокую плотность воды, температуру ее кипения и плавления.
Количество водородных связей зависит от температуры — чем выше температура, тем меньшее кол-во связей образуется: в парах воды присутствуют только отдельные ее молекулы; в жидком состоянии — образуются ассоциаты (H2O)n, в кристаллическом состоянии каждая молекула воды связана с соседними молекулами четырьмя водородными связями.
Химические свойства воды
Вода «охотно» вступает в реакции с другими веществами:
- с щелочными и щелочноземельными металлами вода реагирует при н.у.:
- с менее активными металлами и неметаллами вода реагирует только при высокой температуре:
- с основными оксидами при н.у. вода реагирует с образованием оснований:
- с кислотными оксидами при н.у. вода реагирует с образованием кислот:
- вода является главным участником реакций гидролиза (подробнее см. Гидролиз солей);
- вода участвует в реакциях гидратации, присоединяясь к органическим веществам с двойными и тройными связями.
Растворимость веществ в воде
- хорошо растворимые вещества — в 100 г воды растворяется более 1 г вещества при н.у.;
- малорастворимые вещества — в 100 г воды растворяется 0,01-1 г вещества;
- практически нерастворимые вещества — в 100 г водры растворяется менее 0,01 г вещества.
Совершенно нерастворимых веществ в природе не существует.
При растворении многих веществ в воде вокруг их молекул образуется оболочка из молекул воды — такой «слоеный пирог» называется гидратом. После кристаллизации в составе таких комплексов сохраняются некоторая часть молекул воды, образуя кристаллогидрат:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник
Что такое вода химия 8 класс доклад
Ключевые слова конспекта: вода, физические и химические свойства воды, водные растворы.
Физические свойства воды
Чистая вода — прозрачная жидкость, без цвета, вкуса и запаха, плотность 1 кг/л, температура кипения 100 °С при 1 атм, температура плавления 0°С. У воды высокая удельная теплоемкость — 4,12 кДж/кг К), поэтому она долго нагревается и медленно остывает. У воды большая теплота испарения. На испарение 1 г воды требуется 2,25 кДж теплоты.
Атомы Н и О в молекуле воды соединены полярными ковалентными связями. На атоме водорода в молекуле Н2О имеется небольшой положительный заряд δ+, а на атоме кислорода — небольшой отрицательный δ-. Поскольку молекула воды имеет уголковое строение, она представляет собой двухполюсную частицу — диполь: 
Химические свойства воды
Вода реагирует со многими металлами по типу реакций замещения.
С наиболее активными металлами — от Li по Аl в ряду активности металлов при комнатной температуре протекают реакции замещения одного атома Н в молекуле Н2O. С магнием реакция идет при нагревании, с алюминием — после снятия защитной оксидной пленки. В реакции образуются гидроксиды металлов — соединения, содержащие гидроксогруппу ОН, и водород:
2Li + 2Н2O = 2LiOH + Н2↑,
Са + 2Н2O = Са(ОН)2 + Н2↑.
Менее активные металлы — Zn, Mo, W, Fe — взаимодействуют с водой при высокой температуре (400-600 °С). В этих реакциях образуются оксиды металлов и водород:
Zn + Н2O = ZnO + Н2↑,
3Fe + 4Н2O = Fe3O4 + 4Н2↑
Вода реагирует с оксидами активных металлов (реакция гидратации). При этом получаются растворимые в воде гидроксиды металлов — щелочи:
Na2O + Н2O = 2NaOH,
СаО + Н2O = Са(ОН)2.
Вода соединяется с оксидами многих неметаллов. При этом получаются растворимые в воде гидроксиды неметаллов — кислоты:
СO2 + Н2O = Н2СO3,
SO3 + Н2O = H2SO4.
Гидролиз — это обратимая реакция обмена, например соли с водой. При этом происходит расщепление молекул воды на Н и ОН, которые входят в состав двух новых веществ:
К2СO3 + Н2O = КНСО3 + КОН,
РСl3 + ЗН2O = Н3РО3 + ЗНСl.
Вода в жизнедеятельности человека. Водные растворы
Вода — жизненная среда всех живых организмов. Человек живет на суше, но его организм на 65-70% состоит из воды. Все процессы в живой клетке осуществляются в водной среде. В сутки человеку необходимо 2 л питьевой воды. Кроме того, вода нужна, чтобы варить пищу, стирать белье, умываться. Большие количества пресной воды расходуются в промышленности и сельском хозяйстве (растворитель). Отметим, что соленая вода морей и океанов для этих целей непригодна. Доля пресной воды в общих запасах воды на Земле составляет менее 3% от всех водных ресурсов.
Вода — химический реагент. Соединяясь с оксидами активных металлов, вода образует щелочи, а в реакциях с оксидами неметаллов дает кислоты — два больших и важных в деятельности человека класса веществ. Один из способов синтеза этилового спирта (этанола) C2H5OH — реакция этилена С2Н4 с водой:
Жесткость воды — это свойства воды, обусловленные содержанием в ней ионов Са 2+ , Mg 2+ , Fe 2+ . Если концентрация этих ионов велика, то воду называют жесткой, если мала — мягкой. При стирке с мылом в жесткой воде образуются осадки, часть мыла уходит в осадок и ухудшается качество ткани. Такая вода непригодна для охлаждения в радиаторах автомобилей, в паровых котлах и стиральных машинах. При нагревании жесткой воды образуется накипь, которая забивает трубы и ускоряет изнашивание механизмов. Различают временную и постоянную жесткость воды.
Временная или карбонатная жесткость вызвана присутствием растворенных гидрокарбонатов кальция Са(НСО3)2, магния Mg(HCO3)2 и железа Fe(HCO3)2. При кипячении воды гидрокарбонаты разлагаются с образованием осадка карбоната, и жесткость воды снижается:
Са(НСO3)2 = СаСО3↓ + СO2↓ + Н2O,
Fe(HCO3)2 = FeCO3↓ + CO2↓ + Н2O.
Другой способ устранения временной жесткости — действие известкового молока или соды:
Постоянная жесткость воды обусловлена присутствием в ней хлоридов, сульфатов и других растворимых солей кальция, магния и железа. Ее устраняют действием соды:
СаСl2 + Na2CO3 = СаСO3↓ + 2NaCl.
Водный раствор — разновидность раствора, в котором растворителем служит вода. Будучи превосходным растворителем, именно вода используется для приготовления большинства растворов в химии.
Вещества, которые плохо растворяются в воде, называют гидрофобными (‘боящимися воды’), а хорошо в ней растворяющиеся — гидрофильными (‘любящими воду’). Примером типичного гидрофильного соединения может служить хлорид натрия (поваренная соль).
Если вещество образует водный раствор, который хорошо проводит электрический ток, то он называется сильным электролитом; в противном случае — слабым.
Конспект урока по химии «Вода. Свойства воды. Водные растворы». Выберите дальнейшее действие:
Источник