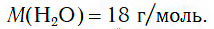- Урок 27. Состав и физические свойства воды
- Состав и строение воды
- Физические свойства воды
- Вода как растворитель
- Познание мира
- Вода — определение, структура, характеристики, свойства и функции
- Структура воды
- В газовой фазе
- В жидкой фазе
- В твердой фазе
- Водородная связь в воде
- Характеристики / Свойства воды
- Физические свойства воды
- Вода как растворитель
- Высокая удельная теплоемкость
- Аномальное расширение воды
- Биологические функции воды
Урок 27. Состав и физические свойства воды
В уроке 27 «Состав и физические свойства воды» из курса «Химия для чайников» узнаем, что из себя представляет вода, выясним её состав, а также физические свойства.
Наиболее распространенным оксидом на Земле является оксид водорода H2O, или вода. Без воды, как и без кислорода, невозможна жизнь человека, животных и растений.
Вода — единственное вещество, существующее на Земле одновременно в трех агрегатных состояниях: жидком, твердом и газообразном. Она является основным компонентом морей и океанов, ледников и айсбергов, облаков и тумана.
Около 70 % поверхности Земли покрыто океанами, морями, реками и озерами — природными хранилищами воды. Из космоса толстый слой воды имеет голубой цвет (рис. 104), вот почему нашу планету называют голубой. Вода входит в состав всех живых организмов, а также очень многих минералов.
Состав и строение воды
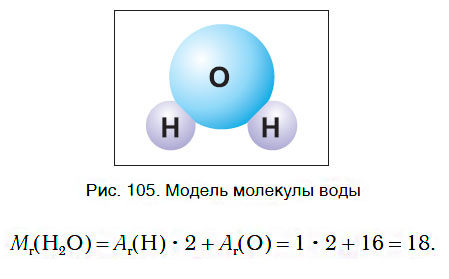
Как вы уже знаете, молекула воды состоит из трех атомов — двух атомов водорода и одного атома кислорода (рис. 105). Относительная молекулярная масса воды равна:
Следовательно, молярная масса воды равна:
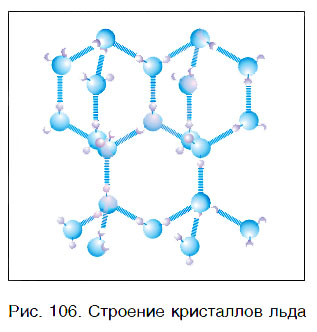
Вода — это вещество с молекулярным строением. В твердом (рис. 106) и жидком агрегатных состояниях молекулы воды прочно связаны друг с другом. Этим во многом объясняется целый ряд удивительных физических свойств воды.
Физические свойства воды
При комнатных условиях вода представляет собой жидкость без вкуса и запаха. В тонком слое вода не имеет цвета. Однако при толщине более 2 м она имеет голубой цвет. Совершенно чистая вода очень плохо проводит электрический ток.
На заметку: По тому, как проводит электрический ток вода, можно судить о ее чистоте — чем ниже электропроводность, тем чище вода.
У большинства веществ в твердом состоянии плотность выше, чем в жидком. В отличие от них вода в твердом агрегатном состоянии (лед) имеет более низкую плотность, чем в жидком. При 0 °С плотность льда равна примерно 0,92 г/см 3 , а плотность жидкой воды — примерно 1,00 г/см 3 . Это означает, что лед легче воды, поэтому он не тонет в ней (рис. 107). Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
У воды высокая теплоемкость, поэтому она медленно нагревается, но и медленно остывает. Это позволяет морям и океанам накапливать тепло летом (и днем) и высвобождать его зимой (и ночью), что предотвращает резкие колебания температуры воздуха на нашей планете в течение года (и суток). Моря и океаны служат своеобразными аккумуляторами тепла на нашей планете.
При нормальном давлении (101,3 кПа) температура кипения воды равна 100 °С. При понижении давления температура кипения воды понижается. Например, в горах на высоте около 5000 м давление существенно ниже нормального (примерно в два раза), поэтому вода закипает в этих условиях при температуре около 84 °С. Понятно, что варить продукты до готовности в горах необходимо более длительное время. И наоборот, в скороварке, где создается высокое давление, вода закипает при температуре выше 100 °С, что позволяет быстрее приготавливать пищу.
Вода как растворитель
С совершенно чистой водой, не содержащей никаких других веществ, большинство людей никогда не встречается. Такая вода используется только в специальных целях.
Почти все жидкости, с которыми мы сталкиваемся в повседневной жизни и деятельности, представляют собой растворы различных веществ.
Раствор — это однородная смесь двух и более веществ.
Одно из веществ, входящих в состав раствора, называется растворителем, а остальные — растворенными веществами. Очень часто растворителем является вода. Вода может растворять твердые, жидкие и газообразные вещества.
Все природные воды содержат растворенные соли. Их легко обнаружить экспериментально, выпарив воду на часовом стекле. Кроме солей, вода может растворять различные газы. Их присутствие (правда, не всегда) можно обнаружить экспериментально. Например, поместив пробирку с холодной водой из-под крана в теплое место, через некоторое время можно заметить у стенок пробирки пузырьки. Это растворенные газы (преимущественно кислород) выделяются из раствора при его нагревании до комнатной температуры (рис. 108).
Многие жидкости также хорошо растворимы в воде. Например, серная кислота и спирт неограниченно растворяются в воде. В таком случае говорят, что вещество смешивается с водой в любых соотношениях. Из-за хорошей растворимости многих веществ в воде ее иногда называют универсальным растворителем.
Краткие выводы урока:
- Вода не имеет вкуса, цвета (в тонком слое) и запаха, кипит при 100 °С, а переходит в твердое состояние при 0 °С.
- Плотность твердой воды меньше, чем жидкой.
- Раствор — это однородная смесь двух и более веществ.
- Вода является универсальным растворителем — она хорошо растворяет многие твердые, жидкие и газообразные вещества.
Надеюсь урок 27 «Состав и физические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Познание мира
Вода — определение, структура, характеристики, свойства и функции
Вода — это неорганическое жидкое химическое вещество, не имеющее цвета, запаха и вкуса, которое составляет большую часть гидросферы Земли и жидкостей в организме всех живых существ.
- Вода — чрезвычайно важный компонент для существования жизни, поскольку она жизненно важна для всех биологических процессов. Однако, она не имеет калорийности или питательной ценности.
- Вода находится в жидком состоянии при стандартных атмосферных температуре и давлении.
- Занимает 71% всей суши на Земле и около 70% от общей массы тела человека.
- Вода также важна для различных химических процессов, поскольку является универсальным растворителем.
Структура воды
- Химическая формула воды — H 2 O, что указывает на то, что одна молекула воды состоит из двух атомов водорода и одного атома кислорода.
- Атомы в молекуле воды связаны друг с другом полярными ковалентными связями. Сама по себе молекула электрически нейтральна, но полярна с отрицательными и положительными зарядами, локализованными в разных областях.
В газовой фазе
- В молекуле воды s- и p-орбитали валентной оболочки sp 3 гибридизуются с образованием четырех гибридных sp 3 орбиталей, тетраэдрически ориентированных вокруг атома кислорода.
- Две гибридные орбитали заняты поодиночке, а неподеленные пары электронов занимают две другие.
- Каждая отдельная занятая sp 3 -орбиталь перекрывается наполовину заполненной орбиталью атома H.
- В результате атом кислорода связан с двумя атомами водорода двумя ковалентными связями ОН, и на атоме кислорода находятся две неподеленные пары электронов.
- Структура молекулы воды имеет угловатую изогнутую структуру.
- Молекула воды полярна, потому что кислород более электроотрицателен, чем водород. Таким образом, атом кислорода притягивает к себе общие электроны.
- В результате на атоме кислорода развивается частичный отрицательный заряд, а у атома водорода — частичный положительный заряд.
В жидкой фазе
- В жидкой фазе молекулы воды удерживаются вместе межмолекулярными водородными связями.
- Одна молекула воды способна образовывать четыре водородные связи, поскольку она может образовывать две связи с неподеленной парой кислорода и отдавать два электрона водороду.
- В воде образование четырех водородных связей приводит к межмолекулярной тетраэдрической структуре, образующей открытую структуру и трехмерную сетку связей.
В твердой фазе
- Твердая форма воды — это лед, который может существовать в различных кристаллических формах в зависимости от условий замерзания воды.
- В обычном гексагональном льду каждый атом кислорода тетраэдрически окружен четырьмя другими атомами кислорода, тогда как один атом водорода находится между каждой парой кислорода.
- Таким образом, каждый атом водорода ковалентно связан с одним атомом кислорода и связан с другим атомом кислорода водородной связью.
- Такое расположение вызывает упаковку атомов с большими открытыми пространствами, что приводит к уменьшению плотности льда по сравнению с жидкой водой.
- Когда лед тает, некоторые водородные связи разрываются, и молекулы воды становятся более плотными.
Водородная связь в воде
- Благодаря полярности молекул воды они способны притягивать друг друга. Эти взаимодействия представляют собой слабые притяжения, называемые водородными связями.
- Водородная связь в воде — это слабое взаимодействие между частично положительным атомом водорода и частично отрицательным атомом кислорода.
- Водородная связь в воде является межмолекулярной и происходит между двумя атомами двух разных молекул.
- Одна молекула воды способна образовывать четыре водородные связи, поскольку она может образовывать две связи с неподеленной парой кислорода и отдавать два электрона водороду.
- В воде образование четырех водородных связей приводит к межмолекулярной тетраэдрической структуре, образующей открытую структуру и трехмерную сетку связей.
- Структура, образованная после образования водородных связей, приводит к тому, что коллективное основное состояние жидкой воды имеет энергию ниже, чем основное состояние в отдельных газообразных молекулах.
- Это создает стабильную структуру молекул воды в жидкой воде.
- Водородная связь, образованная в воде, является слабой, и ее прочность составляет одну двадцатую от силы ковалентной связи ОН.
- Срок службы этих связей также очень короткий, и они непрерывно разрываются и образуются в течение коротких периодов времени. Таким образом, в жидкой воде поддерживается динамическое равновесие.
- Точно так же все молекулы воды в жидкой воде имеют по крайней мере одну водородную связь с соседней молекулой воды, при этом свободные молекулы воды практически отсутствуют.
Характеристики / Свойства воды
Физические свойства воды
- Чистая вода — это прозрачная бесцветная жидкость без запаха, которая легко улавливает аромат любого растворенного в ней вещества.
- Температура замерзания, температура кипения, энтальпия плавления и энтальпия испарения воды выше по сравнению с гидридами других членов той же группы из-за межмолекулярных водородных связей между молекулами.
- Вода имеет высокий дипольный момент, что делает ее идеальной средой для растворения самых разных соединений.
- Высокая удельная теплоемкость воды позволяет ей поглощать тепло различных биохимических и физиологических реакций, происходящих внутри тела, с минимальным повышением температуры.
- Вода плохо проводит тепло и электричество, но добавление небольшого количества кислоты или щелочи делает ее электропроводящей.
Вода как растворитель
- Воду также называют универсальным растворителем из-за ее способности растворять самые разные вещества.
- Эта способность обусловлена интенсивной водородной связью и полярностью молекул воды.
- Полярность воды заставляет воду вести себя по-разному с полярными и неполярными соединениями.
- Полярные молекулы воды могут образовывать слабые электростатические взаимодействия с другими полярными молекулами и ионами.
- Таким образом, полярные молекулы и ионы взаимодействуют с частично положительными и частично отрицательными концами воды, причем положительные заряды притягивают отрицательные заряды.
- Когда количество молекул воды в растворе больше, чем молекул растворенного вещества, взаимодействия приводят к образованию трехмерной водной сферы, называемой гидратной оболочкой, вокруг молекул растворенного вещества.
- Формирование гидратной оболочки обеспечивает равномерное диспергирование молекул растворенного вещества по всему раствору.
- Однако неполярные молекулы не взаимодействуют с водой и не образуют гидратных оболочек из-за отсутствия заряженных взаимодействий.
Высокая удельная теплоемкость
- Благодаря интенсивной водородной связи вода имеет очень высокую удельную теплоемкость и высокую теплоту испарения.
- Эти свойства позволяют воде смягчать климат и температуру Земли, смягчая большие колебания температуры.
- Аналогичный процесс происходит в организме, где вода предотвращает быстрое повышение температуры тела в результате различных биохимических реакций.
- Скрытая теплота плавления и испарения воды также высока, что предотвращает таяние ледников и дрейфующих льдов.
Аномальное расширение воды
- Аномальное расширение воды — это ненормальное свойство воды, когда вода расширяется, а не сжимается, когда температура повышается с 4 ° C до 0 ° C.
- Таким образом, плотность воды максимальна при 4 ° C и уменьшается с понижением температуры.
- Это свойство воды является следствием того, что молекулы воды в замерзающем состоянии удерживаются вместе притяжением HO, а не притяжением OO.
- Но поскольку взаимодействие HO не такое сильное, как взаимодействие OO, при замерзании наблюдается небольшое расширение воды.
Биологические функции воды
Некоторые биологические функции воды перечислены ниже:
- Вода — это жизненно важная жидкость организма, которая необходима для регулирования таких процессов, как пищеварение, транспортировка питательных веществ и экскреция. Вода растворяет ионные и полярные органические соединения и позволяет транспортировать продукты пищеварения к нужным местам в организме.
- Вода регулирует температуру тела за счет потоотделения и испарения.
- Вода является средой для всех метаболических реакций в организме, поскольку все метаболические реакции в организме происходят в фазе растворения.
- Вода также обеспечивает среду обитания для различных животных в виде прудов, рек, морей и т. д.
- Вода необходима для прорастания семян и процесса фотосинтеза, с помощью которого растения готовят себе пищу.
- Вода — это среда для переноса минералов из почвы в различные части растений.
- Вода помогает поддерживать структуру растений, обеспечивая соответствующее давление на ткани растения.
- Вода также способствует образованию различных биологических мембран, взаимодействуя с различными органическими соединениями.
- Вода также влияет на основные компоненты всех клеток, такие как ДНК и белки, где водородные связи регулируют сворачивание белков и нуклеиновых кислот.
- Структура двойной спирали ДНК также поддерживается молекулами воды, которые упорядоченно окружают ДНК.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник