Cu2o реагирует с водой
Оксид меди (I) Cu2O – красновато-коричневые кристаллы с кубической кристаллической решеткой, в которых реализуется линейно-тетраэдрическая координация атомов, плотность 6,1 г/см 3 , температура плавления 1242°С.
В воде не растворяется и не реагирует с ней. Имеет слабовыраженные амфотерные свойства с преобладанием основных.
Взаимодействует с растворами щелочей с образованием гидроксокомплексов:
В водных растворах аммиака образует гидроксид диамминмеди (I):
С соляной кислотой взаимодействует с образованием дихлорокупрата (I) водорода:
С бромоводородом и йодоводородом образует соли меди (I):
В разбавленной серной кислоте диспропорционирует, образуя сульфат меди (II) и металлическую медь:
Восстанавливается водородом, угарным газом и активными металлами до металлической меди:
Cu2O + Mg = 2Cu + MgO.
При нагревании окисляется кислородом воздуха:
Оксид меди (I) получают электролизом раствора хлорида натрия с использованием медных электродов. На катоде выделяется водород, а на аноде растворяется медь с образованием ионов Cu + , при взаимодействии с группами ОН — образуется Cu2O.
Оксид меди (I) образуется при нагревании до 1100°С оксида меди (II):
или при восстановлении сульфата меди глюкозой или гидразином в щелочной среде 
Гидроксид меди (I) CuOH как индивидуальное соединение не выделен. При взаимодействии солей меди (I) с щелочами в растворе образуется гидратированный оксид Cu2O · nH2O, из раствора выделяется только Cu2O. При растворении Cu2O в растворах щелочей образуется M[Cu(OH)2].
Источник
Химические свойства основных оксидов
Химические свойства основных оксидов
Подробно про оксиды, их классификацию и способы получения можно прочитать здесь.
1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении.
CuO + H2O ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль:
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
При взаимодействии основных оксидов с кислотами и их оксидами работает правило:
Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота).
Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N2O5, NO2, SO3 и т.д.).
| Основные оксиды, которым соответствуют щелочи | Основные оксиды, которым соответствуют нерастворимые основания |
| Реагируют со всеми кислотами и их оксидами | Реагируют только с сильными кислотами и их оксидами |
| Na2O + SO2 → Na2SO3 | CuO + N2O5 → Cu(NO3)2 |
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи . При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
CuO + Al2O3 ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
(чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al2O3 + H2O = H2Al2O4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO2. Получается алюминат-ион AlO2 — . Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.).
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями.
При оценке окислительно-восстановительной активности металлов и их ионов можно использовать электрохимический ряд напряжений металлов:

Восстановительные свойства (способность отдавать электроны) у простых веществ-металлов здесь увеличиваются справа налево, окислительные свойства ионов металлов — увеличиваются наоборот, слева направо. При этом некоторые ионы металлов в промежуточных степенях окисления могут проявлять также восстановительные свойства (например ион Fe 2+ можно окислить до иона Fe 3+ ).
Более подробно про окислительно-восстановительные реакции можно прочитать здесь.
Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0.
4.1. Восстановление углем или угарным газом.
Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
FeO + C = Fe + CO
Активные металлы, расположенные в ряду активности левее алюминия, активно взаимодействуют с углеродом, поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ:
CaO + 3C = CaC2 + CO
Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
CuO + CO = Cu + CO2
4.2. Восстановление водородом .
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
CuO + H2 = Cu + H2O
4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла)
При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
Например , оксид цинка взаимодействует с алюминием:
3ZnO + 2Al = Al2O3 + 3Zn
но не взаимодействует с медью:
ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
4.4. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.
Например , аммиак восстанавливает оксид меди (II):
3CuO + 2NH3 = 3Cu + 3H2O + N2
5. Взаимодействие оксидов металлов с окислителями.
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe 2+ , Cr 2+ , Mn 2+ и др.) могут выступать в качестве восстановителей.
Например , оксид железа (II) можно окислить кислородом до оксида железа (III):
Источник
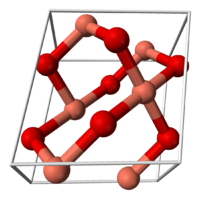
Оксид меди (II)
Оксид меди (II)
| Оксид меди(II) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид меди(II)) |
| Химическая формула | CuO |
| Отн. молек. масса | 79.545 а. е. м. |
| Молярная масса | 79.545 г/моль |
| Физические свойства | |
| Плотность вещества | 6.31 г/мл г/см³ |
| Состояние (ст. усл.) | черный порошок |
| Термические свойства | |
| Температура плавления | 1447 [1] °C |
| Температура разложения | 1100 °C |
| Химические свойства | |
| Растворимость в воде | нерастоворим г/100 мл |
| Классификация | |
| номер CAS | [1317-38-0] |
Окси́д ме́ди(II) (окись меди) CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Кристаллическая решётка оксида меди относится к типу моноклинных решёток, с симметрией группы C2h и параметрами решётки a = 4.6837(5), b = 3.4226(5), c = 5.1288(6), α = 90° , β = 99.54(1)°, γ = 90°. Атом меди окружён четырьмя атомами кислорода и имеет искажённую плоскую конфигурацию.
Содержание
Получение
Получить оксид меди(II) можно:
- нагревая металлическую медь на воздухе (при температурах выше 1100 °C получается оксид меди(II)):
Химические свойства
Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
При сплавлении CuO со щелочами образуются купраты:
При нагревании до 1100 °C разлагается:
Оксиду меди(II) соответствует гидроксид меди(II) Cu(OH)2, который является очень слабым основанием. Он способен растворяться в концентрированных растворах щелочей с образованием комплексов (то есть обладает слабыми амфотерными свойствами):
Оксид меди(II) может быть восстановлен до металлической меди при помощи аммиака, монооксидом углерода или водородом:
Применение
CuO используют при производстве стекла и эмалей для придания им зелёной и синей окраски. Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом цвет становится розовым.
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- The effect of hydrostatic pressure on the ambient temperature structure of CuO, Forsyth J.B., Hull S., J. Phys.: Condens. Matter 3 (1991) 5257-5261
Примечания
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Оксид меди (II)» в других словарях:
Оксид меди(I) — Оксид меди(I) … Википедия
Оксид меди(II) — Оксид меди(II) … Википедия
ОКСИД МЕДИ — ОКСИД МЕДИ, химическое соединение меди и кислорода, существующее в двух формах: закиси (Сu2О), блестящий красный порошок, встречающийся в природе в виде минерала куприта, и окиси (СuО), черного цвета, которая разлагается на Сu2О и кислород при… … Научно-технический энциклопедический словарь
оксид меди — (CuO) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN copper oxidecupric oxidecuprous oxide … Справочник технического переводчика
Оксид меди (I) — Оксид меди(I) (закись меди) Cu2O твёрдое вещество красно бурого цвета, нерастворимое в воде и органических растворителях. Температура плавления 1235 °C. При нагревании до 1800 °C разлагается на металлическую медь и кислород. В природе оксид… … Википедия
Оксид меди — Известно три оксида меди: Оксид меди(I) Cu2O Оксид меди(II) CuO Оксид меди(III) Cu2O3 … Википедия
Оксид меди(III) — Общие Систематическое наименование Оксид меди(III) Традиционные названия Окисел медь Химическая формула Cu2O3 Физические свойства Состояни … Википедия
Оксид — (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся… … Википедия
Меди оксиды — Известно три оксида меди: Оксид меди(I) Cu2O Оксид меди(II) CuO Оксид меди(III) Cu2O3 … Википедия
Оксид-сульфат титана — Общие Систематическое наименование Оксид сульфат титана Традиционные названия Основной сернокислый титан; оксосульфат титана; сульфат титанила Химическая формула TiOSO4 Физические свойства … Википедия
Источник









