- Тема V. Работа 4. Итоговая по теме V. Вариант 4
- Вопросы:
- Решения и ответы:
- Даны вещества соляная кислота гидроксид кальция вода
- даны вещества:соляная кислота,гидроксид кальция,вода,оксид фосфора 5 валентный, оксид магния. С какими из перечисленных веществ может взаимодействовать
- Другие вопросы из категории
- Читайте также
- Даны вещества соляная кислота гидроксид кальция вода
- Решите К. Р. по химии за 8 класс.
Тема V. Работа 4. Итоговая по теме V. Вариант 4
Вопросы:
1. Даны вещества: вода, соляная кислота, магний, гидроксид бария, оксид натрия, гидроксид меди(II). Какие из них будут взаимодействовать между собой? Напишите уравнения реакций и назовите образующиеся вещества.
2. Напишите уравнения реакций, позволяющих осуществить следующие превращения:

3. Чем сходны и чем различаются по составу и свойствам основные и кислотные оксиды? Ответ поясните примерами.
4. Рассчитайте количество вещества (моль) и массу каждого продукта, образующегося при проведении следующих превращений: гидроксид меди(II) → оксид меди(II) → хлорид меди(II), если было взято 49 г гидроксида меди(II).
Решения и ответы:
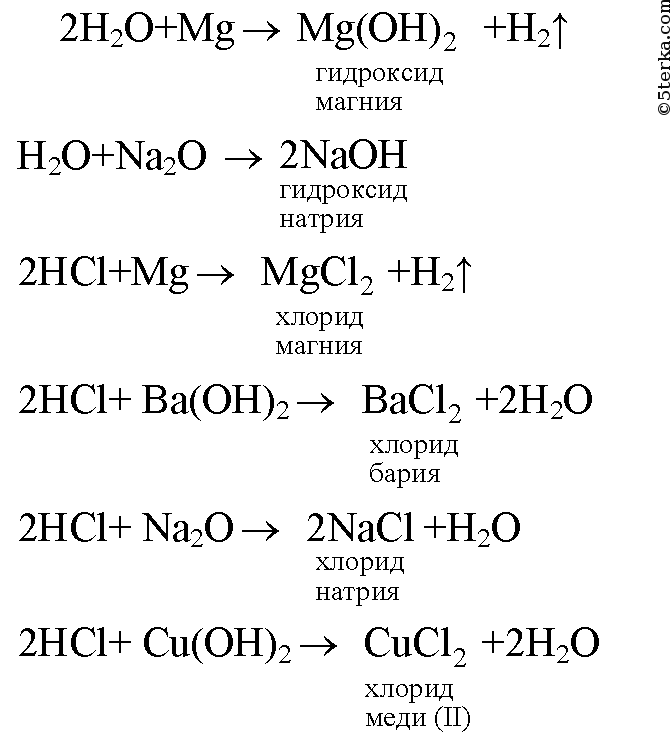

3. Основные оксиды образованы эелементами металлов и кислородом, а кислотные оксиды элементами неметаллов и кислородом:



задача №4
к главе «Тема V. Важнейшие классы неорганических соединений. Работа 4. Итоговая по теме V».
Источник
Даны вещества соляная кислота гидроксид кальция вода
Внимание: в случае ухудшения самочувствия перед началом опытов или во время их выполнения обязательно сообщите об этом организатору в аудитории.
1. Вы приступаете к выполнению эксперимента. Для этого получите лоток с лабораторным оборудованием и реактивами у специалиста по обеспечению лабораторных работ в аудитории.
2. Прочтите ещё раз перечень веществ, приведённый в тексте к заданиям 23 и 24, и убедитесь, что на выданном лотке находится пять перечисленных в перечне реактивов.
3. Перед началом выполнения эксперимента осмотрите ёмкости с реактивами и определите способ работы с ними. При этом обратите внимание на рекомендации, которым Вы должны следовать.
— В склянке находится пипетка. Это означает, что отбор жидкости и переливание её в пробирку для проведения реакции необходимо проводить только с помощью пипетки. Для проведения опытов отбирают 7–10 капель реактива.
— Пипетка в склянке с жидкостью отсутствует. В этом случае переливание раствора осуществляют через край склянки, которую располагают так, чтобы при её наклоне этикетка оказалась сверху («этикетку — в ладонь!»). Склянку медленно наклоняют над пробиркой, пока нужный объём раствора не перельётся в неё. Объём перелитого раствора должен составлять 1–2 мл (1–2 см).
— Для проведения опыта требуется порошкообразное (сыпучее) вещество. Отбор порошкообразного вещества из ёмкости осуществляют только с помощью ложечки или шпателя.
— При отборе исходного реактива взят его излишек. Возврат излишка реактива в исходную ёмкость категорически запрещён. Его помещают в отдельную, резервную пробирку.
— Сосуд с исходным реактивом (жидкостью или порошком) обязательно закрывается крышкой (пробкой) от этой же ёмкости.
— При растворении в воде порошкообразного вещества или при перемешивании реактивов следует слегка ударять пальцем по дну пробирки.
— Для определения запаха вещества взмахом руки над горлышком сосуда с веществом направляют пары этого вещества на себя.
— Для проведения нагревания пробирки с реактивами на пламени спиртовке необходимо:
1) снять колпачок спиртовки и поднести зажжённую спичку к её фитилю;
2) закрепить пробирку в пробиркодержателе на расстоянии 1–2 см от горлышка пробирки;
3) внести пробирку в пламя спиртовки и передвигать её в пламени вверх и вниз так, чтобы пробирка с жидкостью равномерно прогрелась;
4) далее следует нагревать только ту часть пробирки, где находятся вещества, при этом пробирку удерживать в слегка наклонном положении;
5) открытый конец пробирки следует отводить от себя и других лиц;
6) после нагревания жидкости пробиркодержатель с пробиркой поместить в штатив для пробирок;
7) фитиль спиртовки закрыть колпачком.
— Если реактивы попали на рабочий стол, их удаляют с поверхности стола с помощью салфетки.
— Если реактив попал на кожу или одежду, необходимо незамедлительно обратиться за помощью к специалисту по обеспечению лабораторных работ в аудитории.
4. Вы готовы к выполнению эксперимента. Поднимите руку и пригласите организатора в аудитории, который пригласит экспертов предметной комиссии для оценивания проводимого Вами эксперимента.
5. Начинайте выполнять опыт. Записывайте в черновике свои наблюдения за изменениями, происходящими с веществами в ходе реакций.
6. Вы завершили эксперимент. В бланке ответов № 2 подробно опишите наблюдаемые изменения, которые происходили с веществами в каждой из двух проведённых Вами реакций. Сделайте вывод о химических свойствах веществ (кислотно-оснόвных, окислительно-восстановительных), участвующих в реакции, и классификационных признаках реакций.
Подготовьте лабораторное оборудование, необходимое для проведения эксперимента. Проведите химические реакции между гидроксидом кальция и выбранными веществами в соответствии с составленными уравнениями реакции, соблюдая правила техники безопасности, приведённые в инструкции к заданию. Опишите изменения, происходящие с веществами в ходе проведённых реакций.
Дан раствор гидроксида кальция, а также набор следующих реактивов: газообразный оксид углерода(IV), водные растворы гидроксида натрия, фосфорной кислоты, нитрата бария и металлический цинк.
Используя только реактивы из приведённого перечня, запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства гидроксида кальция, и укажите признаки их протекания.
Составлены уравнения двух реакций, характеризующих химические свойства гидроксида кальция, и указаны признаки их протекания:
1. — выпадение белого осадка;
2. — выпадение белого осадка.
Источник
даны вещества:соляная кислота,гидроксид кальция,вода,оксид фосфора 5 валентный, оксид магния. С какими из перечисленных веществ может взаимодействовать
:а)гидроксид натрия б)гидроксид железа 3 валентный?Напишите уравнения соответствующих реакций.Укажите тип каждой реакции
HCl+NaOH=NaCl+H2O-соединение
P2O5 + 6NaOH = 2Na3PO4 + 3H2O-соединение
Fe(OH)3+HCl=FeCl3+H2O-соединение
Fe(OH)3+P2O5=FePO4+H2O-соединение
Другие вопросы из категории
2Mg + O2 = 2MgО (СРОЧНО)
Найти массу 0,5 моль H2So4 (серой кислоты)
Сколько молекул в
в 2 моль Co2
В 1,8г H2O
Читайте также
кислород и гидроксид натрия
4) аммиак и диоскид кремния
В какой из приведенных пар оба вещества взаимодействуют с раствором азотной кислоты:
1)сера и нитрат серебра
2)серебро и аммиак
3)медь и гидроксид кальция
4)гидроскид меди и раствор хлорида натрия
Какое из перечисленных веществ не образует аллотропных модификаций:
(4),оксид меди (2), серной кислотой, гидроксид кальция.
1) NO
2) NaCl
3) H2
4) H2O
В перечне веществ к кислотным оксидам относят:
1) Na2O, N2O5, CaO
2) N2O5, SO2, SiO2
3) CaO, SiO2, SO3
4) CuO, CO2, MgO
С какими из перечисленных веществ будет взаимодействовать оксид азота (V).
1) KOH;
2) HCl;
3) NaCl;
4) O2
Какие химические свойства характерны для оксида кальция?
Выбери правильный ответ.
1) газ при обычных условиях;
2) вещество твердое, белого цвета;
3) твердое вещество черного цвета;
4) бесцветная летучая жидкость.
А5. Как называется вещество SO3?
1) оксид серы;
2) оксид серы (II)
3) оксид серы (VI)
4) оксид серы (IV).
А6. Оксиды образуются:
1) при горении простых и сложных веществ;
2) при разложении растворимых оснований;
3) только при горении сложных веществ;
4) при разложении кремниевой кислоты.
С какими из перечисленных веществ будет вступать в реакцию оксид цинка?
1) H2O
2) HCl
3) O2
4) Al2O3
Установи соответствие между формулой и названием соответствующего оксида:
Формула
Название оксида
А) CuO
Б) Na2O
В) Mn2O7
Г) SO3
1) оксид меди (II)
2) оксид натрия
3) оксид серы (VI)
4) оксид марганца (II)
5) оксид калия
6) оксид марганца (VII)
Установи соответствие между формулой оксида и реагентами с каждым, из которых он может взаимодействовать.
Формула
Реагенты
А) Na2O
Б) CO2
В) Al2O3
1) HCl, Na(OH), K2CO3
2) H2O, CaO, Ca(OH)2
3) CO2, H2SO4, H2O
4) CaCl2, SiO2, K2O
Оксид ванадия (V) получают сжиганием порошка металла в кислороде. Рассчитай массу ванадия, необходимую для получения оксида массой 50 г.
правильного ответа нет.
2. Какое из перечисленных веществ является природным сырьем для промышленного получения суперфосфата?
г) правильного ответа нет.
3.Какое из перечисленных веществ не реагирует с разбавленной азотной кислотой?
с каким из перечисленных веществ взаимодействует K2O 1.H2O 2.FeO 3.CuSO4 4.N2O5 5.NaOH 6.H2SO4
Источник
Даны вещества соляная кислота гидроксид кальция вода
1. Составьте сокращённое ионное уравнение упомянутой в тексте реакции между гидроксидом кальция и соляной кислотой.
2. Объясните, почему эту реакцию используют для повышения рН воды.
Прочитайте следующий текст и выполните задания 6—8.
В пищевой промышленности используется пищевая добавка Е526, которая представляет собой гидроксид кальция Ca(OH)2. Она находит применение при производстве: фруктовых соков, детского питания, маринованных огурцов, пищевой соли, кондитерских изделий и сладостей.
Получение гидроксида кальция в промышленном масштабе возможно путём смешивания оксида кальция с водой, этот процесс называется гашение.
Широкое применение гидроксид кальция получил в производстве таких строительных материалов, как белила, штукатурка и гипсовые растворы. Это связано с его способностью взаимодействовать с углекислым газом CO2, содержащимся в воздухе. Это же свойство раствора гидроксида кальция применяется для измерения количественного содержания углекислого газа в воздухе.
Полезным свойством гидроксида кальция является его способность выступать в роли флокулянта, очищающего сточные воды от взвешенных и коллоидных частиц (в том числе солей железа). Он также используется для повышения рН воды, так как природная вода содержит вещества (например, кислоты), вызывающие коррозию в сантехнических трубах.
Источник
Решите К. Р. по химии за 8 класс.
1В
1.Даны вещества: соляная кислота, оксид магния, гидроксид натрия, оксид серы шесть, гидроксид железа три. Напишите уравнение всех возможных реакций между указанными веществами; Назовите продукты реакций.
2. С какими из перечисленных веществ будет реагировать разбавленная серная кислота: железо, оксид бария, карбонат кальция, медь, гидроксид алюминия, хлорид цинка? Напишите уравнение возможных реакций; Назовите образующие вещества.
3. Напишите уравнения реакций с помощью которых можно осуществить следующие превращения: СuO в Сu(NOтри) два в Cu(OH)два в СuO в СuClдва в Cu
4. Напишите уравнение реакций, в результате которых можно получить следующие вещества: а) Гидроксид натрия; б) ортофосфорную кислоту; в) хлорид алюминия;
5. Вычислите объём водорода (н. у.) , образующего при взаимодействии 13 грамм цинка с избытком раствора серной кислоты.
2.С чем будет реагировать соляная кислота: цинк, гидроксид бария, сульфат меди два, ртуть, оксид железа три, карбонат калия? Напишите уравнения возможных реакций; Назовите образующие вещества.
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Al2O3.в AlCl3 в Al(OH)3 в Al2O3 в Al2(SO4)3 в Al(NO3)3
4. Напишите уравнение реакций, в результате которых можно получить следующие вещества: а) хлорид меди; б) серную кислоту; в) гидроксид магния.
5. Вычислите массу 20%-ного раствора соляной кислоты, который потребуется для полной нейтрализации 18,5 грамм гидроксида кальция.
ешите К. Р. по химии за 8 класс. Чак Норрис Ученик (27), Вопрос открыт 1 минуту назад1В
1.Даны вещества: соляная кислота, оксид магния, гидроксид натрия, оксид серы шесть, гидроксид железа три. Напишите уравнение всех возможных реакций между указанными веществами; Назовите продукты реакций.
2. С какими из перечисленных веществ будет реагировать разбавленная серная кислота: железо, оксид бария, карбонат кальция, медь, гидроксид алюминия, хлорид цинка? Напишите уравнение возможных реакций; Назовите образующие вещества.
3. Напишите уравнения реакций с помощью которых можно осуществить следующие превращения: СuO в Сu(NOтри) два в Cu(OH)два в СuO в СuClдва в Cu
4. Напишите уравнение реакций, в результате которых можно получить следующие вещества: а) Гидроксид натрия; б) ортофосфорную кислоту; в) хлорид алюминия;
5. Вычислите объём водорода (н. у. ) , образующего при взаимодействии 13 грамм цинка с избытком раствора серной кислоты.
2.С чем будет реагировать соляная кислота: цинк, гидроксид бария, сульфат меди два, ртуть, оксид железа три, карбонат калия? Напишите уравнения возможных реакций; Назовите образующие вещества.
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Al2O3.в AlCl3 в Al(OH)3 в Al2O3 в Al2(SO4)3 в Al(NO3)3
4. Напишите уравнение реакций, в результате которых можно получить следующие вещества: а) хлорид меди; б) серную кислоту; в) гидроксид магния.
5. Вычислите массу 20%-ного раствора соляной кислоты, который потребуется для полной нейтрализации 18,5 грамм гидроксида кальция.
ЧТА ?
Источник





