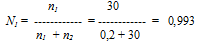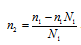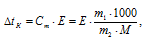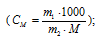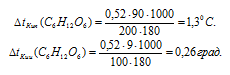- Вычисление понижения давления газа при указанной температуре
- Молекулярная физика. Насыщенные и ненасыщенные пары.
- Насыщенный пар.
- Давление насыщенного пара .
- Зависимость давления насыщенного пара от температуры.
- Ненасыщенный пар.
- Насыщенный и ненасыщенный пар
- Фазовые переходы: изменение агрегатных состояний вещества
- Парообразование
- Температура кипения
- Испарение и конденсация
- Определение насыщенного пара
- Свойства насыщенного пара
- Решение задач по теме «Насыщенный пар»
Вычисление понижения давления газа при указанной температуре
Задача 475
При 315 К давление насыщенного пара над водой равно 8,2 кПа (61,5 мм рт. ст.). На сколько понизится давление пара при указанной температуре, если в 540 г воды растворить 36 г глюкозы С6Н12О6?
Решение:
M(С6Н12О6) = 180,г/моль, М(Н2О) – 18,г/моль.
Для расчета по формуле P1 = N1P0 нужно вычислить мольную долю растворителя N1. Мольная масса воды равна 18,г/моль, мольная масса глюкозы — 180 г/моль. Количество воды и сахарозы соответственно равны:
Находим мольную долю воды:
Р1= 0,993 . 8,2 = 8,14 кПа.
Понижение давления пара находим по формуле:

Ответ: 0,06кПа.
Задача 476.
При 293 К давление насыщенного пара над водой равно 2,34 кПа (17,53 мм рт. ст.). Сколько граммов глицерина С3Н5(ОН)3 надо растворить в 180 г воды, чтобы понизить давление пара на 133,3 Па (1 мм рт. ст.)?
Решение:
M[С3Н5(ОН)3] = 92г/моль, М(Н2О) = 18,г/моль.
Из формулы: 
Р1 — Р0 — 
Из формулы P1 = N1P0 находим мольную долю растворителя N1, получим:
Из уравнения 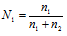
где n1 – число молей растворителя, n2 – число молей растворенного вещества получим выражение для расчета числа молей растворённого вещества глицерина, получим:
Количество воды равно: n1 = 18/18 = 10 моль;
Находим количество глицерина: 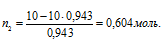
Находим массу глицерина из формулы n2 = m/M, где m – масса вещества; М – мольная масса вещества.
Тогда m = n2M =0,604 . 92 = 55,6г.
Ответ: 55,6г.
Задача 477.
На сколько градусов повысится температура кипения воды, если в 100 г воды растворить 9 г глюкозы С6Н12О6?Решение:
М(С6Н12О6) = 180г/моль. Для расчетов используем уравнение:
где СМ — моляльная концентрация, рассчитаем по уравнению:
где m1 — масса растворённого вещества; m2 — масса растворителя; М – молярная масса растворённого вещества; Е – эбуллиоскопическая константа (для воды Е = 0,52); 
Находим повышение температуры кипения растворов глюкозы:
Ответ: на 0,26 град.
Задача 478.
При какой приблизительно температуре будет кипеть 50%-ный (по массе) раствор сахарозы C12H22О11?
Решение:
M( С12Н22О11 ) = 342г/моль.
При пересчете на 1000 г Н2О содержание сахарозы в растворе равно 500 г. Поскольку мольная масса сахарозы составляет 342 г/моль, то моляльность раствора рассчитаем по уравнению:
где m1 — масса растворённого вещества; m2 — масса растворителя; М – молярная масса растворённого вещества; Е – эбуллиоскопическая константа (для воды Е = 0,52); 
Находим повышение температуры кипения растворов сахарозы:
СМ = (500 . 1000)/(1000 . 342) = 1,46 моля на 1000 г Н2О.
По формуле 

Источник
Молекулярная физика. Насыщенные и ненасыщенные пары.
Насыщенный пар.
При испарении одновременно с переходом молекул из жидкости в пар происходит и обратный процесс. Беспорядочно двигаясь над поверхностью жидкости, часть молекул, покинувших ее, снова возвращается в жидкость.
Если испарение происходит в закрытом сосуде, то сначала число молекул, вылетевших из жидкости, будет больше числа молекул, возвратившихся обратно в жидкость. Поэтому плотность пара в сосуде будет постепенно увеличиваться. С увеличением плотности пара увеличивается и число молекул, возвращающихся в жидкость. Довольно скоро число молекул, вылетающих из жидкости, станет равным числу молекул пара, возвращающихся обратно в жидкость. С этого момента число молекул пара над жидкостью будет постоянным. Для воды при комнатной температуре это число приблизительно равно 10 22 молекул за 1 с на 1 см 2 площади поверхности. Наступает так называемое динамическое равновесие между паром и жидкостью.
Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным паром.
Это означает, что в данном объеме при данной температуре не может находиться большее количество пара.
При динамическом равновесии масса жидкости в закрытом сосуде не изменяется, хотя жидкость продолжает испаряться. Точно так же не изменяется и масса насыщенного пара над этой жидкостью, хотя пар продолжает конденсироваться.
Давление насыщенного пара .
При сжатии насыщенного пара, температура которого поддерживается постоянной, равновесие сначала начнет нарушаться: плотность пара возрастет, и вследствие этого из газа в жидкость будет переходить больше молекул, чем из жидкости в газ; продолжаться это будет до тех пор, пока концентрация пара в новом объеме не станет прежней, соответствующей концентрации насыщенного пара при данной температуре (и равновесие восстановится). Объясняется это тем, что число молекул, покидающих жидкость за единицу времени, зависит только от температуры.
Итак, концентрация молекул насыщенного пара при постоянной температуре не зависит от его объема.
Поскольку давление газа пропорционально концентрации его молекул, то и давление насыщенного пара не зависит от занимаемого им объема. Давление р0, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара.
При сжатии насыщенного пара большая его часть переходит в жидкое состояние. Жидкость занимает меньший объем, чем пар той же массы. В результате объем пара при неизменной его плотности уменьшается.
Зависимость давления насыщенного пара от температуры.
Для идеального газа справедлива линейная зависимость давления от температуры при постоянном объеме. Применительно к насыщенному пару с давлением р0 эта зависимость выражается равенством:
Так как давление насыщенного пара не зависит от объема, то, следовательно, оно зависит только от температуры.
Экспериментально определенная зависимость p0(T) отличается от зависимости (p0=nkT) для идеального газа.
С увеличением температуры давление насыщенного пара растет быстрее, чем давление идеального газа (участок кривой АВ на рисунке). Это становится особенно очевидным, если провести изохору через точку A (пунктирная прямая). Происходит это потому, что при нагревании жидкости часть ее превращается в пар, и плотность пара растет. Поэтому, согласно формуле (p0=nkT), давление насыщенного пара растет не только в результате повышения температуры жидкости, но и вследствие увеличения концентрации молекул (плотности) пара. Главное различие в поведении идеального газа и насыщенного пара заключается в изменении массы пара при изменении температуры при неизменном объеме (в закрытом сосуде) или при изменении объема при постоянной температуре. С идеальным газом ничего подобного происходить не может (молекулярно-кинетическая теория идеального газа не предусматривает фазового перехода газа в жидкость).
После испарения всей жидкости поведение пара будет соответствовать поведению идеального газа (участок ВС кривой на рисунке выше).
Ненасыщенный пар.
Если в пространстве, содержащем пары какой-либо жидкости, может происходить дальнейшее испарение этой жидкости, то пар, находящийся в этом пространстве, является ненасыщенным.
Пар, не находящийся в состоянии равновесия со своей жидкостью, называется ненасыщенным.
Ненасыщенный пар можно простым сжатием превратить в жидкость. Как только это превращение началось, пар, находящийся в равновесии с жидкостью, становится насыщенным.
Источник
Насыщенный и ненасыщенный пар
О чем эта статья:
Фазовые переходы: изменение агрегатных состояний вещества
Прежде чем говорить о насыщенном паре, нужно освежить знания об агрегатных состояниях и фазовых переходах между ними. Если вы забыли, какие бывают агрегатные состояния, то можете сбегать в нашу статью про них.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Вот какие бывают фазовые переходы:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
На схеме — названия всех фазовых переходов:
Фазовые переходы — важная штука. Все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы в металлургии и микроэлектронике.
Парообразование
Итак, парообразование — это переход из жидкого состояния в газообразное.
При парообразовании всегда происходит поглощение энергии: к веществу необходимо подводить теплоту, чтобы оно испарялось. Из-за этого внутренняя энергия вещества увеличивается.
У процесса парообразования есть две разновидности: испарение и кипение.
Испарение — это превращение или переход жидкости в газ (пар) со свободной поверхности жидкости. Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
Кипение — процесс интенсивного парообразования, который происходит в жидкости при определенной температуре.
Например, мы заварили себе горячий чай. Над чашкой мы увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. 🤔 Это действительно так, но при этом оба процесса могут происходить параллельно.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Физика объясняет испарение тем, что жидкость обычно несколько холоднее окружающего воздуха, и из-за разницы температур происходит испарение.
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
Направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
из глубины жидкости к поверхности, а затем в воздух;
только из жидкости к поверхности;
к поверхности из воды и газовой среды одновременно;
к площади поверхности только от воздуха.
Подытожим, чтобы не запутаться, в чем главная разница между испарением и кипением:
при любой температуре
с поверхности жидкости
при определенной температуре
с поверхности жидкости
Температура кипения
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость — чаще всего это атмосферное давление. Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
При нормальном атмосферном давлении, которое приблизительно равно 100 кПа, температура кипения воды равна 100°C. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре 100 градусов по Цельсию равно 100 кПа. Это значение пригодится при решении задач.
Чем выше мы поднимаемся, тем меньше становится атмосферное давление, потому что масса атмосферы над нами уменьшается. Так, например, на вершине Эльбруса атмосферное давление составляет 5 × 104 Па — в два раза меньше, чем нормальное атмосферное давление. Поэтому и температура кипения на вершине Эльбруса будет ниже, чем на уровне моря. Вода там закипит при температуре 82°C.
Температура кипения при нормальном атмосферном давлении — это строго определенная величина для каждой жидкости.
Испарение и конденсация
Молекулы в жидкости непрерывно и хаотично движутся. Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Значения скоростей молекул случайны. Из-за этого среди всех молекул обязательно есть те, что движутся очень быстро. Если такая молекула окажется вблизи поверхности раздела жидкости и окружающей среды, то ее кинетическая энергия может достигнуть большого значения, и молекула покинет жидкость.
Собственно, именно так происходит процесс испарения (мы говорили о нем выше, когда речь шла о фазовых переходах). Когда испарившихся молекул становится много, образуется пар.
Обратный процесс тоже возможен: вырвавшиеся за пределы жидкости молекулы вернутся в жидкость. Это конденсация, о ней мы тоже говорили.
Если открыть сосуд с жидкостью, то испарившиеся молекулы будут покидать пространство над жидкостью и не возвращаться обратно. Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Испарение может происходить с разной скоростью. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии преодолеть эти силы притяжения и вылететь наружу, и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее — вода. Намного медленнее воды испаряются масло и ртуть.
Определение насыщенного пара
Оставим стакан воды на столе и будем замерять уровень воды в нем каждый день. Если записать эти измерения и сравнить их, станет очевидно: уровень воды стал меньше, то есть вода испарилась.
Теперь давайте накроем стакан сверху. Молекулы пара уже не смогут покидать пространство над жидкостью, по мере испарения их количество начнет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Сначала количество конденсирующихся молекул за единицу времени будет меньше количества испаряющихся молекул. Но по мере роста концентрации пара (то есть увеличении количества молекул в единице объема пара) поток конденсирующихся молекул вырастет. Это приведет к состоянию, которое называется динамическим равновесием.
Пар, находящейся в динамическом равновесии, называют насыщенным.
Представьте себе огромный бизнес-центр с не менее огромными дверями. У сотрудников бизнес-центра разный график работы, поэтому люди одновременно заходят в здание и выходят из него в произвольном количестве. Допустим, в 6 часов вечера 100 человек заходят в здание, чтобы попасть на деловую встречу, а другие 100 человек уже закончили работать и идут домой. Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Значение давления насыщенного пара и его плотности являются максимальными при заданном значении температуры. Если это не так, то пар ненасыщенный.
Свойства насыщенного пара
При постоянной температуре плотность насыщенного пара не зависит от его объема.
Представьте, что объем сосуда с насыщенным паром уменьшили, не изменив температуры.
Количество молекул, переходящих от пара к жидкости, превысит количество испаряющихся молекул, но при этом часть пара сконденсируется, а оставшийся пар снова придет в динамическое равновесие. В итоге плотность этого пара будет равна начальной плотности.
Давление насыщенного пара не зависит от его объема.
Это связано с тем, что давление и плотность связаны через уравнение Менделеева-Клапейрона, и следует из первого свойства насыщенного пара.
Кстати, уравнение Менделеева-Клапейрона справедливо для насыщенного пара. При этом нужно быть внимательным с частными случаями. Так, например, закон Бойля-Мариотта для насыщенного пара не выполняется.
pV = νRT
p — давление газа [Па]
V — объем [м3]
ν — количество вещества [моль]
T — температура [К]
R — универсальная газовая постоянная
R = 8,31 м 2 × кг × с -2 × К -1 × моль -1
При неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры.
В начальный момент испарения динамическое равновесие будет нарушено (некоторая часть жидкости испарится дополнительно). Плотность пара будет расти, пока динамическое равновесие не восстановится.
Давление и температура насыщенного пара растут быстрее, чем по линейному закону, который справедлив для идеального газа.
В случае идеального газа рост давления обусловлен только ростом температуры, а в случае с насыщенном паром имеют значение два фактора: температура и масса пара.
В случае нагревания насыщенного пара молекулы начинают ударяться чаще, так как их в целом стало больше, потому что пара стало больше.
Главное отличие насыщенного пара от идеального газа: пар сам по себе не является замкнутой системой, а находится в постоянном контакте с жидкостью.
Решение задач по теме «Насыщенный пар»
Применим свойства насыщенного пара при решении задач.
Задачка раз
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните.
Решение
Так как пар и вода находятся в контакте длительное время, пар является насыщенным. При уменьшении объема сосуда давление насыщенного пара не меняется. Из уравнения Менделеева-Клапейрона следует, что для того, чтобы давление пара не менялось, его количество вещества (а значит и масса) должно уменьшаться.
В этом процессе происходит конденсация, часть молекул пара переходят в жидкость, поэтому масса жидкости увеличивается.
Ответ
Масса жидкости увеличивается.
Задачка два
Какова плотность насыщенного пара при температуре 100°С?
Решение
При нормальном давлении (p = 105 Па) 100°С — это температура кипения воды. Значит, давление насыщенного пара при этой температуре равно атмосферному давлению.
Найдем связь между давлением и плотностью через уравнение Менделеева-Клапейрона.
Подставим значение давления в уравнение состояния идеального газа, предварительно переведя температуру в Кельвины: T = 100 + 273 = 373 K
Источник