- Гидролиз гидрофосфата натрия
- Общие сведения о гидролизе гидрофосфата натрия
- Гидролиз гидрофосфата натрия
- Примеры решения задач
- Дигидрофосфат натрия
- Содержание
- Получение
- Физические свойства
- Химические свойства
- Применение
- Литература
- Полезное
- Смотреть что такое «Дигидрофосфат натрия» в других словарях:
- Дигидрофосфат натрия
- Содержание
- Получение
- Физические свойства
- Химические свойства
- Применение
Гидролиз гидрофосфата натрия
Общие сведения о гидролизе гидрофосфата натрия
Рис. 1. Гидрофосфат натрия. Внешний вид.
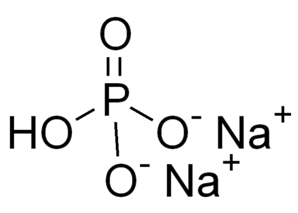
Брутто-формула – Na2HPO4. Молярная масса равна гидрофосфата натрия 141,96 г/моль. Молекула имеет строение:
Хорошо растворяется в воде (гидролизуется по аниону). Образует изополисоединения.
Гидролиз гидрофосфата натрия
Гидрофосфат натрия представляет собой кислую соль, образованную слабой кислотой – фосфорной (H3PO4) и сильным основанием – гидроксидом натрия (NaOH):
Подвергается гидролизу по аниону. Характер среды водного раствора гидрофосфата натрия – щелочной. Уравнение гидролиза будет выглядеть следующим образом:
2Na + +HPO4 2- + H2O ↔ H2PO4 — + 2Na + + OH — (полное ионное уравнение);
HPO4 2- + H2O ↔ H2PO4 — + OH — (сокращенное ионное уравнение);
Теоретически возможна вторая ступень гидролиза:
Примеры решения задач
| Задание | Составьте уравнения реакций гидролиза следующих солей в молекулярной, ионной и сокращенной ионной формах: а) NaHSO3; б) NaF; в) MgCl2; г) Na2CO3; д)FeCl3. Укажите реакцию среды. |
| Ответ | Гидролизу подвергаются соли, в составе которых присутствует «слабый ион», те. Они должны быть образованы слабой кислотой и сильным основанием, сильной кислотой и слабым основанием или слабой кислотой и слабым основанием. |
Наличие гидроксид-ионов свидетельствует о щелочном характере среды.
Слабого иона нет, поскольку соль образована сильным основанием (гидроксидом натрия) и сильной кислотой (фтороводородной). Гидролизу не подвергается. Среда нейтральная.
Слабого иона нет, поскольку соль образована сильным основанием (гидроксидом магния) и сильной кислотой (хлороводородной). Гидролизу не подвергается. Среда нейтральная.
Наличие гидроксид-ионов свидетельствует о щелочном характере среды.
Fe 3+ + HOH ↔ FeOH 2+ + H + ;
Наличие ионов водорода свидетельствует о кислом характере среды.
| Задание | Установите соответствие между названием соли и отношением её к гидролизу: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ответ | а) Нитрат калия представляет собой соль, образованную сильной кислотой (азотной) и сильным основанием (гидроксидом калия): Гидролизу не подвергается. Вариант 4. б) Сульфид бария представляет собой соль, образованную слабой кислотой (сероводородной) и сильным основанием (гидроксидом бария): Подвергается гидролизу по аниону. Вариант 2. в) хлорид алюминия представляет собой соль, образованную сильной кислотой (хлороводородной) и слабым основанием (гидроксидом алюминия): Подвергается гидролизу по катиону. Вариант 1. г) карбонат натрия представляет собой соль, образованную слабой кислотой (угольной) и сильным основанием (гидроксидом натрия): Подвергается гидролизу по аниону. Вариант 2. Источник Дигидрофосфат натрия
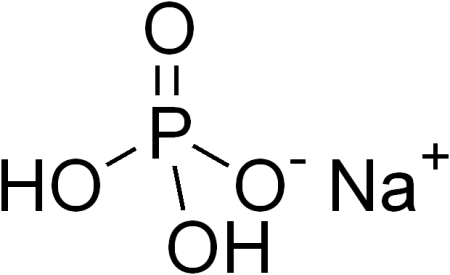
Дигидрофосфат натрия — неорганическое соединение, кислая соль щелочного металла натрия и ортофосфорной кислоты с формулой NaH2PO4, бесцветные кристаллы, хорошо растворимые в воде, образует кристаллогидраты. СодержаниеПолучение
Физические свойстваДигидрофосфат натрия образует бесцветные кристаллы. Хорошо растворимы в воде, плохо в этаноле. Образует несколько кристаллогидратов NaH2PO4•n H3O, где n = 1, 2, которые плавятся в кристаллизационной воде при 100, 60°С соответственно. Химические свойства
Применение
Литература
Wikimedia Foundation . 2010 . ПолезноеСмотреть что такое «Дигидрофосфат натрия» в других словарях:Натрия фосфаты — Известны следующие фосфаты натрия: Дигидрофосфат натрия NaH2PO4 Гидрофосфат натрия Na2HPO4 Ортофосфат натрия Na3PO4 Применение Употребляются для буферных растворов различного назначения, как эмульгаторы в пищевой промышленности … Википедия Гидрофосфат натрия — Гидрофосфат натрия … Википедия Гидрокарбонат натрия — Гидрокарбонат натрия … Википедия Тетраборат натрия — Минерал Tincalconite … Википедия Хлорид натрия — Хлорид натрия … Википедия Нитропруссид натрия — Статья инструкция. Текст данной статьи практически полностью повторяет инструкцию по применению лекарственного средства, предоставляемую его производителем. Это нарушает правило о недопустимости инструкций в энциклопедических статьях. Кроме того … Википедия Бромид натрия — Бромид натрия … Википедия Гидроксид натрия — Гидроксид натрия … Википедия Карбонат натрия — Карбонат натрия … Википедия Тиосульфат натрия — Тиосульфат натрия … Википедия Источник Дигидрофосфат натрия
Дигидрофосфат натрия — неорганическое соединение, кислая соль щелочного металла натрия и ортофосфорной кислоты с формулой NaH2PO4, бесцветные кристаллы, хорошо растворимые в воде, образует кристаллогидраты. СодержаниеПолучение
H3PO4 + NaOH → NaH2PO4 + H2O
Na2HPO4 + H3PO4 → 2NaH2PO4
P4 + 10H2O2 + 4NaOH → 4NaH2PO4 + 8H2O Физические свойстваДигидрофосфат натрия образует бесцветные кристаллы. Хорошо растворимы в воде, плохо в этаноле. Образует несколько кристаллогидратов NaH2PO4· n H2O, где n = 1, 2, которые плавятся в кристаллизационной воде при 100, 60 °C соответственно. Расплавы кристаллогидратов, равно как концентрированные растворы дигидрофосфата натрия представляют собой вязкие мутные опалесцирующие жидкости, легко кристаллизующиеся при понижении температуры в полупрозрачную стекловидную массу. Химические свойства
NaH2PO4 ⋅ 2H2O → 100oC NaH2PO4 + 2H2O
2NaH2PO4 → 160oC Na2H2P2O7 + H2O
NaH2PO4 → 220−250oC NaPO3 + H2O
NaH2PO4 + NaOH → Na2HPO4 + H2O NaH2PO4 + 2NaOH → Na3PO4 + 2H2O
3NaH2PO4 + 3AgNO3 → Ag3PO4↓ + 3NaNO3 + 2H3PO4 ПрименениеДигидрофосфат натрия является массовым продуктом химической промышленности. Типичная цена составляет порядка 800$/т.
Источник | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||