Гидролиз
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.
Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉
По катиону, по аниону или нет гидролиза?
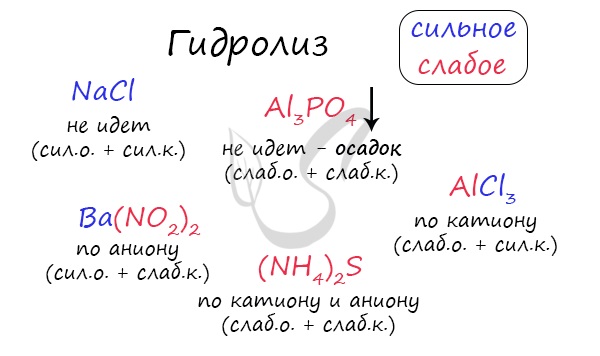
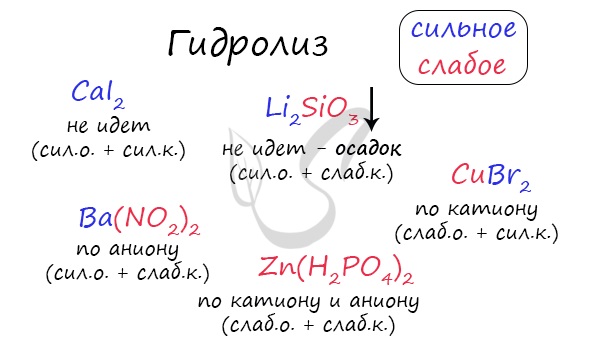
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
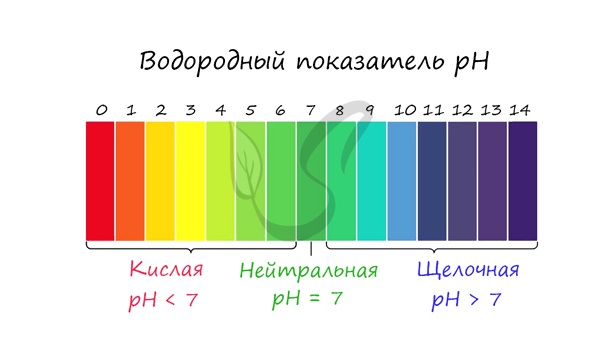
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH
Источник
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Теория к заданию 23 из ЕГЭ по химии
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза (от греч. hydro — вода, lysis — распад, разложение).
Гидролиз — это реакция обменного разложения вещества водой.
Гидролизу подвергаются различные вещества: неорганические — соли, карбиды и гидриды металлов, галогениды неметаллов; органические — галогеналканы, сложные эфиры и жиры, углеводы, белки, полинуклеотиды.
Водные растворы солей имеют разные значения рН и различные типы сред — кислотную ($рН 7$), нейтральную ($рН = 7$). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу.
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов $Н^<+>$ или $ОН^<->$, и раствор соли становится кислотным или щелочным соответственно.
Классификация солей
Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, соль $KClO$ образована сильным основанием $KOH$ и слабой кислотой $HClO$.
В зависимости от силы основания и кислоты можно выделить четыре типа солей.
Рассмотрим поведение солей различных типов в растворе.
1. Соли, образованные сильным основанием и слабой кислотой.
Например, соль цианид калия $KCN$ образована сильным основанием $KOH$ и слабой кислотой $HCN$:
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения
2) полная диссоциация соли (сильного электролита):
Образующиеся при этих процессах ионы $Н^<+>$ и $CN^<->$ взаимодействуют между собой, связываясь в молекулы слабого электролита — цианистоводородной кислоты $HCN$, тогда как гидроксид — ион $ОН^<->$ остается в растворе, обусловливая тем самым его щелочную среду. Происходит гидролиз по аниону $CN^<->$.
Запишем полное ионное уравнение происходящего процесса (гидролиза):
Этот процесс обратим, и химическое равновесие смещено влево (в сторону образования исходных веществ), т.к. вода — значительно более слабый электролит, чем цианистоводородная кислота $HCN$.
Уравнение показывает, что:
а) в растворе есть свободные гидроксид-ионы $ОН^<->$, и концентрация их больше, чем в чистой воде, поэтому раствор соли $KCN$ имеет щелочную среду ($рН > 7$);
б) в реакции с водой участвуют ионы $CN^<->$, в таком случае говорят, что идет гидролиз по аниону. Другие примеры анионов, которые участвуют в реакции с водой:
| $HCOO^<–>, CH_3COO^<–>, NO_2^<–>$ | от слабых кислот — муравьиной $HCOOH$, уксусной $CH_3COOH$, азотистой $HNO_2$ |
| $S^<2->, CO_3^<2->, SO_3^<2->, PO_4^<3->$ | от слабых кислот — сероводородной $H_2S$, угольной $H_2CO_3$, сернистой $H_2SO_3$, ортофосфорной $H_3PO_4$ |
Рассмотрим гидролиз карбоната натрия $Na_2CO_3$.
Происходит гидролиз соли по аниону $CO_3^<2->$.
Полное ионное уравнение гидролиза:
Сокращенное ионное уравнение гидролиза:
Продукты гидролиза — кислая соль $NaHCO_3$ и гидроксид натрия $NaOH$.
Среда водного раствора карбоната натрия — щелочная ($рН > 7$), потому что в растворе увеличивается концентрация ионов $ОН^<->$. Кислая соль $NaHCO_3$ тоже может подвергаться гидролизу, который протекает в очень незначительной степени, и им можно пренебречь.
Подведем итог тому, что вы узнали о гидролизе по аниону:
а) по аниону соли, как правило, гидролизуются обратимо;
б) химическое равновесие в таких реакциях сильно смещено влево;
в) реакция среды в растворах подобных солей щелочная ($рН > 7$);
г) при гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
2. Соли, образованные сильной кислотой и слабым основанием.
Рассмотрим гидролиз хлорида аммония $NH_4Cl$.
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения:
2) полная диссоциация соли (сильного электролита):
Образующиеся при этом ионы $OH^<->$ и $NH_4^<+>$ взаимодействуют между собой с получением $NH_3·H_2O$ (слабый электролит), тогда как ионы $Н^<+>$ остаются в растворе, обусловливая тем самым его кислотную среду.
Полное ионное уравнение гидролиза:
Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, т.к. вода $Н_2О$ — значительно более слабый электролит, чем гидрат аммиака $NH_3·H_2O$.
Сокращенное ионное уравнение гидролиза:
Уравнение показывает, что:
а) в растворе есть свободные ионы водорода $Н^<+>$, и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет кислотную среду ($рН 7)
Неоценима биологическая роль гидролиза некоторых солей, входящих в состав нашего организма. Например, в состав крови входят соли гидрокарбонат и гидрофосфат натрия. Их роль заключается в поддержании определенной реакции среды. Это происходит за счет смещения равновесия процессов гидролиза:
Если в крови избыток ионов $Н^<+>$, они связываются с гидроксид-ионами $ОН^<->$, и равновесие смещается вправо. При избытке гидроксид-ионов $ОН^<->$ равновесие смещается влево. Благодаря этому кислотность крови здорового человека колеблется незначительно.
Другой пример: в составе слюны человека есть ионы $HPO_4^<2->$. Благодаря им в полости рта поддерживается определенная среда ($рН=7-7.5$).
Источник
Урок №14. Гидролиз
Гидролизом называется процесс разложения вещества водой («гидро» — вода, «лизис» — разложение).
Гидролизу подвергаются как неорганические, так и органические вещества в результате обменной реакции между молекулами воды и вещества. Реакции гидролиза могут протекать как обратимо, так и необратимо.
Примеры гидролиза
Неорганических веществ
CH 3 COONH 4 +H 2 O↔CH 3 COOH+NH 4 OH
Органических веществ
CH 3 COOCH 3 +H 2 O↔CH 3 COOH+CH 3 OH
C 2 H 5 ONa+H 2 O↔C 2 H 5 OH+NaOH
CH 2 (NH 2 )-CO-NH-CH 2 -COOH+H 2 O↔2CH 2 (NH 2 )-COOH
Количественно гидролиз характеризуется безразмерной величиной h , называемой степенью гидролиза и показывающей, какая часть молекул растворяемого вещества (от общего количества, принятого за единицу или 100%) подвергается гидролизу:
, где n — число молекул, подвергшихся гидролизу,
N — общее число молекул вещества до начала гидролиза
Факторы, влияющие на степень гидролиза
Степень гидролиза зависит от:
природы растворяемого вещества
1). Гидролиз эндотермическая реакция, поэтому повышение температуры усиливает гидролиз.
2). Чем меньше концентрация соли, тем выше степень ее гидролиза. При разбавлении водой равновесие смещается в сторону протекания реакции, т.е. вправо, степень гидролиза возрастает.
3). Повышение концентрации ионов водорода ослабляет гидролиз, в случае гидролиза по катиону. Аналогично, повышение концентрации гидроксид-ионов ослабляет гидролиз, в случае гидролиза по аниону.
4). Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции. Так, при добавлении к раствору сульфата меди
2CuSO 4 + 2H 2 O (CuOH) 2 SO 4 + H 2 SO 4
раствора гидроксида натрия, содержащиеся в нем гидроксид-ионы будут взаимодействовать с ионами водорода. В результате их концентрация уменьшится, и, по принципу Ле Шателье, равновесие в системе сместится вправо, степень гидролиза возрастет. А если к тому же раствору добавить раствор сульфида натрия, то равновесие сместится не вправо, как можно было бы ожидать (взаимное усиление гидролиза) а наоборот, влево, из-за связывания ионов меди в практически нерастворимый сульфид меди.
5). Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается.
Al(NO 3 ) 3
Соль гидролизуется по катиону. Усилить гидролиз этой соли можно, если:
нагреть или разбавить раствор водой;
добавит раствор щёлочи (NaOH);
добавить раствор соли, гидролизующейся по аниону Nа 2 СО 3 ;
Ослабить гидролиз этой соли можно, если:
растворение вести на холоду;
готовить как можно более концентрированный раствор Al(NO 3 ) 3 ;
добавить к раствору кислоту, например HCl
Гидролиз солей многокислотных оснований и многоосновных кислот проходит ступенчато
Например, гидролиз хлорида железа (II) включает две ступени:
FeCl 2 + H 2 O FeOHCl + HCl
Fe 2+ + 2Cl — + H 2 O (FeOH) + + 2Cl — + H +
Fe(OH)Cl + H 2 O Fe(OH) 2 + HCl
(FeOH) + + Cl — + H 2 O Fe(ОН) 2 + Н + + Cl —
Гидролиз карбоната натрия включает две ступени:
Nа 2 СО 3 + H 2 O NаНСО 3 + NаОН
СО 3 2- + 2Na + + H 2 O НСО 3 — + ОН — + 2Na +
NаНСО 3 + Н 2 О NаОН + Н 2 СО 3
НСО 3 — + Na + + H 2 O Н 2 СО 3 + ОН — + Na +
Гидролиз — процесс обратимый. Повышение концентрации ионов водорода и гидроксид-ионов препятствует протеканию реакции до конца. Параллельно с гидролизом проходит реакция нейтрализации, когда образующееся слабое основание (Fe(ОН) 2 ) взаимодействует с сильной кислотой, а образующаяся слабая кислота (Н 2 СО 3 ) — со щелочью.
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота:
Al 2 S 3 + 6H 2 O =>2Al(OH) 3 ↓+ 3H 2 S↑
Cоли, полностью разлагаемые водой — Al 2 S 3 , нельзя получить по реакции обмена в водных растворах, так как вместо обмена протекает реакция совместного гидролиза:
2AlCl 3 +3Na 2 S≠Al 2 S 3 +6NaCl
2AlCl 3 +3Na 2 S+6H 2 O=2Al(OH) 3 ↓+6NaCl+3H 2 S↑ (взаимное усиление гидролиза)
Поэтому их получают в безводных средах спеканием или другими способами, например:
2Al+3S = t°C =Al 2 S 3
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) и растворимые карбонаты/гидрокарбонаты.
При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl 2 + 2Na 2 CO 3 + H 2 O = Mg 2 (OH) 2 CO 3 + 4NaCl + CO 2
Обратите внимание: (соли Ca 2+ , Sr 2+ , Ba 2+ и Fe 2+ ) – в этом случае протекает обменный процесс:
CaCl 2 + Na 2 CO 3 = CaCO 3 + 2NaCl,
Взаимный гидролиз , протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза ( совместный или взаимный гидролиз). Соли металлов со степенью окисления +3 (Al 3+ , Cr 3+ ) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H 2 S, SO 2 , CO 2 ):
2AlCl 3 + 3K 2 S +6H 2 O = 2Al(OH) 3 + 3H 2 S↑ + 6KCl
2CrCl 3 + 3K 2 CO 3 + 3H 2 O = 2Сr(ОН) 3 + 3СO 2 + 6KCl
2AlCl 3 + 3Na 2 SO 3 + 3Н 2 О=2Al(ОН) 3 + 6NaCl + 3SО 2
2AlCl 3 + 3Na 2 S + 3Н 2 О=2Al(ОН) 3 + 6NaCl + 3H 2 S
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl 3 + 3K 2 CO 3 + 3H 2 O = 2Fe(ОН) 3 + 3СO 2 + 6KCl
Обратите внимание: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl 3 + 3K 2 S (изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO 2 Cl 2 + 2 H 2 O = H 2 SO 4 + 2 HCl,
SOCl 2 + 2 H 2 O = H 2 SO 3 + 2HCl,
PCl 5 + 4 H 2 O = H 3 PO 4 + 5HCl,
CrO 2 Cl 2 + 2H 2 O = H 2 CrO 4 + 2HCl,
PCl 5 + 8NaOH = Na 3 PO 4 + 5NaCl + 4H 2 O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl 3 + 3H 2 O = H 3 PO 4 + 3HCl
Примеры реакций гидролиза
(NH 4 ) 2 CO 3 карбонат аммония – соль, слабой кислоты и слабого основания. Растворима. Гидролизуется по катиону и аниону одновременно. Число ступеней – 2.
1 ступень: (NH 4 ) 2 CO 3 +H 2 O↔NH 4 OH+NH 4 HCO 3
2 ступень: NH 4 HCO 3 +H 2 O↔NH 4 OH+H 2 CO 3
Реакция раствора слабощелочная pH>7, т.к гидроксид аммония более сильный электролит, чем угольная кислота. К д (NH 4 OH)>К д (H 2 CO 3 )
CH 3 COONH 4 ацетат аммония – соль, слабой кислоты и слабого основания. Растворима. Гидролизуется по катиону и аниону одновременно. Число ступеней – 1.
CH 3 COONH 4 +H 2 O↔NH 4 OH+СH 3 COOH
Реакция раствора нейтральная pH=7, т.к К д (CH 3 COOН)=К д (NH 4 OH)
K 2 HPO 4 – гидроортофосфат калия — соль, слабой кислоты и сильного основания. Растворима. Гидролизуется по аниону. Число ступеней – 2.
1 ступень: K 2 HPO 4 +H 2 O↔KH 2 PO 4 +KOH
2 ступень: KH 2 PO 4 +H 2 O↔H 3 PO 4 +KOH
Реакция раствора 1 ступени слабощелочная pH=8,9, так как в результате гидролиза в растворе накапливаются ионы OH — и процесс гидролиза преобладает над процессом диссоциации ионов HPO 4 2- , дающим ионы H + (HPO 4 2- ↔H + +PO 4 3- )
Реакция раствора 2 ступени слабокислая pH=6,4, так как процесс диссоциации дигидроортофосфат ионов преобладает над процессом гидролиза, при этом ионы водорода не только нейтрализуют гидроксид-ионы, но и остаются в избытке, что и обуславливает слабокислую реакцию среды.
Задача: Определите среду растворов гидрокарбоната и гидросульфита натрия.
Решение:
1) Рассмотрим процессы в растворе гидрокарбоната натрия. Диссоци а ция этой соли идёт в две ступени, катионы водорода образуются на второй ступени:
NaHCO 3 = Na + + HCO 3 — (I)
HCO 3 — ↔ H + + CO 3 2- (II)
Константа диссоциации по второй ступени — это К 2 угольной кислоты, равная 4,8∙10 -11 .
Гидролиз гидрокарбоната натрия описывается уравнением:
NaHCO 3 +H 2 O↔H 2 CO 3 +NaOH
HCO 3 — +H 2 O↔H 2 CO 3 +OH — , константа которого равна
K г =K w /K 1 (H 2 CO 3 )=1∙10 -14 /4,5∙10 -7 =2,2∙10 -8 .
Константа гидролиза заметно больше константы диссоциации, поэтому раствор NaHCO 3 имеет щелочную среду.
2) Рассмотрим процессы в растворе гидросульфита натрия. Диссоци а ция этой соли идёт в две ступени, катионы водорода образуются на второй ступени:
NaHSO 3 = Na + + HSO 3 — (I)
HSO 3 — ↔ H + + SO 3 2- (II)
Константа диссоциации по второй ступени — это К 2 сернистой кислоты, равная 6,2∙10 -8 .
Гидролиз гидросульфита натрия описывается уравнением:
NaHSO 3 +H 2 O↔H 2 SO 3 +NaOH
HSO 3 — +H 2 O↔H 2 SO 3 +OH — , константа которого равна
K г =K w /K 1 (H 2 SO 3 )=1∙10 -14 /1,7∙10 -2 =5,9∙10 -13 .
В этом случае константа диссоциации больше константы гидролиза, поэтому раствор NaHSO 3 имеет кислую среду.
Задача: Определить среду раствора соли цианида аммония.
Решение:
NH 4 + + 2H 2 O↔NH 3 . H 2 O + H 3 O +
CN – + H 2 O↔HCN + OH –
NH 4 CN +H 2 O ↔ NH 4 OH+ HCN
К д (HCN) =7.2∙10 -10 ; К д (NH 4 OH) =1.8∙10 -5
Ответ: Гидролиз по катиону и аниону, т.к. K o > K к , слабощелочная среда, pH > 7
Источник