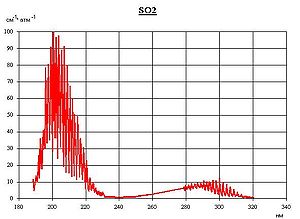
- Оксид серы (IV)
- Cпособы получения оксида серы (IV)
- Химические свойства оксида серы (IV)
- Двуокись серы
- Содержание
- Получение
- Химические свойства
- Применение
- Физиологическое действие
- Дополнительные сведения о токсичности
- Полезное
- Смотреть что такое «Двуокись серы» в других словарях:
- Основные свойства оксида серы 4, с какими веществами взаимодействует
- Оксид серы (IV) или диоксид — что это за вещество
- Основные физические и химические свойства, с какими веществами взаимодействует
- Качественные реакции, как проходит горение
- Как получить, особенности применения
Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
Например , взаимодействие меди с концентрированной серной кислотой:
Химические свойства оксида серы (IV)
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Источник
Двуокись серы
Двуокись серы
| Оксид серы(IV) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид серы(IV) |
| Химическая формула | SO2 |
| Отн. молек. масса | 64.054 а. е. м. |
| Молярная масса | 64.054 г/моль |
| Физические свойства | |
| Плотность вещества | 2,927 г/л г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −75,5 °C |
| Температура кипения | −10,01 °C |
| Химические свойства | |
| Растворимость в воде | 11,5 г/100 мл |
| Классификация | |
| номер CAS | [7446-09-5] |
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO2 — один из основных компонентов вулканических газов.
Содержание
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты:
Образующаяся сернистая кислота сразу разлагается на SO2 и H2O:
Также можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
Химические свойства
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
Со щелочами образует сульфиты:
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°),
Последняя реакция является качественной реакцией на сульфит-ион SO3 2- и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
Или для получения фосфорноватистой кислоты:
Применение
В пищевой промышленности диоксид серы используется как консервант и обозначается на упаковке под кодом Е220.
Физиологическое действие
SO2 токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, першение в горле. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
- ПДК максимально-разового воздействия — 0,5 мг/м 3
Дополнительные сведения о токсичности
Интересно, что чувствительность по отношению к SO2 весьма различна как у людей, так и у растений. Наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — сосна и ель. Наиболее чувствительными к SO2 являются розы. При попадании на них сернистого газа они моментально белеют.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Двуокись серы» в других словарях:
двуокись серы — Сера, Двуокись серы Универсальное дезинфицирующее средство, чаще всего применяемое виноделами для предотвращения уксусного брожения, а при производстве белых вин дополнительно для защиты от вредных бактерий. * * * (Источник: «Объединенный… … Кулинарный словарь
двуокись серы — сернистый газ, сернистый ангидрид … Cловарь химических синонимов I
серы двуокись — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
серы диоксид — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
серы(IV) оксид — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
СЕРЫ СОЕДИНЕНИЯ — серы соединения, применяются в сельском хозяйстве для борьбы с болезнями и вредителями растений, болезнями животных, при химическом консервировании кормов, растительных продуктов, а также в качестве удобрения. Для животных токсичны: сернистый… … Ветеринарный энциклопедический словарь
Двуокись титана — Порошок оксида титана Оксид титана(IV) (диоксид титана, двуокись титана, титановые белила, пищевой краситель E171) TiO2 амфотерный оксид четырёхвалентного титана. Является основным продуктом титановой индустрии (на производство чистого титана… … Википедия
Двуокись — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
СОЛНЕЧНАЯ СИСТЕМА — Солнце и обращающиеся вокруг него небесные тела 9 планет, более 63 спутников, четыре системы колец у планет гигантов, десятки тысяч астероидов, несметное количество метеороидов размером от валунов до пылинок, а также миллионы комет. В… … Энциклопедия Кольера
1-Экологическое состояние городов России — Экологическое состояние (ЭС) совокупность условий среды обитания и жизнедеятельности населения города (состояния атмосферного воздуха, вод, почв, растительности и др.), определяемых воздействием природных и антропогенных (производственных … Города России
Источник
Основные свойства оксида серы 4, с какими веществами взаимодействует
Оксид серы (IV) или диоксид — что это за вещество
Оксид серы (IV) является кислотным оксидом, бесцветным газообразным веществом, обладающим резким запахом (как у загорающейся спички) и хорошо растворимым в воде.
Источник: wikipedia.org Источник: wikipedia.org
Химическая формула диоксида серы:
Основные физические и химические свойства, с какими веществами взаимодействует
Вещество S O 2 под названием сернистый газ является ядовитым. Диоксид серы тяжелее воздуха более чем в два раза. При комнатной температуре в одном объеме воды растворяется примерно 40 объемов сернистого газа, что сопровождается образованием сернистой кислоты H 2 S O 3 . При повышении давления при комнатной температуре вещество сжижается. Оксид серы (IV) представляет собой один из основных компонентов вулканических газов.
Физические характеристики оксида серы (IV):
- бесцветный газ;
- растворяется в воде, этаноле, серной кислоте;
- молярная масса — 64,054 г/моль;
- плотность — 0,002927 г/см^3;
- энергия ионизации — 12,3 ± 0,1 эВ;
- температура плавления: –75,5°C;
- температура кипения: –10,01°C.
Оксид серы (IV) относится к кислотным оксидам. Благодаря содержанию в веществе серы в степени окисления + 4 S O 2 способен играть роль и окислителя, и восстановителя в химических реакциях.
Являясь кислотным оксидом, сернистый газ вступает в химические реакции со щелочами и оксидами щелочных и щелочноземельных металлов.
Взаимодействие оксида серы (IV) с гидроксидом натрия сопровождается образованием либо кислой соли (при условии избытка сернистого газа), либо средней соли (если щелочь в избытке):
S O 2 + 2 N a O H ( и з б ) → N a 2 S O 3 + H 2 O
S O 2 ( и з б ) + N a O H → N a H S O 3
Уравнение реакции оксида серы (IV) с основным оксидом натрия:
S O 2 + N a 2 O → N a 2 S O 3
В процессе реакции оксида серы (IV) с водой образуется сернистая кислота. Данный процесс является обратимым. Это связано со способностью сернистой кислоты распадаться в значительной степени в водном растворе, что приводит к образованию оксида и воды.
S O 2 + H 2 O ↔ H 2 S O 3
У S O 2 наиболее ярко выражены восстановительные свойства. В процессе взаимодействия вещества с окислителями повышается степень окисления серы.
Окисление оксида серы кислородом на катализаторе в жестких условиях (процесс является обратимым):
2 S O 2 + O 2 ↔ 2 S O 3
Обесцвечивание бромной воды сернистым ангидридом:
S O 2 + B r 2 + 2 H 2 O → H 2 S O 4 + 2 H B r
Процесс окисления сернистого газа с помощью азотной кислоты протекает легко:
S O 2 + 2 H N O 3 → H 2 S O 4 + 2 N O 2
Процесс окисления оксида серы (IV) с помощью озона:
S O 2 + O 3 → S O 3 + O 2
Окисление сернистого газа оксидом свинца (IV):
S O 2 + P b O 2 → P b S O 4
При контакте с сильными восстановителями S O 2 может проявлять окислительные свойства.
Взаимодействие с сероводородом приводит к восстановлению сернистого газа до молекулярной серы:
S O 2 + 2 Н 2 S → 3 S + 2 H 2 O
Окисление оксидом серы (IV) угарного газа и углерода:
S O 2 + 2 C O → 2 С О 2 + S
S O 2 + С → S + С O 2
Качественные реакции, как проходит горение
Качественная реакция на сернистый газ и на сульфит-ион представляет собой процесс обесцвечивания раствора перманганата калия:
5 S O 2 + 2 H 2 O + 2 K M n O 4 → 2 H 2 S O 4 + 2 M n S O 4 + K 2 S O 4
Двуокись серы является продуктом горения серы или горящих материалов, в состав которых входит сера:
Δ H = − 297 к Д ж / м о л ь
С целью повышения интенсивности горения сжиженную серу (140-150°C, 284–302°F) распыляют с помощью специальной насадки, что приводит к образованию мелких капель серы, обладающих большой площадью поверхности. Реакция является экзотермической. В процессе температура повышается до 1000-1600°C. Произведенное тепло по большей части утилизируют с помощью производства пара, который в дальнейшем может быть преобразован в электрическую энергию. Сходным образом происходит горение сероводорода и сероорганических соединений. К примеру:
2 Н 2 S + 3 О 2 → 2 Н 2 О + 2 S O 2
В процессе обжига сульфидных руд, например, пирита, сфалерита и сульфида ртути, аналогично происходит выделение :
4 F e S 2 + 11 O 2 → 2 F e 2 O 3 + 8 S O 2
2 Z n S + 3 O 2 → 2 Z n O + 2 S O 2
H g S + O 2 → H g + S O 2
4 F e S + 7 O 2 → 2 F e 2 O 3 + 4 S O 2
Данные реакции, протекающие при извержении вулканов, в комплексе служат наиболее крупным источником диоксида серы. В результате таких явлений может происходить выброс миллионов тонн S O 2 .
Как получить, особенности применения
Существуют разные способы получения оксида серы (IV).
Сжигание серы на воздухе:
Горение сульфидов и сероводорода:
2 H 2 S + 3 O 2 → 2 S O 2 + 2 H 2 O
2 C u S + 3 O 2 → 2 S O 2 + 2 C u O
Оксид серы (IV) получают в результате реакции взаимодействия сульфитов с более сильными кислотами. В качестве примера можно привести реакцию сульфита натрия с серной кислотой:
N a 2 S O 3 + H 2 S O 4 → N a 2 S O 4 + S O 2 + H 2 O
При обработке концентрированной серной кислотой неактивных металлов получают S O 2 . К примеру, такой результат можно наблюдать при взаимодействии меди с концентрированной серной кислотой:
C u + 2 H 2 S O 4 → C u S O 4 + S O 2 + 2 H 2 O
Сферы применения оксида серы (IV):
- текстильная промышленность, отбеливание различных изделий и материалов, чувствительных к хлору;
- сельское хозяйство, борьба с вредными микроорганизмами, обработка теплиц, погребов, овощехранилищ и складов;
- виноделие, S O 2 применяют как консервант в виде пищевой добавки Е 220 ;
- извлечение серы из отходящих газов металлургической промышленности;
- получение различных солей сернистой кислоты.
Источник