Синтез воды Образование воды при горении
Синтез воды это
Это химические реакции взаимодействия атомов кислорода с атомами водорода, причем в результате синтеза воды образуется большое количество энергии в виде взрыва.
Образование воды при горении водорода в кислороде (воздухе) послужило доказательством состава воды как сложного вещества, состоящего из двух химических элементов — водорода и кислорода.
Схема установки для синтеза воды из простых веществ изображена на рисунке 2.
Приступая к выполнению опыта в собранной установке, прежде всего убеждаются в чистоте водорода, после чего его поджигают на конце Г-образной трубки 1, подводя ее под воронку 2. Включают водоструйный насос 4, соединенный с предохранительной двугорлой склянкой 5. Через некоторое время в дугообразной трубке 3 собирается немного жидкости. Водоструйный насос останавливают и прекращают ток водорода.
Образовавшийся продукт реакции идентифицируют, внося в приемник небольшое количество безводного сульфата меди. Появление голубого окрашивания (образование медного купороса) свидетельствует о том, что полученная в опыте жидкость — вода.

Для опытов собирают установку согласно рисунку 3. В качестве реактора используют со суд без дна (рис. 3, а) из набора НПХ или универсальную го релку (рис. 3,6).
Горение водорода в кислороде
Водород из прибора для получения газов 1 проверяют начистоту. Заполняют реактор 2 кислородом из газометра 3. Проверяют наполнение реактора 2 кислородом, поднося к его отверстию тлеющую лучинку. Поджигают водород на конце газоотводной трубки, не прекращая подачи кислорода из газометра.

Рис. 3. Установка для сжигания водорода и кислорода друг в друге:
а —горение водорода в кислороде: 1 — прибор для получения газов, 2 — реактор, 3 — газометр; б — универсальная горелка; в — горение кислорода в водороде.
Если пламя кислорода внутри реактора 2 погасло, немедленно закрывают кран аппарата для получения водорода. Повторять опыт можно после остывания колокола-реактора.
Чтобы установить, в каких объемных отношениях водород и кислород взаимодействуют с образованием паров воды, берут для взрыва определенные объемы газов и после реакции устанавливают, какой газ остался неизрасходованным и какой он занимал объем. Опыт проводят в эвдиометре — толстостенной трубке с дном и впаянными электродами. В настоящее время промышленный эвдиометр не может быть использован в школе из-за отсутствия безопасного высоковольтного преобразователя, который сейчас разрабатывается.
В качестве индуктора может быть использован пьезоэлектрический высоковольтный преобразователь . Верхний конец этой трубки плотно закрыт резиновой пробкой через которую продеты две проволоки. Верхние концы их присоединены вилке для подключения к источник тока (в сеть), а нижние концы загнуты. В них продета и укреплена тон чайшая медная проволочка-волосок В нижний конец трубки вставлена ре зиновая пробка 5 с узким отверстием, чтобы уменьшить поток воды в трубку (после взрыва) и таким образом предотвратить возможность выброса верхней пробки. Пробка не должна доходить до дна чаши 6 на 4—5 мм.

Взрыв кислородно-водородной смеси можно осуществить с помощью пьезоэлектрического источника электрического тока, используя насадку для воспламенения газов.
Если для взрыва были взяты одинаковые объемы кислорода и водорода, то после реакции остался один объем кислорода, (это доказывается вспыхиванием тлеющей лучинки). Следовательно, объемы вступающих в реакцию газов — водорода и кислорода—относятся как 2:1. Принимают во внимание, что кислород в 16 раз тяжелее водорода (это видно из сравнения плотности 1,44:0,089=16:1) и что соотношение объемов кислорода и водорода 1:2. Делают вывод, что массовые отношения этих эле ментов в воде 16:2, или 8 : 1 (или 88,9% О и 11,1 % Н).
Рис. 4. Установка для синтеза воды в искровом разряде:
1 — трубка-реактор, 2 —электроды, 3 — трубка с зажимом, 4 — воронка.
Для этого опыта и для разложения метана в искровом разряде можно использовать установку, изображенную на рисунке 4. Реактор 1, разделенный на четыре равные по объему части, заполняют водой через воронку 4 до появления капель воды из трубки при открытом зажиме 3. Затем реактор 1 через верхнюю трубку с зажимом 3 заполнят сначала двумя объемами водорода (из аппарата Киппа), а затем двумя объемами кислорода (из газометра). Электроды присоединяют к источнику тока. Вместо выпрямителя ВС-24М (В-24) можно использовать батарейку КБС. Искра получается при повороте одного из электродов на 180° до замыкания и размыкания цепи. После взрыва наличие оставшегося кислорода доказывают по воспламенению тлеющей лучинки, поднесенной к отверстию трубки 3. Для вытеснения кислорода из реактора воронку поднимают вверх при открытом зажиме.
Меры предосторожности. Перед наполнением реактора водород проверяют на чистоту. Во избежание выплескивания при взрыве воды из воронки ее накрывают листом мокрой фильтровальной бумаги.
Определение содержания кислорода в воздухе
Эксперименты по определению состава воздуха сыграли важную роль в развитии химии как науки, что нашло отражение и в учебной литературе по химии. Разработаны в связи с этим многочисленные учебные опыты по определению состава воздуха. Все они основаны на том, что воздух состоит из двух основных компонентов: один из них легко вступает во многие химические реакции (кислород), тогда как второй компонент смеси (атмосферный азот)—вещество Значительно менее реакционноспособное. Для демонстрации малопригодны исторические опыты с использованием электрических разрядов и поглощением образовавшихся оксидов азота ввиду их сложности и длительности. В учебных опытах используют для связывания кислорода легкоокисляющееся вещество — фосфор.
Сжигание фосфора в закрытом пространстве (стеклянный колпак-колокол, склянка с отрезанным дном) — традиционный школьный опыт,для определения состава воздуха. Техника выполнения этого опыта приведена во многих руководствах по химическому эксперимент, а также в школьных учебниках по химии, Этим способом состав воздуха определяют приблизительно.
Содержание кислорода в воздухе можно определить, если вме сте фосфора использовать медь (рис. 30). Простейший опыт состоит в нагревании порошка меди, помещенного на дно пробирки 1, градуированной на 5 равных частей и плотно закрытой ре зиновой пробкой с газоотводной трубкой, опущенной в стакан с водой. При нагревании кислород, содержащийся в пробирке 1, соединяется с медью. После охлаждения пробирки при открытом кране 2 вода засасывается на 1 /5 часть ее вместимости. Более точные результаты могут быть получены при использовании усовершенствованной установки опыт проводят в двух градуированных цилиндрах 1, 5 объемом по 500 мл каждый. В трубке помещена «колбаска» из свеже-восстановленной медной сетки.
Левый цилиндр 1 заполонен воздухом, правый — подкрашенной водой и погружен вверх дном в чашу с водой. Делительную воронку 2 заполняют водой, а трубку с медной сеткой сильно нагревают. Выде ляющиеся пузырьки газа сразу не следует собирать в цилиндр. После того как выделение газа прекратилось, цилиндр помещают на газоотводную трубку. В левый цилиндр начинают приливать воду с такой скоростью, чтобы на вытес нение 500 мл воздуха потребовалось 10—15 мин. После приливания 500 мл воды кран воронки закрывают. В правом цилиндре 5 собирается только 4 /5 вытесненного объема воздуха.
Пробку с газоотводной трубкой 4 отделяют от реакционной трубки, после чего прекращают нагревание.
Заслуживают внимания опыты по определению состава воздуха с использованием медицинских шприцев. В настоящее время для учебных целей созданы специальные шприцы — стеклянные поршневые дозаторы. С их помощью могут быть выполнены многие количеств венные опыты, в том числе и по определению состава воздуха. Для наглядности их следует использовать при проецировании некоторых опытов на экран с помощью графопроектора .
Статья на тему Синтез воды
Источник
Как создать воду из водорода и кислорода
Вода — это общее название монооксида диоксида водорода или H2O .
Молекула образуется в результате многочисленных химических реакций, включая реакцию синтеза ее элементов, водорода и кислорода.
Сбалансированное химическое уравнение для реакции таково :
2 H2 + O2 + O2 → 2 H2O
Как сделать воду
Теоретически, легко сделать воду из водорода и кислорода.
Нужно смешать два вещества вместе, добавить достаточное количество тепла, чтобы обеспечить энергию активации для начала реакции.
Простое же смешивание двух газов при комнатной температуре, однако, ничего не даст, так как молекулы водорода и кислорода в воздухе не образуют спонтанно реакцию.
Для разрыва ковалентных связей, удерживающих молекулы H2 и O2 вместе, необходима энергия.
Затем катионы водорода и анионы кислорода свободно вступают в реакцию друг с другом, делают они это из-за различий в их электроотрицательности.
Когда химические связи восстанавливаются, образуя воду, высвобождается дополнительная энергия, которая распространяет реакцию. Чистая реакция является высоко экзотермической, т.е. реакцией, сопровождающейся выделением тепла.
Две демонстрации
Одной из распространенных химических демонстраций является наполнение небольшого воздушного шарика водородом и кислородом и прикосновение к воздушному шару — с расстояния и за щитом безопасности — горящей шиной.
Более безопасным вариантом является наполнение воздушного шара газом водорода и зажигание воздушного шара в воздухе.
Ограниченный кислород в воздухе реагирует на образование воды, но в более контролируемой реакции.
Еще одна простая демонстрация заключается в пузырьке водорода добавленного в мыльную воду.
Пузырьки плавают, потому что они легче воздуха.
Зажигалка с длинной рукояткой или горящая шина может быть использована для зажигания и образования воды.
Можно использовать водород из баллона со сжатым газом или в результате нескольких химических реакций ( например, реакции кислоты с металлом ).
Источник
Водород. Заблуждения
В завтрашний день могут смотреть не только лишь все. Мало кто может это делать!
Прочитанная недавно статья очередного эксперта по газу и водороду привела меня в неистовую печаль.
Настолько, что захотелось выматериться поделиться своими соображениями, о блуждающих в массах заблуждениях касательно водорода.
Очень часто при обсуждении вопроса производства, хранения и использования водорода, упираются в некие ограничения, которые в реальности таковыми не являются.
Например следующее утверждение:
Водород очень подвижный газ и потребует для развития водородной энергетики новых материалов уже прямо завтра. Отдельные комментаторы в интернетах указывают, что температура горения водорода очень высока и составляет 2500-2800 градусов и что не имеется в достаточном количестве необходимых материалов для широкого использования котлов на водороде и что эти материалы слишком дороги.
Во-первых, непонятно почему рассматривается сферический конь в вакууме рассмотрение горения не на воздухе, а в чистом кислороде? В аналогичных условиях, тот же метан развивает температуру до 2100-2200 град. С, что не намного ниже водородной температуры. Но это мелочи на фоне прочего.
Во-вторых, давайте рассмотрим ближайшие перспективные планы «водородных активистов», на период до 2030-го года.
From 2025 to 2030, hydrogen needs to become an intrinsic part of our integrated energy system, with at least 40 gigawatts of renewable hydrogen electrolysers and the production of up to ten million tonnes of renewable hydrogen in the EU.
Что в переводе на русский означает производство 10 млн тонн электролизного водорода в год.
Измерение топливного газа в массовых величинах с химической точки зрения более правильно, чем в объёмных, т.к. количество извлекаемой энергии зависит напрямую от массы вещества вступающей в реакцию горения, но поскольку многим привычней объёмные «попугаи», то для упрощения понимания переведём в них.
Ранее в сериале, рассматривая вопросы стимулирования энергоперехода, было прикинуто, что 1 кг водорода потенциально содержит 120 МДж энергии, что приблизительно эквивалентно 4-4,5 куб.м. метана, или 1 тыс. куб.м. метана энергетически эквивалентна 220-250 кг водорода. Таким образом, можно приблизительно оценить что 10 млн. тонн водорода это энергетический эквивалент 42,5 млрд. куб.м. метана.
Потребление Европы по данным Газпрома, оценивается в 500-550 млрд куб.м. в год, т.е. объём предполагаемого производства водорода к 2030г. предполагается на уровне 7-8% от потребляемого газа.
Mitsubishi Hitachi Power Systems (MHPS) еще несколько лет назад успешно испытала газовую турбину большой мощности на одной из своих электростанций, подав в камеру сгорания природный газ с добавкой 30% водорода. Температура газов на выходе – 1600 градусов, оборудование такую нагрузку, хоть и не без сложностей, но выдержало. КПД незначительно, но увеличился, а вот количество образовавшегося углекислого газа оказалось ниже сразу на 10%, а по поводу оксидов азота японская компания информацию раскрыла не полностью, ограничившись фразой «остались на приемлемом уровне». Рекомендация MHPS – экономически оправдано и экологически полезно использовать топливную смесь из 80% природного газа и 20% водорода.
Конечно неизвестно при каких условиях планируется рассматривать эти 10 млн, тонн, но инженерно этот газ имеет смысл приводит в то же состояние, что и метан. Плотность метана 670 гр/куб.м. плотность водорода 90 гр/куб.м. т.е. 10 млн. тонн в нормальных условиях дадут объём порядка 100 млрд. куб.м. или около 20% от объёма смеси, т.е. предполагаемый уровень использования водорода как-то случайно совпал с тем, что может «принять на хранение» природный газ и существующая инфраструктура. При этом температура горения остаётся в приемлемых рамках, не создавая видимых экспертам проблем водородного горения в кислороде.
Как видим из текущих планов на ближайшее время проблем хранения, транспортировки и сжигания нет.
А что есть? Как ранее уже обсуждалось, в настоящее время в мире производится 75 млн тонн водорода. Более ¾ производят методом реформинга природного газа и лишь около 100 тысяч тонн производится электролизом. При реализации планов увеличить за 8-9 лет производство электролизного водорода только в ЕС (не считая австралийских и американских планов) до уровня в 10 миллионов тонн означает по существу создание новой индустрии с нуля.
Вот она индустрия и «есть» к 2030-му году. Она же и будет финансировать НИОКР на повышение собственной эффективности, разрешение вопросов хранения и транспортировки чистого водорода уже в дальнейшем. Расширение масштабов производства техники снизит её стоимость, точно так же как снизилась себестоимость энергии от солнечных панелей (в 4 раза за 10 лет) и ветрогенераторов (на 20% за 10 лет).
Оксид азота (NOx)
Отдельно хочется остановиться и рассмотреть это заблуждение интернет-экспертов.
Довольно часто от некоторых комментаторов приходится слышать про то, как в процессе горения водорода будет высокая температура и начнёт резко окисляться азот из воздуха, который используется в процессе горения. Чаще всего ссылаются на механизм Зельдовича и что вот именно водородное-то горение его и запускает.
Механизм Зельдовича, описанный в 1947 году, представляет собой реакцию окисления атмосферного азота в топке, при высокой температуре. Начинается сей процесс уже при 1800-1850К, или примерно при 1550 град. С. т.е. при достижении указанной температуры (без разницы от сжигания дров, угля, метана или кизяка) начинается процесс окисления азота.
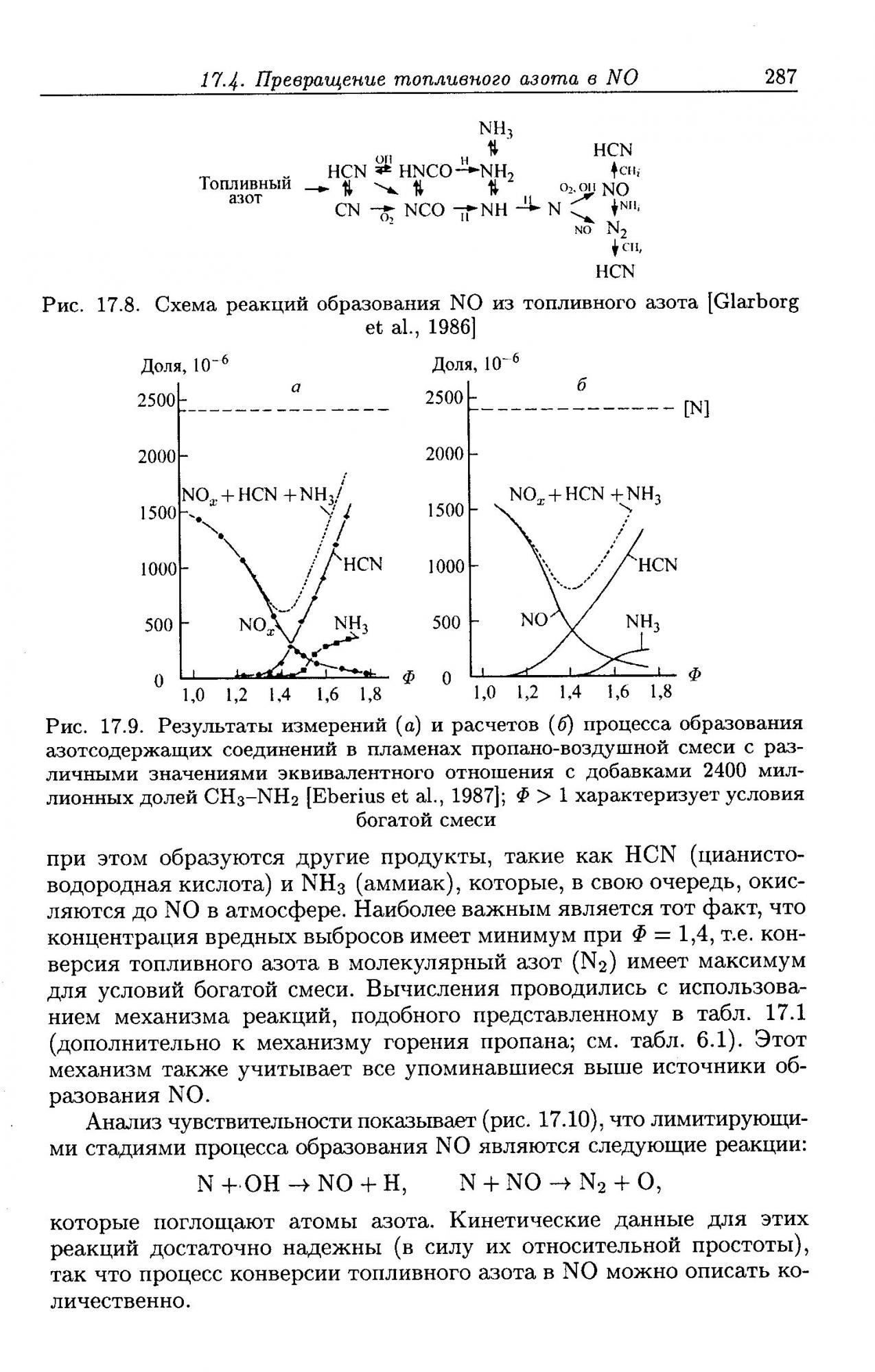
Общая схема выглядит примерно так:
N + OH NO + H (3) (добавлена по расчётам Ч. Фенимора в 1957 г.)
Совокупность реакций (1-3) называется расширенным механизмом Зельдовича. В силу того что энергия тройной связи в молекуле N2 составляет около 950 кДж/моль, реакция (1) имеет большую энергию активации и может проходить с заметной скоростью только при высоких температурах.
Существует ещё и механизм образования оксидов азота им. т-ща Фенимора (Чарльза, а не Купера 
Считаю неправильным останавливаться на полумерах и предлагаю всем обоср…. т.е. испугаться по взрослому и с размахом. Взять и рассмотреть ещё и механизм Фенимора в том числе.
Для этого возьмём и откроем скушную книшку, написанную двумя профессорами Штутгартского университета и ещё одним из университета Беркли:
Крайне интересного текста там немного, но а тем же, кому лень читать источник фиги или кто в принципе не хочет вникать, поясню коротко, тезисно и на пальцах:
- По причине наличия в углеводородном топливе СН- радикалов, при горении смесей в воздухе, образование оксидов азота начинается раньше, чем запускается механизм Зельдовича, уже при 750 град. С. Включается механизм быстрого образования NOx.
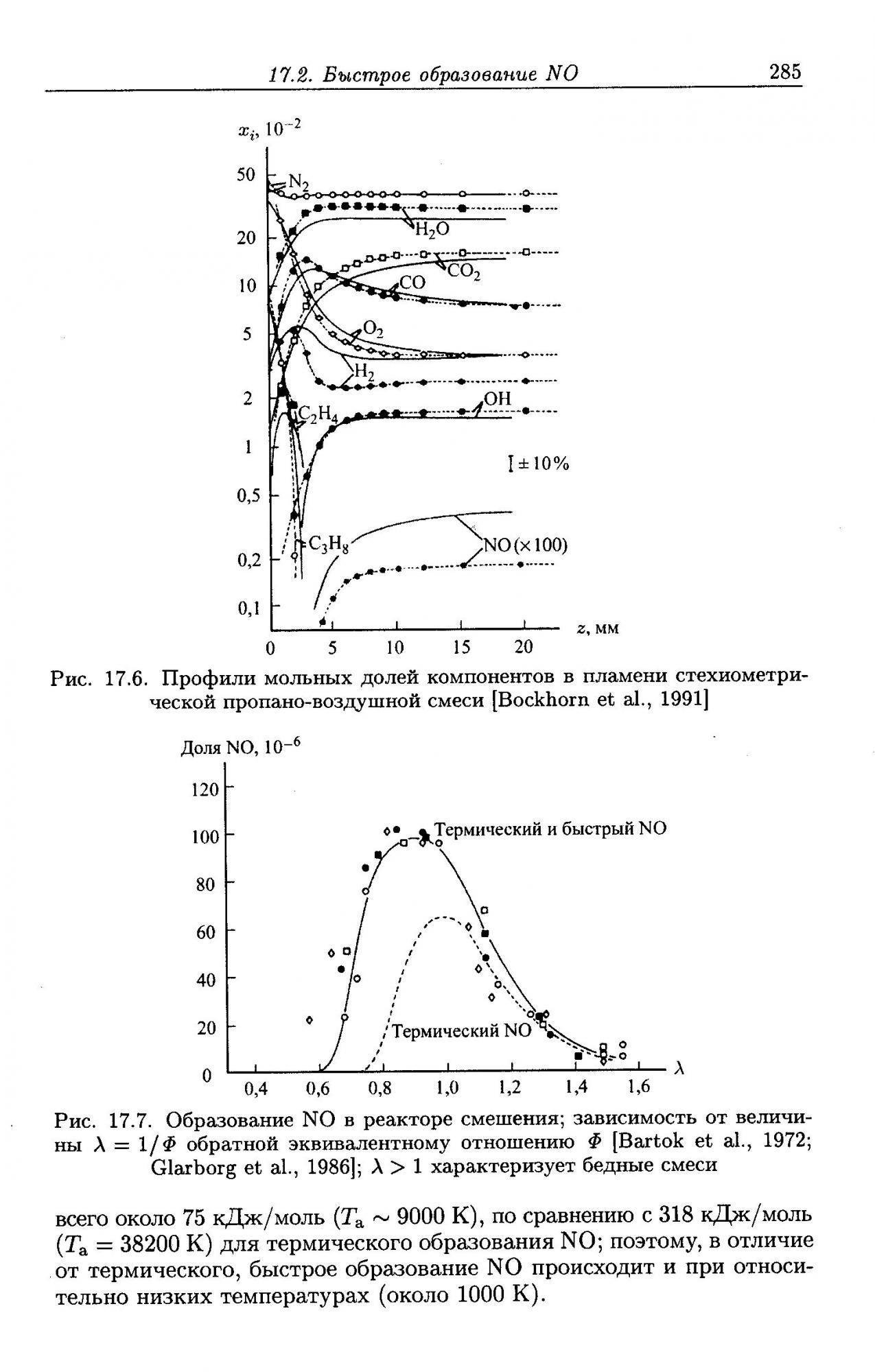
2. По причине 1 при сжигании углеводородного топлива (метан, этан, пропан, уголь, бензин, дрова и прочее без разницы) оксидов азота при горении выделяется больше, чем при горении водорода по механизму Зельдовича, причём больше существенно (см. рис. 17.7)
3. При горении углеводородных топлив, особенно угля, (где даже в особо чистых образцах имеется до 1% азота), содержащийся в топливе связанный азот окисляется вообще независимо от уровня температуры, тем самым увеличивая общий выхлоп оксидов азота.
4. При высокотемпературном сжигании природного газа, (что практикуется на мусоросжигательных заводах особенно, где разгоняют температуру до 2200-2300 град. С), промежуточно образуется HCN – синильная кислота. И хотя она лишь промежуточный продукт, но при высокой температуре может быть кинетически выброшена из зоны реакции и тем самым составит пусть и мизерную но часть выхлопа.
Не смотря на вышеуказанные проблемы образования оксида азота при сжигании природного газа и угля, не спешите хвататься за валидол.
Решение по уменьшению выхода оксидов азота имеются и применяются на существующих котельных и реакторных установках. Кроме указанных ранее способов регулировки температуры горения в топке, довольно широко применяется запатентованный в 1975 году компанией Exxon Research Engineering, метод селективного некаталитического восстановления водородом из аммиака, когда в выхлопную трубу в отводящие газы подаётся аммиак и в диапазоне температур от 800 до 1100 град. С и происходит восстановление азота по схеме:
4NO + 4NH3 + O2 => 4N2 + 6H2O
Поскольку водород очень хороший восстановитель, то при использовании чистого водорода, достаточно обеспечить камеру вторичного дожига, где отходящие выхлопные газы, содержащие CO и NOx будут восстанавливаться чистым водородом, без лишних танцев с бубном.
Источник